卒中后出血转化与炎症反应相关性研究
荆 玲,张 馨
(1.长春中医药大学临床医学院,吉林 长春 130117;2.吉林省人民医院,吉林 长春 130021)
出血转化是指脑梗死后患者首次头部CT/MRI未发现出血,再次头部CT/MRI检查发现颅内出血,或根据首次头部CT/MRI可以确定的出血性梗死[1]。近年来,国内针对卒中后出血转化的发病、诊断、治疗、预后评估等研究不断完善,但预后仍较差,早期诊断、早期治疗、早期预防非常重要。寻找高敏性生物学指标及时发现HT,并及时调整治疗方案,有助于减轻患者神经功能损伤,改善预后。目前国内关于CAR及CAR、NLR、PLR三者联合预测卒中后出血转化的报道较少,本研究采取回顾性研究,选取符合HT诊断标准的38例(血管介入组18例,静脉溶栓组20例)患者为HT组,另外选取卒中后无出血的患者53例作为对照组(非HT组),检测两组患者NLR、PLR、CAR水平,探讨NLR、CAR、PLR等炎性指标与HT的相关性。
1 资料与方法
1.1 一般资料
回顾性分析 2019年9月—2023年2月吉林省人民医院神经内科符合HT诊断标准的38例(血管介入组18例,静脉溶栓组20例)患者为HT组,其中男26例,女12例,年龄45~93岁,平均(67.24±10.21)岁。另外选择卒中后无出血的患者53例作为非HT组,其中男24例,女29例,年龄39~86岁,平均(67.13±10.82)岁。
纳入标准:符合中华医学会修订的《急性缺血性脑卒中的诊断》[1];脑梗死后首次头颅CT/MRI未发现出血,再次头颅CT/MRI检查发现颅内出血,或根据首次头颅CT/MRI可以确定的出血性梗死[1];年龄≥18岁;具有完善的临床资料及相关检验结果。
排除标准:类卒中患者;合并重大疾病包括恶性肿瘤、血液病、严重心、肝、肾功能障碍及其他慢性消耗性疾病患者;近两周内有过感染病史及接受过激素、抗菌药物、免疫抑制剂等治疗的患者;临床资料或者检验资料不完善者;近期有重大外伤、手术史者;年龄<18岁者。
1.2 患者基线资料
收集患者基本信息:姓名、年龄、并发症(高血压史、糖尿病史、冠心病史、房颤)、大面积脑梗死、NHISS评分等;同时收集入院时患者C-反应蛋白、白蛋白、中性粒细胞数、淋巴细胞数、血小板计数等相关指标。
1.3 治疗方法
1)静脉溶栓治疗:所有患者均在脑卒中发病后4.5 h内用rt-PA行静脉溶栓治疗(阿替普酶0.9 mg/kg,最大剂量为90 mg),总剂量的10%首次静脉推完,余90% 60 min内静脉输注完;对治疗期间患者行24 h密切监测。
2)血管内介入治疗:前循环脑梗死6 h之内、后循环脑梗死24 h之内依据病变部位的性质、程度选取合适的治疗方法,比如行支架取栓术、血栓抽吸术或动脉溶栓治疗。
1.4 统计学分析

2 结 果
2.1 两组患者的临床资料
两组患者临床资料具体见表1。
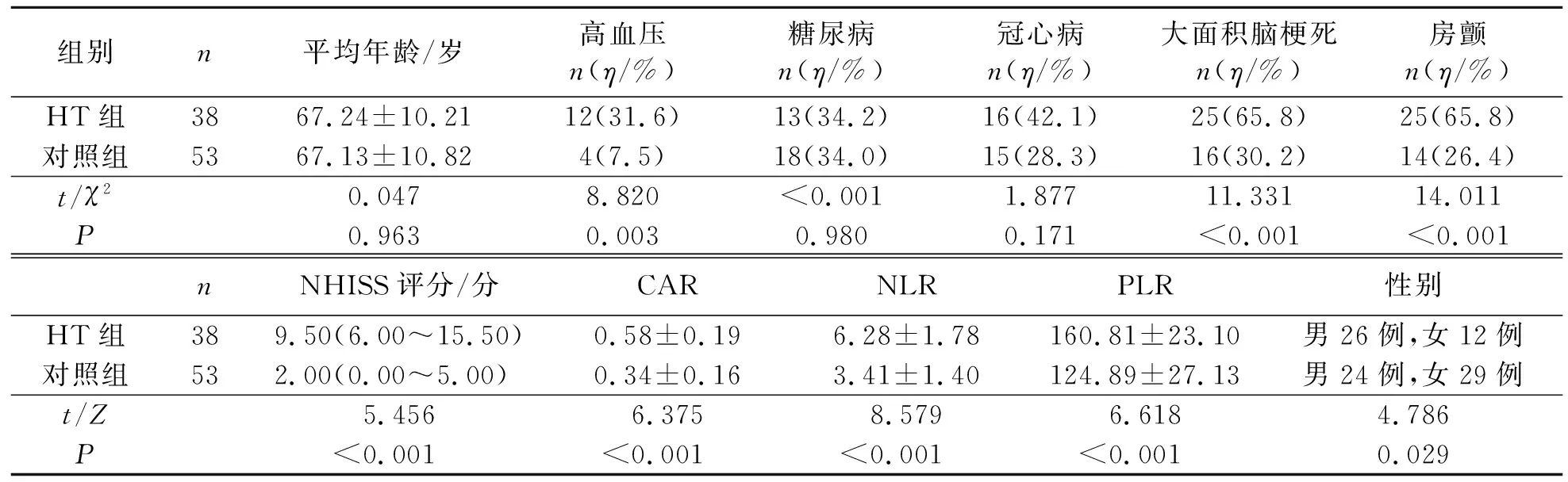
表1 两组患者的临床资料 Tab.1 Clinical information of patients in the two groups
2.2 影响卒中后出血转化患者神经功能转归的一般Logistic多因素回归分析
通过多因素Logistic回归结果显示,调整了其他影响因素后,房颤(OR=13.387,95%CI:1.291~138.829)、NHISS评分(OR=1.268,95%CI:1.046~1.537)、CAR(OR=628.341,95%CI:2.973~132 780.89)、NLR(OR=1.618,95%CI:0.892~2.933)和PLR(OR=1.058,95%CI:1.009~1.109)均为HT患者的危险因素,并且预测值与真实值之间无明显差异,Logistic回归模型拟合度较好(hosmer-lemeshowP=0.229)。见表2。

表2 影响HT患者神经功能转归的一般多因素Logistic回归分析Tab.2 General multi-factor Logistic regression analysis affected the reincarnation of neurological function of HT patients
2.3 CAR、PLR、NLR对卒中后出血转化患者神经功能转归的预测价值
ROC分析结果显示,CAR、NLR、PLR水平对HT的预测均具有统计学意义(均P<0.001),AUC分别为0.832(95%CI=0.739~0.902)、0.903(95%CI=0.823~0.955)和0.856(95%CI=0.766~0.921),截断值分别为0.43、4.23和133.93。三者联合ROC分析,AUC为0.930(95%CI=0.570~0.973),约登指数为0.767,诊断准确较高。见表3、图1。

图1 CAR、NLR和PLR对卒中后出血转化患者的预测价值Fig.1 Predicting value of CAR,NLR and PLR in bleeding transformation after stroke

表3 NLR、PLR、CAR预测HT神经功能转归的效能分析Tab.3 NLR,PLR,CAR predicts the efficiency analysis of HT neurological revenue
3 讨 论
卒中后出血转化是急性缺血性脑卒中的常见并发症,依据神经功能受损症状分为症状性和无症状性出血转化。症状性出血转化可能进一步加重患者的病情,影响患者预后及生活质量,严重时可能昏迷甚至死亡,其发生率为2%~7%[2]。目前相关研究[3-4]证实,AIS患者接受溶栓后发生HT的危险因素主要有年龄、NIHSS 评分、大面积脑梗死、既往糖尿病史、冠心病史、高血压史、房颤、一些抗凝及抗血小板药物的使用等,和出血转化风险存在相关性,但目前仍缺乏非常有利的出血转化风险预测模型。本研究旨在探究中性粒细胞数和淋巴细胞数比值(NLR)、血小板和淋巴细胞数比值(PLR)、C反应蛋白和白蛋白比值(CAR)等炎性指标和HT的相关性,结果显示:高血压病、大面积脑梗死、NLR是HT的危险因素;NHISS评分、房颤、CAR、PLR是发生HT的独立危险因素;高水平的NLR、CAR、PLR的急性脑梗死患者发生HT的风险大,三者联合对HT预测效果更好。
3.1 HT的炎症反应机制
出血转化的病理生理研究机制有很多,目前公认的是以下4种:缺血损伤、再灌注损伤、凝血功能紊乱和血脑屏障破坏。相关研究[5]显示,急性缺血性脑卒中早期是由于缺血缺氧,发生氧化应激反应、炎症反应和血管反应,会激活一系列炎症因子、氧自由基和细胞因子造成血管内皮细胞损伤,基底膜完整性被破坏,缺血区域及周围区域血管通透性增高,最终导致血脑屏障(Blood-brain barrier,BBB)的破坏而发生HT。急性缺血性脑卒中溶栓后发生HT的并发症的4种机制:ROS生成、血管再生重建因子、组织型纤溶酶原激活剂(tPA)的直接毒性及炎症反应,其中炎症是介导再灌注损伤的重要因素,tPA诱导的再灌注治疗导致中性粒细胞、小胶质细胞和巨噬细胞数量升高。炎症介导许多信号引发一系列级联反应,增加血脑屏障通透性,造成血管源性水肿,并最终导致HT的发生[6-7]。靳佳敏等[8]研究显示,炎症反应在脑梗死出血性转化中发挥关键作用,炎症因子可以直接或间接地导致急性缺血性脑卒中自发性出血转化。
3.2 炎性标志物
3.2.1 中性粒细胞数/淋巴细胞数
白细胞在缺血性脑卒中神经炎症和继发性损伤中起关键作用。NLR是中性粒细胞计数与淋巴细胞计数的比值,本试验没有单独对中性粒细胞数和淋巴细胞数单独分析,而是将两者作为一个整体进行分析。曹文延等[9-10]已证实NLR是评估脑卒中患者预后和不良结局的一种新型炎性标志物,NLR是评估急性缺血性脑卒中患者病情迅速进展甚至早期死亡的指标,还可以评估接受静脉溶栓和血管内介入治疗后急性缺血性脑卒中患者发生HT的风险[11],本研究显示,静脉溶栓和血管内介入治疗的急性缺血性脑卒中患者NLR越高,越容易发生出血性脑梗死。XING Y等[12]的研究表明,白细胞计数的增多是溶栓后 HT 的独立预测因子,未发生HT的患者白细胞计数明显低于发生HT的患者。SONG Q等[13]研究表明,高水平的 NLR 与HT的发生呈正相关关系。MAESTRINII等[14]也指出,接受溶栓的急性缺血性脑卒中患者,溶栓前的高水平NLR与症状性HT的出现有一定的相关性。综上可以看出,NLR不仅可以体现中性粒细胞介导的炎症反应,而且也能体现淋巴细胞的免疫调节作用。本研究也证实了HT组NLR明显高于对照组(P<0.05),高水平的NLR是HT发生的危险因素。
3.2.2 C反应蛋白/白蛋白
C反应蛋白/白蛋白(CRP)是一种新型炎性标志物,CRP能够改变身体微环境,最终导致血管内皮损伤,主要表现为小胶质细胞增多和白细胞外渗,临床上把CRP当作一种炎症标志物。WANG R等[15-16]指出,CRP升高会加重缺血性脑卒中的炎症反应,增大对组织的破坏作用,接受溶栓治疗的患者更易发生HT,CRP升高和HT的发生呈正相关关系。相关研究[17]表明,接受溶栓治疗的患者,溶栓成功后血管再灌注后会发生一系列反应,如蛋白分解会使人血白蛋白下降,应激及炎症反应会使CRP升高,致使血脑屏障通透性增大,进而增加急性脑梗死患者发生HT的风险。PUIG J等[18-19]发现,接受rt-PA静脉溶栓及小剂量白蛋白治疗的患者和接受rt-PA静脉溶栓及大剂量白蛋白治疗的患者相比,前者预后明显不好,这也证实了白蛋白在缺血性脑卒中治疗中的保护作用。本研究证实了卒中后出血转化组CAR明显高于对照组(P<0.05),高水平的CAR是急性脑梗死后HT发生的独立危险因素。
3.2.3 血小板/淋巴细胞数
PLR是一种新型炎症标志物,PLR升高反映全身炎症反应加剧[20],郎娅淞等[21]指出,PLR水平与急性缺血性脑卒中患者的预后有一定相关性。研究[22]发现,当血流受干扰,如血管狭窄、PLT黏附到受损的血管内皮上相互聚集,使管腔堵塞,造成局部缺血最终导致组织梗死[23],梗死区由于长期缺氧而致血管壁破坏,导致出血,继而局部压力降低,血液经侧支循环进入梗死区,加重梗死灶的出血。PLT越高,发生出血性脑梗死的风险越高。SHI K等[24]研究表明,在脑梗死患者和大鼠模型中,tPA通过结合膜联蛋白A2(annexin A2)作用于免疫细胞,调控细胞的转录组基因表达,并迅速活化外周免疫细胞,导致外周免疫细胞(尤指淋巴细胞)发生迁移,致使血脑屏障破坏,促进溶栓后出血转化的发生。研究[25]发现,PLR与原发性脑室出血的严重程度及不良预后有关,所以推测PLR水平高低可能与急性缺血性脑卒中后HT的发生有关。本研究证实了卒中后出血转化组PLR明显高于卒中后无出血组(P<0.05),高水平的PLR是HT发生的独立危险因素。
综上所述,NLR、 PLR和 CAR均可作为预测 HT的风险指标,且三者联合具有较好的预测效果。

