A族链球菌体内耐受β-内酰胺类药物的机制研究进展
郭孟杨 综述 姚开虎 审校
(国家儿童医学中心/首都医科大学附属北京儿童医院/北京市儿科研究所微生物研究室/国家呼吸系统疾病临床医学研究中心/教育部儿科重大疾病研究重点实验室,北京 100045)
A族链球菌(group AStreptococcus,GAS)可导致多种临床疾病,包括咽炎、猩红热、脓疱病、蜂窝织炎在内的非侵袭性急性疾病,亦包括坏死性筋膜炎和链球菌中毒性休克综合征等侵袭性疾病。此外,感染GAS 还可引起免疫介导性疾病,如急性风湿热(acute rheumatic fever,ARF)、风湿性心脏病、链球菌感染后肾小球肾炎等,严重影响人体健康[1]。目前尚无针对GAS 的疫苗投入临床应用,其感染治疗主要依靠抗菌药物[2]。青霉素作为一线药物治疗GAS 疾病已有80 余年,体外试验还从未确认过有对青霉素耐药的GAS 菌株,指南或共识目前仍推荐使用青霉素等β-内酰胺类药物治疗GAS 感染[3-4]。但是,自20 世纪50 年代开始,便时有青霉素治疗GAS感染失败的报道[5]。关于GAS 体内耐受β-内酰胺类药物的机制至今尚无定论,研究者从不同方面对这一现象产生的原因进行了假设和研究。本文就GAS 体内耐受β-内酰胺类药物的现象及可能机制进行回顾和总结,以期引起国内同行对相关情况的重视,为临床用药和后续研究提供参考。
1 GAS体内耐受β-内酰胺类药物的现象
至今为止,β-内酰胺类药物治疗GAS 感染失败的主要临床报道见表1。Markowitz 等[6]回顾了1953—1993 年间报道的青霉素治疗GAS 所致咽扁桃体炎失败的情况,经咽拭子细菌培养证实,为期10 d 的口服青霉素治疗失败率为19.1%~21.7%。Gastanaduy 等[7]研究发现,对于GAS 所致咽喉炎患者,依据细菌培养结果,口服或肌注青霉素治疗的失败率为25%左右,且治疗失败组的抗链球菌溶血素O 和抗链球菌DNA 酶B 的滴度在治疗前高于治疗成功组,可能该类患者发病前为GAS 携带者,而青霉素对处于增殖活跃期的细菌清除效果更好,治疗失败(细菌清除失败)或许与是否为GAS 携带状态有关[12]。当GAS 所致咽炎治疗不及时或不彻底时,或会引起风湿热、心内膜炎、脑膜炎等危及生命健康的严重疾病。有研究发现,GAS 咽部和皮肤感染或携带状态会增加ARF 的发病风险,但应用β-内酰胺类、大环内酯类和磺胺类等抗生素并不能降低该风险,尚不能确定其是否与药物不能彻底清除感染或携带菌有关[13]。近几十年来,时有β-内酰胺类药物治疗GAS 感染失败的相关报道,虽然各研究中关于治疗失败的判定标准不一,但用药后未彻底清除体内GAS 的现象基本一致,该现象及其背后的机制值得关注。
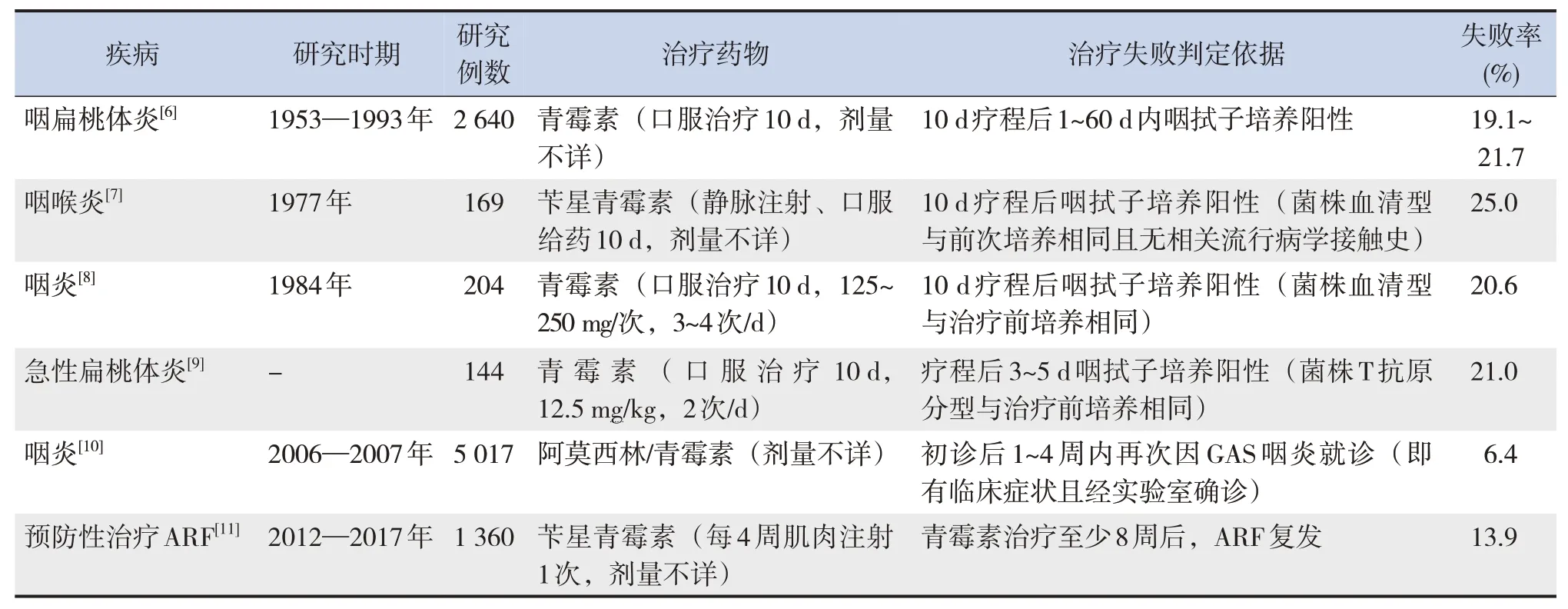
表1 β-内酰胺类药物治疗GAS感染失败的情况
2 GAS体内耐受β-内酰胺类药物的机制
关于β-内酰胺类药物治疗GAS 感染/清除体内GAS 失败的原因,研究者提出了不同观点。总结既往文献,可从致病菌株的药物敏感性和其他作用两个方面进行考虑:一是GAS 菌株对β-内酰胺类药物敏感性降低;二是其他微生物与药物在人体内发生相互作用,或菌株在机体内出现不同于体外试验的其他特性,如持留性(persistence)、产生生物膜的能力等,使得GAS无法被完全清除。
2.1 GAS对青霉素敏感性降低及其机制
已有研究报道了对β-内酰胺类药物敏感性降低的GAS 菌株[14-19]。目前,美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)只有GAS 对青霉素敏感的判定界值(MIC≤0.12 μg/mL 为敏感),没有GAS 对青霉素中介或耐药的判定界值[20]。与CLSI 不同,欧洲抗菌药物敏感性试验委员会(European Committee on Antimicrobial Susceptibility Testing,EUCAST)关 于GAS 体外药敏试验结果的判读包括敏感和耐药而无中介的标准,具体标准如下:敏感为MIC≤0.125 μg/mL(脑膜炎)、MIC≤0.25 μg/mL(非脑膜炎);耐药为MIC>0.125 μg/mL(脑膜炎)、MIC>0.25 μg/mL(非脑膜炎)[21],且有系统综述表明并未有以此为判定标准的耐药菌株报道[14]。
尚未见确证的青霉素耐药GAS 菌株的报告,但青霉素最低抑菌浓度(minimum inhibitory concentration,MIC)升高的GAS 菌株时有出现[14]。Vannice等[15]发现2株GAS菌株对氨苄青霉素、阿莫西林和头孢噻肟的MIC值升高,分别为0.25 μg/mL、0.25 μg/mL、0.06 μg/mL,比对照菌株的MIC 值高3~6倍,且其青霉素结合蛋白2x(penicillin binding protein 2x,PBP2x)发生了Thr553Lys 氨基酸替换。美国一项多中心研究报道,GAS菌株中PBP2x存在Pro601Leu 氨基酸替换的青霉素MIC 值(0.023~0.032 μg/mL)是野生型GAS 菌株(0.012 μg/mL)的2~3 倍;具有Phe599Tyr 和Gly600Asp 双氨基酸替换的GAS 菌株青霉素MIC 值(0.023 μg/mL)大于或等于仅具有Gly600Asp氨基酸替换的GAS菌株青霉素MIC 值(0.016 μg/mL),双氨基酸替换可能对MIC 值的增加具有累积效应。以上研究提示PBP2x中某些氨基酸替换导致GAS菌株对β-内酰胺类药物的敏感性降低,且有报道提出该种现象在GAS流行的emm型别中更常见[16]。有研究亦证明,具有停乳链球菌似马亚种(Streptococcus dysgalactiae subspecies equisimilis,SDSE)4 Kb 重组基因片段的PBP2x 嵌合体可导致GAS 在体外试验中对β-内酰胺类药物敏感性降低,且经相同剂量的青霉素治疗之后,感染突变菌株的坏死性肌炎小鼠四肢的细菌载量更高[17]。1995—2016 年冰岛一项对1 515株耐红霉素GAS菌株的研究发现,具有Met593Thr氨基酸替换的GAS菌株青霉素和氨苄青霉素MIC 值(青霉素:0.023 μg/mL,氨苄青霉素:0.032 μg/mL)是野生型GAS 菌株(青霉素:0.012 μg/mL,氨苄青霉素:0016 μg/mL)的2 倍[18]。2015—2021 年美国一项涵盖侵袭性GAS感染菌株的研究发现,具有PBP2x 中Thr553Lys 氨基酸替换的GAS 菌株,其氨苄青霉素和阿莫西林MIC 值是无此替换菌株的5~10 倍,提示PBP2x 的氨基酸改变与GAS 对β-内酰胺类药物(氨苄青霉素、青霉素G、头孢噻肟、头孢西丁和美罗培南等)敏感性降低有关[19]。
细菌外排泵亦与耐药性密切相关,有研究发现,青霉素不敏感GAS 菌株中编码外排泵相关的基因表达上调,但同时与蛋白质合成和菌细胞生长相关的基因表达下调,这亦表明GAS 菌株对青霉素产生抗性也需付出一定的生存代价[22]。
实际临床工作中普遍以CLSI 或EUCAST 规定的标准判定GAS 菌株是否耐药/不敏感,而该标准的制定以患者临床疗效为参考,虽然青霉素对于大部分GAS 感染仍有较好疗效,且CLSI 无GAS 对青霉素中介或耐药的判定界值,无法确定“耐药株”,但近年来不断有关于青霉素MIC 值增加的GAS菌株的报道[14-19],MIC值增加提示菌株具有耐药倾向,需要警惕体外试验耐药菌株的出现。
2.2 接种效应
接种效应(inoculum effect)指体外试验中当细菌接种量高于药敏试验使用量时,抗菌药物对其抗菌活性减弱的现象[23]。当抗生素杀死细菌并破坏细菌细胞壁时,死亡菌体释放出能破坏抗生素的酶,从而减少抗生素进入仍存活细菌的浓度,产生接种效应。虽然GAS 不产生β-内酰胺酶,但近年来研究表明其亦存在对青霉素的接种效应。Eagle[5]在20世纪50年代发现,若给小鼠接种GAS后24 h 内给药或细菌接种量低于107CFU/mL,则青霉素治疗通常有效,若GAS 接种浓度达到107~108CFU/mL,则细菌清除效果不佳,认为此现象可能与细菌处于不同生长周期有关。不同生长周期的GAS 表达青霉素结合蛋白(penicillin binding protein,PBP)的量不同,给小鼠接种GAS 24~48 h后,其PBP表达量明显低于前24 h,青霉素主要与PBP结合以达到抗菌效果,因此青霉素治疗GAS失败或与用药开始的时间有关[23]。有研究表明,GAS菌株对青霉素的接种效应明显,即在高细菌密度和生长平台期,细菌对青霉素的敏感性明显降低[24]。采用中空纤维感染模型(可体外模拟体内感染)研究发现,输注青霉素减少GAS 菌落数量的幅度与首次接种剂量有关,在青霉素20 mg/q4h 的相同给药方案下,高剂量接种组的细菌量减少幅度较小;青霉素连续输注24 h后,接种效应最为显著,此后再应用青霉素降低细菌量的作用没有前24 h用药作用明显[24],此现象与不同增殖期GAS 的PBP 表达量不同的研究结果一致[23],这些研究突显了早期治疗的必要性。
2.3 共存细菌的作用
处于同一环境中的其他细菌产生β-内酰胺酶对GAS 可提供间接保护作用。有研究发现,应用阿莫西林治疗GAS 引起的咽扁桃体炎时,在患者咽部检测到了耐阿莫西林的流感嗜血杆菌,其分泌包裹β-内酰胺酶的外膜囊泡对GAS具有保护作用,在肉汤培养基中分别加入724 μg/mL 和1.2 mg/mL的外膜囊泡蛋白时,GAS阿莫西林MIC值从原来的0.016 μg/mL升至4 μg/mL和16 μg/mL,且用β-内酰胺酶抑制剂克拉维酸盐处理后,该种保护作用消失[25]。该研究表明感染部位其他菌群分泌的包裹β-内酰胺酶的外膜囊泡与β-内酰胺类药物治疗GAS感染失败有关。
Geyrhofer 等[26]认为,菌群存活与菌群死亡率及抗生素清除率均有关。首先,一部分细菌因暴露于抗生素而死亡,同时,存活细菌会产生分解或灭活抗生素的酶,从而降低抗生素浓度,当抗生素浓度在所有细菌被清除前降低到某一不足以杀死细菌的浓度或以下时,则会有抗性菌群的存活,要有抗性细菌存活就需达到最小接种量。产β-内酰胺酶共存细菌要产生GAS 保护作用也必需达到一定的接种量,即这些在GAS 感染部位共存的其他菌群数量与其为GAS提供的保护作用有关。
有研究发现,虽然大肠杆菌单独存在时对氨苄青霉素敏感,但当与非耐药枯草芽孢杆菌共存时,其可免受氨苄青霉素的清除,并对其他细菌的生长产生抑制作用[27]。该种现象的具体机制尚不明确,GAS 感染患者感染部位的非耐药共存菌是否会导致其免受β-内酰胺类药物的清除需要进一步的调查研究。
2.4 细菌持留性及生物膜的形成
细菌的持留性在抗生素治疗失败中也扮演了重要角色。2018 年,欧洲分子生物学组织定义了细菌“持留性”,即细菌一个细胞亚群在杀菌性抗生素治疗中存活下来,但其并没有产生耐药性,且当无抗生素时,其恢复增殖并保持药物敏感性的特性。抗生素诱导是细菌产生持留性的触发因素之一,诱导产生具有持留性菌群的MIC 值并无改变,但其最低杀菌浓度(minimum bactericidal concentration,MBC)值高于其他菌群。这可以解释为何青霉素治疗对药物敏感的GAS 感染仍会失败的情况[28]。有研究表明,GAS 被接种到非生物表面形成高细菌负荷的团聚状态(生物膜样环境)时具有形成持留性的能力,并证明此现象与外排泵和菌细胞自身生长停滞有关[22]。临床中严重GAS 感染患者即使接受了正规青霉素治疗,但由于感染部位可达高细菌载量形成生物膜样环境,产生的持留性细菌无法被清除,可能会因此导致治疗失败。
生物膜与抗生素不能清除GAS 密切相关。无症状患者口咽部的GAS 携带状态与生物膜形成相关,皮肤和咽部的GAS 感染部位均可发现生物膜[29]。不同于MIC及MBC,清除生物膜中的细菌,药物需要达到最低生物膜根除浓度(minimum biofilm eradication concentration value,MBEC)。生物膜可使GAS对青霉素的耐受性提高2 500~5 000倍。有研究发现,应用外切糖苷酶去除咽细胞(pharyngeal cell)的聚糖物质后,其表面所形成的GAS生物膜MBEC是未处理咽细胞表面GAS生物膜的2 倍余,说明聚糖物质可降低GAS 生物膜MEBC,增加生物膜中GAS 对青霉素的敏感性[30]。此外,亦有研究证明精氨酸脱亚氨酶(arginine deiminase,ADI)促进细菌生物膜的形成[31]。若能以咽细胞表面聚糖为基础,研发具有相似结构或抑制ADI途径的药物,将其与青霉素联用或可避免治疗失败。
2.5 GAS可内化入细胞
通常将GAS 定义为胞外菌,但它亦会侵入细胞并在胞内持续存在,以躲避免疫清除和抗生素作用[32]。研究表明,链球菌可通过多种机制粘附并内化(internalization)入细胞[33]。青霉素脂溶性较低,对人体细胞膜的透过率低,不能有效清除胞内菌。内化入胞的GAS 免受青霉素清除,可引起反复感染和无症状的咽部携带状态[34]。喹诺酮类抗生素在细胞内与细胞外浓度的比值,比β-内酰胺类抗生素高约8倍,具有较强的组织细胞渗透性。对GAS 侵入的细胞应用阿莫西林和喹诺酮类药物拉库沙星(lascufloxacin,LSFX)后发现,阿莫西林不能减少胞内GAS量,而LSFX可有效减少内化入宿主细胞内的GAS[35]。近年来,有学者针对β-内酰胺类药物不能清除胞内GAS 的问题进行研究,探寻新的GAS感染治疗方向。Lu等[36]发现血管内皮生长因子可通过增强内皮细胞中溶酶体活性及促进异体吞噬从而有助于胞内GAS的清除。
3 结语
尽管体外试验中GAS 总是对青霉素等敏感,但GAS 体内耐受青霉素等β-内酰胺类药物也已得到确证。GAS 体内耐受青霉素等β-内酰胺类药物的机制尚无定论,可能与GAS 菌株的药物敏感性有关,也可能与机体内的其他因素,包括GAS 的接种效应、共存菌的作用、GAS 生物膜和细菌持留性,以及细菌内化入细胞等。需要注意的是,虽然有青霉素等药物清除细菌失败的情况,但仍然少见,包括青霉素在内的β-内酰胺类药物对大部分GAS 感染仍然有效,换用其他药物不论是从经济还是疗效考虑,均于患者无益[37]。临床需要持续对治疗失败的情况保持警惕,并监测GAS 分离株体外药物敏感状况,为GAS 体内耐受β-内酰胺类药物的机制研究提供更多线索和证据,促进预防和治疗GAS感染新策略的研发。
作者贡献声明:郭孟杨查阅及整理分析文献、撰写文章;姚开虎把握选题、修改文章、经费支持。
利益冲突声明:所有作者声明不存在利益冲突。

