牦牛附睾不同区段上皮细胞SLC基因家族的表达分析







摘要:【目的】揭示附睾不同区段溶质载体(SLC)蛋白的调控及功能差异,明确SLC基因家族在牦牛附睾中的表达情况,为提高牦牛繁育性能提供理论依据。【方法】从牦牛附睾头、附睾体和附睾尾的上皮细胞转录组数据中筛选出54个SLC基因家族差异表达基因(DEGs),通过关联网络分析筛选出关键基因,然后采用实时荧光定量PCR检测DEGs在牦牛附睾不同区段上皮细胞中的表达情况。【结果】在牦牛附睾头vs附睾体中有SLC2A9、SLC8A1和SLC29A1等18个DEGs呈上调表达,SLC41A2、SLC40A1和SLC26A3等24个DEGs呈下调表达;在附睾头vs附睾尾中有SLC16A2、SLC7A1和SLC2A9等17个DEGs呈上调表达,SLC39A4、SLC26A3和SLC40A1等15个DEGs呈下调表达;在附睾体vs附睾尾中有SLC5A3、SLC16A2和SLC46A3等6个DEGs呈上调表达,SLC25A20、SLC20A2和SLC27A1等6个DEGs呈下调表达。通过关联网络分析筛选出13个关键基因:SLC41A2、SLC7A8、SLC26A3、SLC39A11、SLC30A4、SLC1A1、SLC7A2、SLCO2A1、SLC6A2、SLC22A17、SLC5A5、SLC22A18和SLC30A4。其中,SLC26A3基因是附睾头vs附睾体、附睾头vs附睾尾2组样本的关键基因,且SLC26A3基因在附睾头的相对表达量显著高于附睾体和附睾尾(Plt;0.05)。牦牛附睾SLC基因家族在矿物质吸收通路上富集的数量最多,其中SLC26A3基因参与矿物质吸收和胰腺物分泌2条信号通路。【结论】从牦牛附睾不同区段上皮细胞中筛选得到13个SLC基因家族调控基因,其中SLC26A3基因是附睾头vs附睾
体、附睾头vs附睾尾2组样本的共有关键基因,通过调控矿物质吸收而影响雄性牦牛的生殖能力。
关键词:牦牛;附睾;上皮细胞;SLC基因家族;差异表达基因(DEGs)
中图分类号:S823.85文献标志码:A 文章编号:2095-1191(2024)11-3404-10
Expression analysis of SLC gene family in epithelial cellsof different segments of yak epididymis
WU Yi-tao, PAN Mei-lan, LUO Xiao-feng, PAN Cheng, ZHAO Wang-sheng*(School of Life Science and Engineering, Southwest University of Science and Technology, Mianyang,Sichuan 621010, China)
Abstract:【Objective】The regulation and functional differences of solute carrier( SLC) protein in different segments of epididymis were revealed, and the expression of SLC gene family in yak epididymis was clarified to provide theoretical basis for improving the breeding performance of yaks. 【Method】A total of 54 differentially expressed genes( DEGs) of SLC gene family were screened from the transcriptome data of epithelial cells of yak epididymis caput, corpus, and cauda epithelial cells. Key genes were screened by association network analysis, and then real-time fluorescence quantitative PCR was used to detect the expression of DEGs in epithelial cells of different segments of yak epididymis.【 Result】In the comparison between caput vs corpus, 18 DEGs including SLC2A9, SLC8A1 and SLC29A1 were up-regulated, while 24 DEGs including SLC41A2, SLC40A1 and SLC26A3 were down-regulated. In the caput vs cauda, 17 DEGs including SLC16A2, SLC7A1 and SLC2A9 were up-regulated, while 15 DEGs including SLC39A4, SLC26A3 and SLC40A1 were down-regulated. For the corpus vs cauda, 6 DEGs including SLC5A3, SLC16A2 and SLC46A3 were up-regulated, while6 DEGs including SLC25A20, SLC20A2 and SLC27A1 were down-regulated. A total of 13 key genes were selected through association network analysis: SLC41A2, SLC7A8, SLC26A3, SLC39A11, SLC30A4, SLC1A1, SLC7A2, SLCO2A1, SLC6A2, SLC22A17, SLC5A5, SLC22A18 and SLC30A4. Among them,SLC26A3 gene was the key gene in both the caput vs corpus and caput vs cauda groups. SLC26A3 gene exhibited significantly higher expression in the caput compared to the corpus and cauda segments( Plt;0.05). The SLC gene family of yak epididymis was the most abundant in mineral absorption pathway, and SLC26A3 gene was involved in 2 signaling pathways: mineral absorption and pancreatic secretion. 【Conclusion】Thirteen regulatory genes of SLC gene family are selected from epithelial cells of different seg‐ments of yak epididymis, among which SLC26A3 gene is the common key gene of caput vs corpus and caput vs cauda groups, which influences the reproductive ability of male yaks by regulating mineral absorption.
Key words: yak; epididymis; epithelial cells; SLC gene family; differentially expressed genes( DEGs)
Foundation items: Central Government Guiding Local Science and Technology Development Projec(t 2023ZY026); Sichuan Science and Technology Plan Projec(t 2021YFH0101); Graduate Excellent Course and Bilingual Course Project of Southwest University of Science and Technology(20SYKC05)
0 引言
【研究意义】牦牛是青藏高原的特有物种之一,广泛分布于我国青藏高原地区。牦牛作为高原地区重要的牲畜品种,为西藏及其他高海拔地区的游牧民族提供了必要的资源,在高原农业经济中发挥着重要作用(廖阳慈等,2023)。由于高原地区环境恶劣及饲养管理方式落后,牦牛的生长发育和繁殖受到限制,导致牦牛的经济价值未能完全体现(Jing et al.,2022)。因此,有效提高牦牛繁育性能已成为高原畜牧养殖业的重点和难点。【前人研究进展】附睾是精子发育、修饰、成熟和储存的重要场所(李琳等,2007;蒙利洁等,2024)。附睾附着于睾丸上,连接睾丸和输精管,内部分布有数条小管并布满纤毛,精子随着这些纤毛的摆动悬浮于管腔中,且沿着附睾头部向尾部运动。哺乳动物的附睾组织分为3个部分:附睾头、附睾体和附睾尾(赵旺生等,2023)。附睾头部可分泌睾丸液,促进精子发育成熟;附睾尾能维持精子活力,使精子处于静止状态,在精子的储存过程中发挥作用(Shah et al.,2018)。在附睾转运过程中,鞭毛结构改变、蛋白与精子相互作用、碳酸氢盐/腺苷酸(Adenosine monophosphate,AMP)浓度变化、磷酸酶和激酶活性及精子细胞内pH变化均是影响精子成熟和获得活力的重要因素(Navarro et al.,2007;Dacheux and Dacheux,2014;Gervasi and Vis‐conti,2017)。溶质载体(Solute carrier,SLC)转运蛋白家族参与各种物质的运输,包括离子、氨基酸、糖、代谢物及异生物质等(Hediger et al.,2004),其家族成员可通过调节生殖道内腔液的pH而影响生殖过程(Lin et al.,2015)。已有研究表明,敲除小鼠的SLC4A2和SLC22A14基因,会导致其精子发生异常而不育(Medina et al.,2003;Maruyama et al.,2016)。此外,在SLC26A8基因敲除雄性小鼠模型中,精子结构的严重缺陷导致其无法生育(Touré et al.,2007;Dirami et al.,2013)。SLC蛋白家族中的SLC26属于保守膜蛋白,主要介导各种阴离子穿透上皮细胞质膜的运输,是构成pH和HCO3–浓度的重要调节因子(冉丽丹等,2015)。SLC26A3基因调节雄性个体生育能力的作用更复杂。SLC26A3基因缺失与附睾的严重病变、细胞结构异常及精子数量、形态和功能缺陷相关,且这些缺陷共同损害雄性个体的生育能力(El Khouri et al.,2018)。【本研究切入点】SLC基因家族在附睾不同区段均有大量表达(Pholpramool et al.,2011),但有关SLC基因家族在牦牛精子发生过程中的分子作用机制至今尚未明确。【拟解决的关键问题】通过对牦牛附睾头、附睾体和附睾尾的上皮细胞进行转录组测序分析,揭示附睾不同区段SLC蛋白的调控及功能差异,明确SLC基因家族在牦牛附睾中的表达情况,为提高牦牛繁育性能提供理论依据。
1 材料与方法
1. 1 试验材料
在四川省阿坝州红原县屠宰场选择3头体型和生长情况相似、身体健壮、36月龄的公牦牛,通过手术去势采集睾丸和附睾,分离附睾并去除结缔组织和脂肪组织,经磷酸盐缓冲液(PBS)漂洗后按头、体和尾3个部位进行分割,分别命名为附睾头(T1、T2、T3)、附睾体(J1、J2、J3)和附睾尾(W1、W2、W3),然后转移至含玻璃化冷冻液的冻存管中,液氮速冻保存。动物试验由西南科技大学生物与健康伦理委员会批准,批准号L2022014。
1. 2 牦牛附睾组织总RNA提取
按照RNAsimple总RNA 提取试剂盒(DP419)说明分别提取牦牛附睾头、附睾体、附睾尾的上皮细胞总RNA,采用琼脂糖凝胶电泳和NanoDrop ND-2000分光光度计(赛默飞世尔中国公司)分别检测总RNA质量及其浓度,检测合格的总RNA置于-80 ℃超低温冰箱保存备用。
1. 3 牦牛附睾SLC基因家族筛选
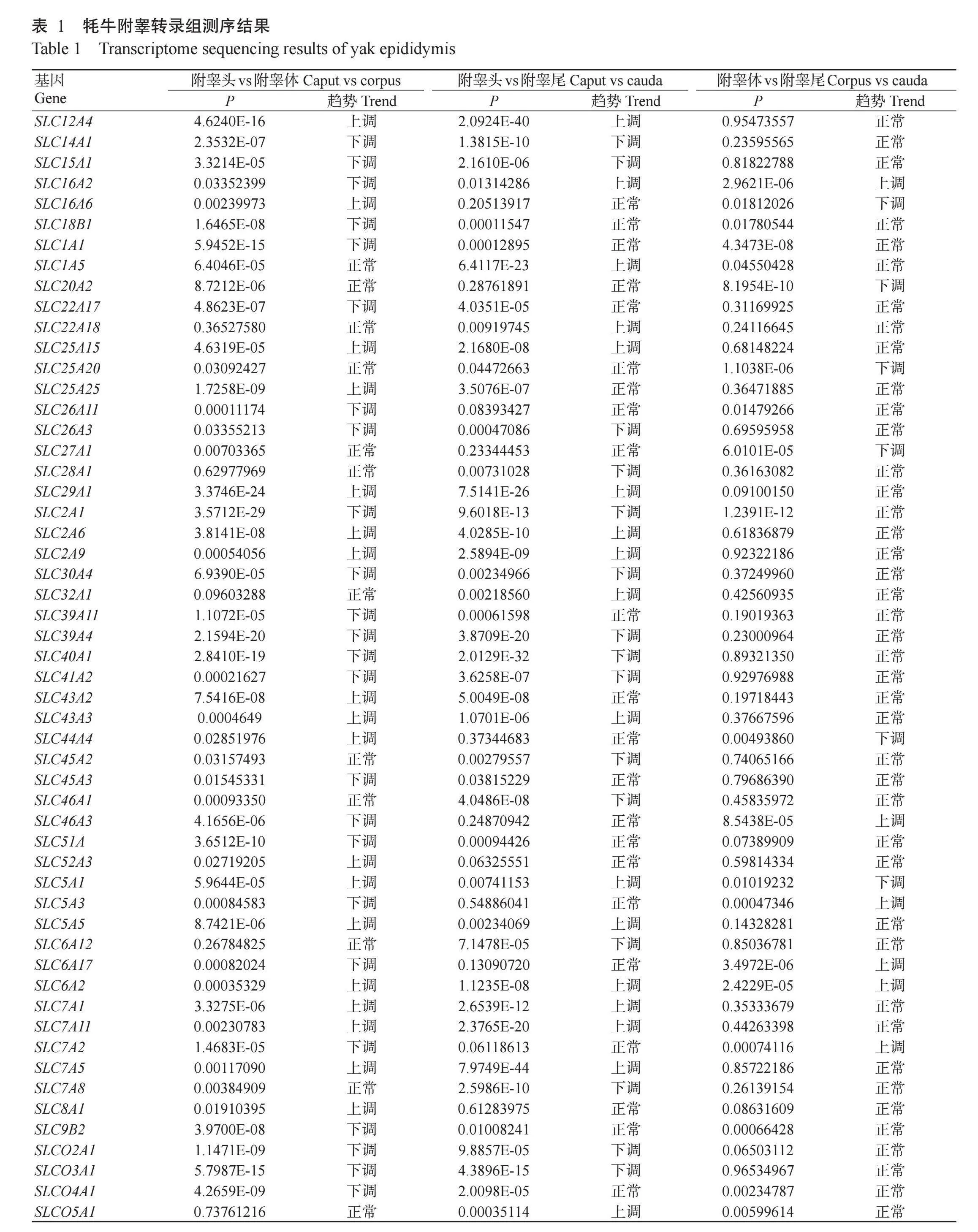
使用Oligo(dT)磁珠富集牦牛附睾头、附睾体和附睾尾的上皮细胞mRNA,以mRNA为模板合成cDNA第一链,加入缓冲液、dNTPs和DNA聚合酶I合成cDNA第二链,纯化后进行末端修复加poly(A)尾并连接测序接头,然后根据片段大小进行PCR扩增。构建cDNA文库后,通过实时荧光定量PCR和Qubit® 2.0荧光仪测定文库浓度,采用Agilent 2100生物分析仪测定插入片段大小,使用Illumina Nova‐Seq 6000对cDNA文库进行测序。根据牦牛附睾转录组测序结果(表1)筛选出附睾头、附睾体和附睾尾中SLC基因家族的差异表达基因(Differentially expressed genes,DEGs)。
1. 4 生物信息学分析
从牦牛附睾头、附睾体、附睾尾的上皮细胞转录组数据库中筛选出属于SLC基因家族的DEGs,使用Python 3.12.4中的Seaborn程序对附睾头vs附睾体、附睾头vs附睾尾、附睾体vs附睾尾3组样本间的SLC基因家族进行差异表达分析,将所有DEGs集合后采用Z-score对数据进行标准化处理及层次聚类分析。对附睾头vs附睾体、附睾头vs附睾尾、附睾体vs附睾尾3组样本间的DEGs进行Spearman相关分析,然后使用R语言(3.6.3)对各DEGs的相关性进行可视化,并通过KEGG数据库(https://www.genome.jp/kegg)对DEGs进行KEGG信号通路富集分析。
1. 5 实时荧光定量PCR检测
将总RNA反转录合成cDNA,作为实时荧光定量PCR扩增的模板。以Premier 5.0设计扩增引物(表2),并委托生工生物工程(上海)股份有限公司合成。实时荧光定量PCR反应体系10.0 μL:2×SG Fast qPCR Master Mix 5.0 μL,上、下游引物(10 μmol/L)各0.4 μL,cDNA模板(50 ng/μL)0.5 μL,无菌去离子水补足至10.0 μL。扩增程序:94 ℃预变性2 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,进行32个循环;72 ℃延伸2 min。附睾头、附睾体和附睾尾样品均设3个重复,通过2-ΔΔCt法计算目的基因相对表达量,并以SigmaPlot v8.02中的t检验进行统计分析。
2 结果与分析
2. 1 牦牛附睾SLC基因家族差异表达分析结果
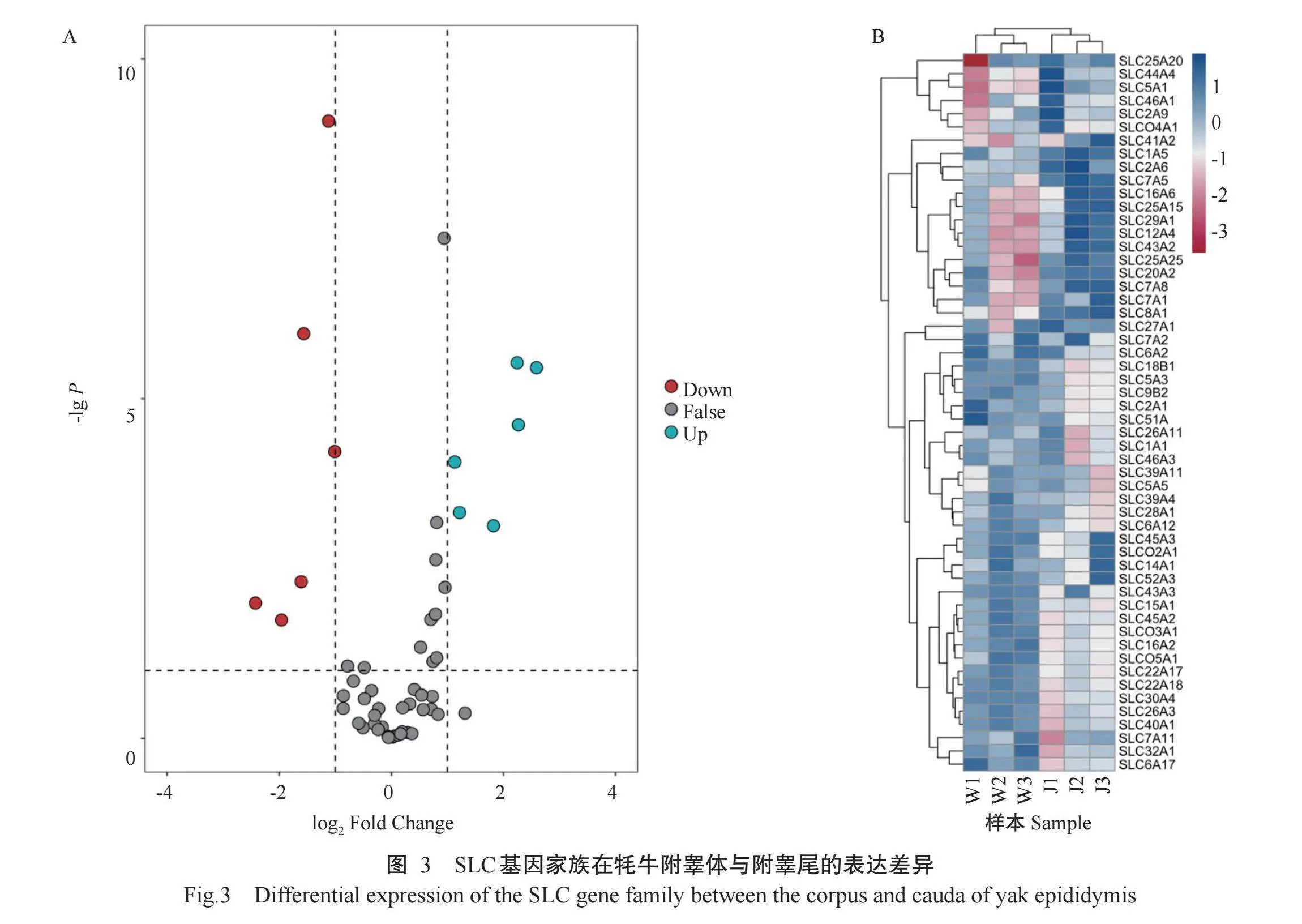
通过对牦牛附睾头、附睾体和附睾尾的上皮细胞转录组数据进行分析,结果发现有54个DEGs属于SLC基因家族。以附睾头的表达量为对照组,附睾体中的SLC2A9、SLC8A1和SLC29A1等18个DEGs呈上调表达,SLC41A2、SLC40A1和SLC26A3等24个DEGs呈下调表达(图1-A);附睾尾中的SLC16A2、SLC7A1和SLC2A9等17个DEGs呈上调表达,SLC39A4、SLC26A3和SLC40A1等15个DEGs呈下调表达(图2-A)。以附睾体的表达量为对照组,附睾尾中的SLC5A3、SLC16A2和SLC46A3等6个DEGs呈上调表达,SLC25A20、SLC20A2和SLC27A1等6个DEGs呈下调表达(图3-A)。此外,从聚类分析热图(图1-B、图2-B和图3-B)可看出附睾头vs附睾体、附睾头vs附睾尾、附睾体vs附睾尾3组样本间的DEGs重复性较好,聚类较集中。
2. 2 SLC基因家族关键基因的筛选与定量分析结果
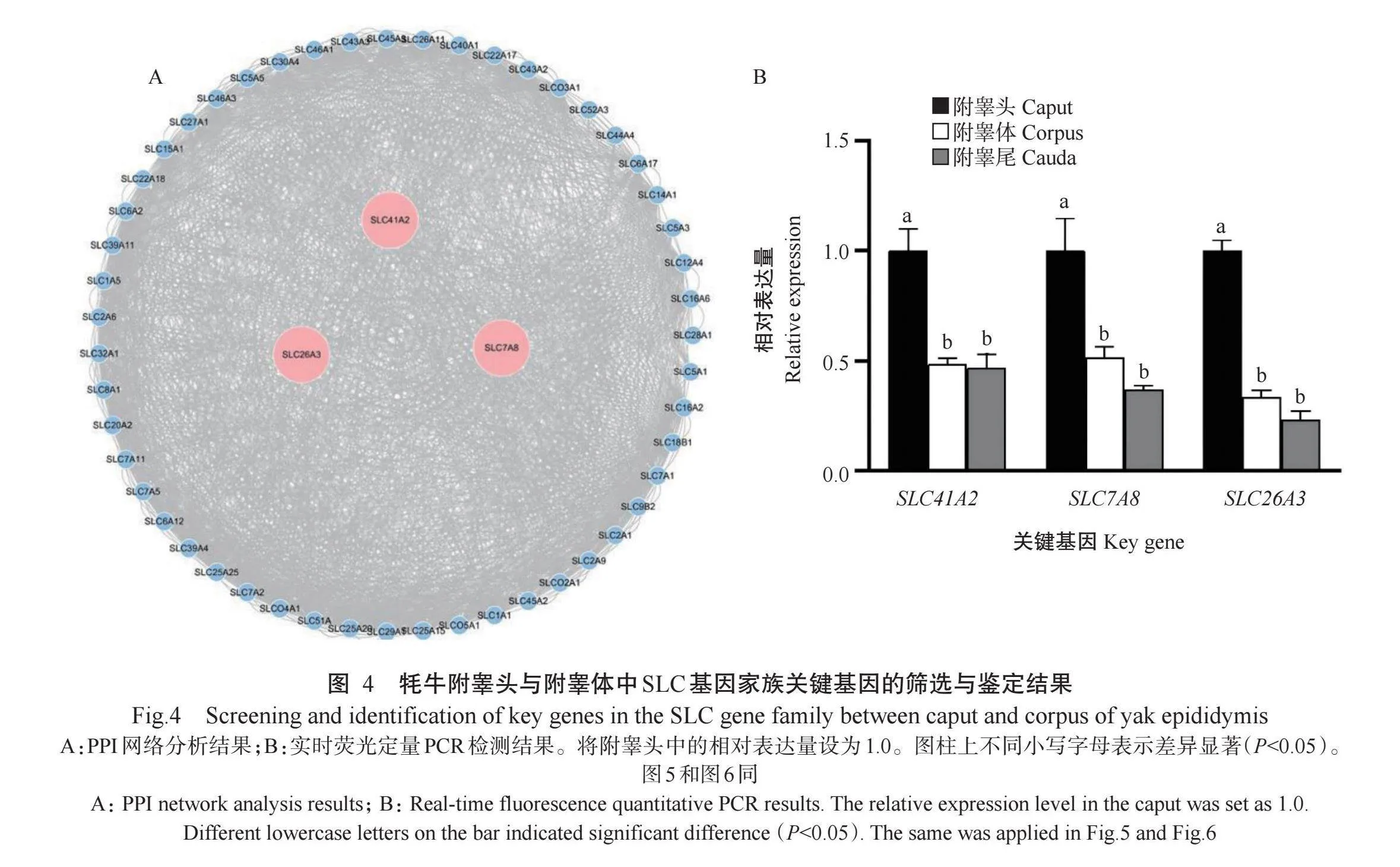
对54个DEGs进行关联网络分析,结果如表3所示。附睾头vs附睾体的边数与平均聚类系数均大于其他2组样本,说明附睾头vs附睾体具有更复杂的基因调控网络。从附睾头vs附睾体组[节点数(n=54)和边数(n=1836)]中筛选出SLC41A2、SLC7A8和SLC26A3等3个关键基因(图4-A);从附睾头vs附睾尾组[节点数(n=54)和边数(n=1628)]中筛选出6个关键基因,分别是SLC39A11、SLC30A4、SLC1A1、SLC7A2、SLCO2A1和SLC26A3(图5-A);从附睾体vs附睾尾组[节点数(n=54)和边数(n=850)]中筛选出5个关键基因,分别是SLC6A2、SLC22A17、SLC5A5、SLC22A18和SLC30A4(图6-A)。实时荧光定量PCR检测结果显示,附睾头vs附睾体、附睾头vs附睾尾2组样本的关键基因均在附睾头上皮细胞中高表达(图4-B和图5-B);附睾体vs附睾尾组的关键基因SLC22A17和SLC30A4在附睾头高表达,SLC6A2和SLC22A18基因在附睾尾的相对表达量显著高于附睾头和附睾体(Plt;0.05,下同),SLC5A5基因在附睾体的相对表达量最高(图6-B)。此外,SLC26A3基因是附睾头vs附睾体、附睾头vs附睾尾2组样本的关键基因,且SLC26A3基因在附睾头的相对表达量显著高于附睾体和附睾尾。
2. 3 牦牛附睾SLC基因家族参与的信号通路调控
对牦牛附睾SLC基因家族DEGs进行KEGG信号通路富集分析,结果(图7)显示,SLC基因家族在矿物质吸收(Mineral absorption)通路上富集的数量最多。其中,SLC26A3基因参与矿物质吸收和胰腺物分泌(Pancreatic secretion)2条信号通路。附睾头vs附睾尾的关键基因中以SLC1A1基因参与的KEGG信号通路最多,包括谷氨酸能突触(Glutamatergic synapse)、蛋白消化和吸收(Protein digestion and absorption)及突触囊泡周期(Synaptic vesicle cycle);而SLC7A2基因主要参与mTOR信号通路(mTORsignaling pathway)。附睾体vs附睾尾的关键基因SLC5A5主要参与甲状腺激素信号通路(Thyroid hor‐mone signaling pathway)。
3 讨论
附睾上皮可保护精子细胞免受免疫系统侵害,并介导血液循环中离子、溶质、营养物质及水的矢量运输,从而确保精子细胞的生存与活力。在生殖过程中,雄性和雌性的生殖道均依赖于pH稳态,而SLC基因家族在电解质运输与pH稳态调节方面发挥重要作用(Delgado-Bermúdez et al.,2022)。SLC蛋白家族调节多种物质在细胞膜上的运输,在细胞对营养物质、药物及其他外源物质的吸收生理过程中扮演重要角色(Lin et al.,2015)。本研究通过分析牦牛附睾头、附睾体和附睾尾的上皮细胞转录组数据发现,SLC基因家族在牦牛附睾头、附睾体和附睾尾的上皮细胞中广泛表达分布,最终筛选得到54个DEGs属于SLC基因家族。在附睾头vs附睾体、附睾头vs附睾尾、附睾体vs附睾尾3组样本间,通过关联网络分析筛选出13个关键基因:SLC41A2、SLC7A8、SLC26A3、SLC39A11、SLC30A4、SLC1A1、SLC7A2、SLCO2A1、SLC6A2、SLC22A17、SLC5A5、SLC22A18和SLC30A4。其中,SLC26A3基因是附睾头vs附睾体、附睾头vs附睾尾2组样本的共有关键基因,且SLC26A3基因在附睾头的相对表达量显著高于附睾体和附睾尾。
哺乳动物生殖道内腔液pH对精子发生、获能、受精及早期胚胎发育等均有重要影响(Bernardino et al.,2019),生殖道的酸碱平衡紊乱通常导致不育或生育能力低下(Gałęska et al.,2022)。在附睾内,低碳酸氢盐浓度的建立有助于生殖腔内酸化,是精子成熟及静止状态下储存的必需条件(Chan et al.,2009;Liu et al.,2012;Breton et al.,2019)。此外,离子平衡的调节对于精子活力及其生育能力至关重要。SLC26是保守的膜蛋白,介导各种阴离子在上皮细胞质膜上运输,是pH和HCO-浓度的重要调3节因子(Delgado-Bermúdez et al.,2022)。Touré(2019)研究证实,大多数SLC26蛋白通过刺激Cl-通道活性,与各种上皮组织中的囊性纤维化跨膜传导调节因子(Cystic fibrosis transmembrane conductance regu‐lator,CFTR)相互作用。因此,本研究推测SLC26基因在牦牛附睾精子成熟过程中参与pH和HCO3-浓度的调节。SLC26A3基因在雄性生殖道和精子细胞中的功能研究已有较多报道。Chen等(2009)最先发现SLC26A3基因在精子头部的顶体前部区域表达,且精子头部中的CFTR与SLC26A3基因共同参与精子获能;Chávez等(2012)研究发现,SLC26A3基因存在于小鼠精子中段,与CFTR的位置相同,表明CFTR与SLC26A3相互作用对小鼠精子获能十分重要;El Khouri等(2018)通过分析SLC26A3基因敲除小鼠模型发现,SLC26A3基因缺失小鼠表现出严重的附睾尾损伤和细胞结构异常,严重影响附睾精子的储存。此外,Breton等(2016)研究发现,与野生型小鼠相比,SLC26A3基因缺失小鼠附睾头中的V型三磷酸腺苷(Adenosine triphosphate,V-ATP)含量增加,反映了管腔液中HCO3-和pH失调的补偿机制。综上所述,SLC26A3基因影响附睾环境的pH和离子含量,在雄性生育能力方面发挥着至关重要的作用。本研究中,SLC26A3基因在牦牛附睾头上皮细胞中显著高表达,可能是通过调控附睾腔环境及精子的成熟而影响牦牛的生殖能力。
牦牛附睾SLC基因家族在矿物质吸收通路上富集的数量最多,且关键基因SLC26A3参与该通路的调控。精液的质量及生育能力受矿物质补充的高度影响(Rahman et al.,2014)。饲喂微量矿物质对畜禽精子的产生和生育能力有显著影响,而达到最佳的生殖功能(Narasimhaiah et al.,2018)。矿物质补充有助于保持精子膜的完整性,以及增强精子细胞的抗氧化性能(Kendall et al.,2000)。精子需要有锌离子才能将头部附着于雌性生殖道中,并从前列腺释放出抗菌化合物(Saaranen et al.,1987)。精子膜中的高脂质含量导致精子细胞极易发生氧化损伤和脂质过氧化(Khan et al.,2012),鉴于矿物质的抗氧化特性,补充矿物质能有效清除过量的超氧自由基,进而阻止精子细胞发生氧化损伤。睾丸生长和精子发生对锌的需求量大于身体生长,说明锌在雄性个体的发育及成熟过程中发挥重要作用,尤其对睾丸上皮细胞的完整性至关重要(Narasimhaiah et al.,2018)。由此推测,SLC26A3基因通过调控矿物质吸收而影响雄性的生殖能力。
4 结论
从牦牛附睾不同区段上皮细胞中筛选得到13个SLC基因家族调控基因,其中SLC26A3基因是附睾头vs附睾体、附睾头vs附睾尾2组样本的共有关键基因,通过调控矿物质吸收而影响雄性牦牛的生殖能力。
参考文献((References)):
李琳,周利华,任冬仁,幸宇云,陈从英. 2007. 附睾功能及其对精子成熟的影响[J]. 中国畜牧兽医,34(1):79-82.[ Li L,Zhou L H,Ren D R,Xing Y Y,Chen C Y. 2007. Epi‐didymal functions and its influence on sperm mturation[J]. China Animal Husbandry amp; Veterinary Medicine,34(1):79-82.] doi:10.3969/j.issn.1671-7236.2007.01.025.
廖阳慈,李蕊蕊,索朗斯珠,落桑次旦,参木友. 2023. 西藏自治区牦牛生产现状和趋势分析[J]. 中国畜禽种业,19(6):72-79. [Liao Y C,Li R R,Suolang Sizhu,Luosang Ciddan,Can M Y. 2023. Analysis on current situation and trend of yak production in Xizang Region[J]. The Chinese Livestock and Poultry Breeding,19(6):72-79.] doi:10. 3969/j.issn.1673-4556.2023.06.014.
蒙利洁,黄梦婷,徐永健,冯贤辀,刘文娇,龚婷. 2024. 味觉受体T1R1和T1R3在从江香猪附睾不同区段的差异表达[J]. 南方农业学报,55(4):1160-1169.[ Meng L J,Huang M T,Xu Y J,Feng X Z,Liu W J,Gong T. 2024. Differen‐tial expression of taste receptors T1R1 and T1R3 in diffe-rent regions of epididymis in Congjiang Xiang pigs[J]. Journal of Southern Agriculture,55(4):1160-1169.] doi:10.3969/j.issn.2095-1191.2024.04.024.
冉丽丹,蔡孝莉,刘雪梅,文国容,金海,庹必光. 2015. SLC26蛋白家族成员功能及意义的研究进展[J]. 中国当代医药,22(14):27-31.[ Ran L D,Cai X L,Liu X M,Wen G R,Jin H,Tuo B G. 2015. Research progress on the func‐tion and significance of SLC26 protein family[J]. China Modern Medcine,22(14):27-31.]
赵旺生,李柯锐,张婷婷,潘美兰,王鹏,李春海,张鹏,张永德. 2023. 基于高通量转录组测序的牦牛和犏牛附睾尾部差异表达基因分析[J]. 南方农业学报,54(5):1273-1282.[ Zhao W S,Li K R,Zhang T T,Pan M L,Wang P,Li C H,Zhang P,Zhang Y D. 2023. Differentially expressed genes between epididymal cauda of yak and cattleyak based on high-throughput transcriptome sequencing[J]. Journal of Southern Agriculture,54(5):1273-1282.] doi:10.3969/j.issn.2095-1191.2023.05.001.
Bernardino R L,Carrageta D F,Sousa M,Alves M G,Oliveira P F. 2019. pH and male fertility:Making sense on pH homeodynamics throughout the male reproductive tract[J]. Cellular and Molecular Life Sciences,76:3783-3800. doi:10.1007/s00018-019-03170-w.
Breton S,Nair A V,Battistone M A. 2019. Epithelial dynamics in the epididymis:Role in the maturation,protection,and storage of spermatozoa[J]. Andrology,7(5):631-643. doi:10.1111/andr.12632.
Breton S,Ruan Y C,Park Y J,Kim B. 2016. Regulation of epi‐thelial function,differentiation,and remodeling in the epi‐didymis[J]. Asian Journal of Andrology,18(1):3-9. doi:10.4103/1008-682X.165946.
Chan H C,Ruan Y C,He Q,Chen M H,Chen H,Xu W M,Chen W Y,Xie C,Zhang X H,Zhou Z. 2009. The cystic fibrosis transmembrane conductance regulator in reproduc‐tive health and disease[J]. The Journal of Physiology,587(10):2187-2195. doi:10.1113/jphysiol.2008.164970.
Chávez J C,Hernández-González E O,Wertheimer E,Visconti P E,Darszon A,Treviño C L. 2012. Participation of the Cl-/HCO3- exchangers SLC26A3 and SLC26A6,the Cl- chan‐nel CFTR,and the regulatory factor SLC9A3R1 in mouse sperm capacitation[J]. Biology of Reproduction,86(1):1-14. doi:10.1095/biolreprod.111.094037.
Chen W Y,Xu W M,Chen Z H,Ni Y,Yuan Y Y,Zhou S C,Zhou W W,Tsang L L,Chung Y W,Höglund P,Chan H C,Shi Q X. 2009. Cl- is required for HCO3- entry neces‐sary for sperm capacitation in guinea pig:Involvement of a Cl-/HCO3- exchanger( SLC26A3) and CFTR1[J]. Biology of Reproduction,80(1):115-123. doi:10.1095/biolreprod. 108.068528.
Dacheux J L,Dacheux F. 2014. New insights into epididymal function in relation to sperm maturation[J]. Reproduction,147(2):R27-R42. doi:10.1530/rep-13-0420.
Delgado-Bermúdez A,Yeste M,Bonet S,Pinart E. 2022. A review on the role of bicarbonate and proton transporters during sperm capacitation in mammals[J]. International Journal of Molecular Sciences,23(11):6333. doi:10.3390/ijms23116333.
Dirami T,Rode B,Jollivet M,da Silva N,Escalier D,Gaitch N,Norez C,Tuffery P,Wolf J P,Becq F,Ray P F,Dulioust E,Gacon G,Bienvenu T,TouréA. 2013. Mis‐sense mutations in SLC26A8,encoding a sperm-specific activator of CFTR,are associated with human asthenozoo‐spermia[J]. The American Journal of Human Genetics,92(5):760-766. doi:10.1016/j.ajhg.2013.03.016.
El Khouri E,Whitfield M,Stouvenel L,Kini A,Riederer B,Lores P,Roemermann D,di Stefano G,Drevet J R,Saez F,Seidler U,Touré A. 2018. Slc26a3 deficiency is associa-ted with epididymis dysplasia and impaired sperm fertiliza‐tion potential in the mouse[J]. Molecular Reproduction and Development,85(8-9):682-695. doi:10.1002/mrd. 23055.
Gałęska E,Wrzecińska M,Kowalczyk A,Araujo J P. 2022. Reproductive consequences of electrolyte disturbances in domestic animals[J]. Biology,11(7):1006. doi:10.3390/biology11071006.
Gervasi M G,Visconti P E. 2017. Molecular changes and sig‐naling events occurring in spermatozoa during epididymal maturation[J]. Andrology,5(2):204-218. doi:10.1111/andr.12320.
Hediger M A,Romero M F,Peng J B,Rolfs A,Takanaga H,Bruford E A. 2004. The ABCs of solute carriers:Physio-logical,pathological and therapeutic implications of human membrane transport proteins[J]. Pflügers Archiv,447:465-468. doi:10.1007/s00424-003-1192-y.
Jing X P,Ding L M,Zhou J W,Huang X D,Degen A,Long R J. 2022. The adaptive strategies of yaks to live in the Asian highlands[J]. Animal Nutrition,9:249-258. doi:10.1016/j.aninu.2022.02.002.
Kendall N R,McMullen S,Green A,Rodway R G. 2000. The effect of a zinc,cobalt and selenium soluble glass bolus on trace element status and semen quality of ram lambs[J]. Animal Reproduction Science,62(4):277-283. doi:10. 1016/s0378-4320(00)00120-2.
Khan R U,Rahman Z U,Javed I,Muhammad F. 2012. Effect of vitamins,probiotics and protein on semen traits in post-molt male broiler breeders[J]. Animal Reproduction Scien-ce,135(1-4):85-90. doi:10.1016/j.anireprosci.2012.09.005.
Lin L,Yee S W,Kim R B,Giacomini K M. 2015. SLC trans‐porters as therapeutic targets:Emerging opportunities[J]. Nature Reviews Drug Discovery,14(8):543-560. doi:10. 1038/nrd4626.
Liu Y,Wang D K,Chen L M. 2012. The physiology of bicar‐bonate transporters in mammalian reproduction[J]. Bio-logy of Reproduction,86(4):1-13. doi:10.1095/biolre‐prod.111.096826.
Maruyama S Y,Ito M,Ikami Y,Okitsu Y,Ito C,Toshimori K,Fujii W,Yogo K. 2016. A critical role of solute carrier 22a14 in sperm motility and male fertility in mice[J]. Scien-tific Reports,6(1):36468. doi:10.1038/srep36468.
Medina J F,Recalde S,Prieto J,Lecanda J,Sáez E,Funk C D,Vecino P,van Roon M A,Ottenhoff R,Bosma P J,Bakker C T,Oude Elferink R P J. 2003. Anion exchanger 2 is essential for spermiogenesis in mice[J]. Proceedings of the National Academy of Sciences of the United States of America,100(26):15847-15852. doi:10.1073/pnas.2536 127100.
Narasimhaiah M,Arunachalam A,Sellappan S,Mayasula V K,Guvvala P P,Ghosh S K,Chandra V,Ghosh J,Kumar H. 2018. Organic zinc and copper supplementation on antioxi‐dant protective mechanism and their correlation with sperm functional characteristics in goats[J]. Reproduction in Domestic Animals,53(3):644-654. doi:10.1111/rda. 13154.
Navarro B,Kirichok Y,Clapham D E. 2007. Ksper,a pH-sensitive K+ current that controls sperm membrane poten‐tial[J]. Proceedings of the National Academy of Sciences of the United States of America,104(18):7688-7692. doi:10.1073/pnas.0702018104.
Pholpramool C,Borwornpinyo S,Dinudom A. 2011. Role of Na+/H+ exchanger 3 in the acidification of the male repro‐ductive tract and male fertility[J]. Clinical and Experimen‐tal Pharmacology and Physiology,38(7):403-409. doi:10. 1111/j.1440-1681.2011.05525.x
Rahman H U,Qureshi M S,Khan R U. 2014. Influence of dietary zinc on semen traits and seminal plasma antioxi‐dant enzymes and trace minerals of beetal bucks[J]. Re-production in Domestic Animals,49(6):1004-1007. doi:10.1111/rda.12422.
Saaranen M,Suistomaa U,Kantola M,Saarikoski S,Vanha-Perttula T. 1987. Lead,magnesium,selenium and zinc in human seminal fluid:Comparison with semen parameters and fertility[J]. Human Reproduction,2(6):475-479. doi:10.1093/oxfordjournals.humrep.a136573.
Shah M A,Xu C F,Wu S X,Zhao W S,Luo H,Yi C P,Liu W J,Cai X. 2018. Isolation and characterization of spermato‐genic cells from cattle,yak and cattleyak[J]. Animal Re-production Science,193:182-190. doi:10.1016/j.anirepro‐sci.2018.04.067.
Touré A,Lhuillier P,Gossen J A,Kuil C W,Lhôte D,Jégou B,Escalier D,Gacon G. 2007. The testis anion transporter 1 (Slc26a8) is required for sperm terminal differentiation and male fertility in the mouse[J]. Human Molecular Genetics,16(15):1783-1793. doi:10.1093/hmg/ddm117.
Touré A. 2019. Importance of SLC26 transmembrane anion exchangers in sperm post-testicular maturation and fertili-zation potentia[l J]. Frontiers in Cell and Developmental Biology,7:230. doi:10.3389/fcell.2019.00230.
(责任编辑 兰宗宝)

