条斑紫菜优良品系的基因芯片表达谱分析
陈淑吟+陆勤勤+张美如+陈国耀+许广平
摘 要:利用基因芯片表达谱比较不同特色条斑紫菜品系的基因差异表达,分析其基因与性状差异相关性。结果显示:(1)筛选出在06DO、L0601与HAI等3个样本有共同表达的差异基因900个,占筛选基因总数(19 884个)的4.53%;样本06DO与L0601共有500个差异表达基因,与HAI的差异表达基因780个;L0601与HAI有最多差异共表达基因(972个),但差异表达水平较低;L0601在不同组中皆有较多差异表达优势基因。(2)将这些差异表达基因进行GO功能富集分类,主要涉及蛋白质代谢、光合作用、离子绑定、营养物质合成过程等分类;属于细胞组成的功能基因很少;不同组比较得到的差异表达基因的功能与富集分类表现出的与品系自身特色性状有一定相关性。
关键词:条斑紫菜;基因芯片表达谱;优良品系;差异表达基因
中图分类号:Q949.29+1 文献标识码: A DOI 编码:10.3969/j.issn.1006-6500.2015.04.002
Expression Profiles Analysis of Gene Chip between New Fine Varieties of Pyropiayezoensis
CHEN Shu-yin, LU Qin-qin, ZHANG Mei-ru, CHEN Guo-yao, XU Guang-ping
(Marine Fisheries Research Institute of Jiangsu Province, Nantong,Jiangsu 226007,China)
Abstract:In this study, using agilent gene expression profile chip, the gene differential expression between new high quality varieties with the free conchoce lisgermplasm (sporophytes) was examined. The results indicated that 900 co-expression different genes were obtained from the three groups, they accounted for 4.53% of the total number of genes (19 884). There were differences in 500 genes between the 06DO and the L0601, likewise, 780 genes between the 06DO and the HAI, and 972 genes between the L0601 and HAI. Using GO, these DEG genes were initially classified into different categories, including response to photosynthesis, response to stress, protein synthesis and transcription, and so on. The results show that the different characters of strains are involves in many changes of variety related genes. This study will contribute to provide some useful clues to illuminate the molecular genetics mechanism of the different characters between the strains.
Key words: Pyropiayezoensis; gene chip expression profiles; fine varieties; differentially expressed genes
条斑紫菜(Pyropiayezoensis)为我国长江以北、日本和韩国等沿海地区栽培的一种大型红藻,其生产在我国及世界的海藻产业中占有重要经济地位。有关条斑紫菜丰富的遗传资源、优良品系选育及其相关遗传性状的功能基因等研究,对于遗传育种发展非常有用。随着测序技术的快速应用,为基于DNA水平的紫菜分子遗传学研究提供了高效率技术支持。目前,条斑紫菜中已克隆并应用研究了多个抗性相关功能基因[1-2]。牛建峰等[3]通过条斑紫菜低覆盖度全基因组测序,得出26 629个预测基因。为研究鉴定出Pyropiatenera在高温胁迫下的基因表达情况,San等[4]进行高温条件下的条斑紫菜转录组研究,得到了368 334条EST序列,并分析得到已知功能的大部分转录本属于heat shock protein family。Nakamura等[5]利用454测序技术对条斑紫菜进行了基因组测定,获得了2 069个已知基因及预测CDS序列10 327条。而利用条斑紫菜已有的这些大量的EST、CDS等序列,来寻找与其生长发育、抗病和抗逆性相关的基因更是一种快速有效的方法。以紫菜等大型海洋藻类(Seaweeds)价值性状筛选为目标的分子育种设计研发,将有助于提高藻类栽培可靠性[6]。针对选育的具特色性状的优良新种质,相关表型特征、性能指标等的遗传机制研究备受关注,尤其是与品种产量、抗性相关的重要经济性状调控机理的研究,已成为近年来国家发展农业产业的重点内容。
基因芯片(Gene chip)表达谱具有通量高、速度快的特点,可以同时检测多个试验样本,并对功能基因一次性进行大规模定量分析。作为研究基因功能的重要手段,基因表达谱芯片已被广泛应用于揭示大量基因的表达和调控情况,为利用生物技术手段提高物种抗逆境胁迫能力提供依据。通过检测基因表达的改变情况,对差异基因进行进一步的功能研究,基因芯片这一优势是其他技术不能达到的[7]。
本研究中,借助已公布的条斑紫菜22 431条EST序列(NCBI数据库)、紫菜属其他种类的相应基因DNA序列信息,采用包含近20 000个基因探针的Agilent新型基因芯片,检测、比较两个条斑紫菜优良新品系的差异表达基因,查找可能与其品系突出性状表现相关的功能基因,为优良品系遗传学研究提供基础依据。
1 材料和方法
1.1 样品材料与RNA提取
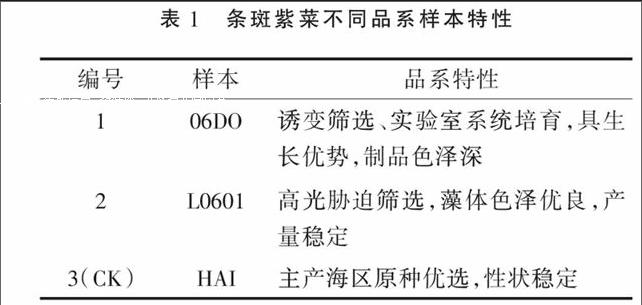
用于试验的样本材料为国家紫菜种质库保有,并为同时间、同一培育条件下的无污染自由丝状体阶段样本。品系编号及特性见表1。
取样本丝状体组织50~250 mg,经无菌水清洗干净并吸去水分后,采用试剂盒mirVanaTM RNA Isolation Kit(Applied Biosystemp/n AM1556)提Total RNA。使用QIAGEN RNeasyR Kit纯化总RNA。样本的总RNA利用NanoDrop ND-2000(Thermo Scientific)定量,由Agilent Bioanalyzer2100(Agilent Technologies)检测RNA完整性。
1.2 条斑紫菜Oligo芯片设计与订制
从NCBI数据库下载紫菜属(Porphyra)的EST序列及Nucleotide序列等,结合文献中预测的基因序列一起归并,利用cdhit软件处理,阈值设置为0.95,序列相似性在95%以上的保留最长的1条序列,得到非冗余序列21 855条用于探针设计。每条序列设计1条探针,共设计长度60 mer探针19 827条。随机选取500条探针重复10次,其余19 327条探针重复2次,另有安捷伦(Agilent)对照探针数(阳性对照+阴性对照)1 417条。
1.3 芯片杂交与扫描
RNA质检合格后,总RNA反转录成双链cDNA,再进一步合成用Cyanine-3-CTP(Cy3)标记的cRNA。cRNA在配制好的片段化混合液中60 ℃温浴30 min进行片段化,冰浴1 min,加入2X GEx Hybridization Buffer 混匀,上芯片,65 ℃、17 h、10 r·min-1滚动杂交。杂交后芯片于洗液中洗脱,利用Agilent Scanner G2505C(Agilent Technologies)扫描仪扫描,分辨率为5 μm,扫描仪自动以100%和10%PMT各扫描1次,两次结果Agilent软件可自动合并得到原始图。
1.4 数据分析与差异表达基因筛选
采用Feature extraction 软件(Version10.7.1.1, Agilent technologies)处理原始图像提取原始数据,接着利用Genespring软件(Version 12.5;Agilent technologies)进行Quantile标准化。标准化后的数据进行过滤,在用于比较的每组样本中至少有一组100%标记为Detected的探针留下进行后续分析。
利用差异倍数Fold change(FC)值进行筛选,标准为FC值>= 2.0,表示组间差异倍数大于或等于2,负值表示下调,FC(abs)表示组间差异倍数的绝对值。对样本结果进行比较,当FC(abs)大于 2 或小于 0.5 时,视为差异表达基因发生有意义表达变化。差异表达基因分别提交GO(GeneOniology)数据库,按GO的3个Ontology,分别描述基因的分子功能(Molecular function,MF)、所处的细胞位置(Cellular component,CC)、参与的生物过程(Biological process,BP),对差异基因进行GO功能分类注释,判定差异基因主要影响的生物学功能或通路。
2 结果与分析
2.1 芯片试验结果评估
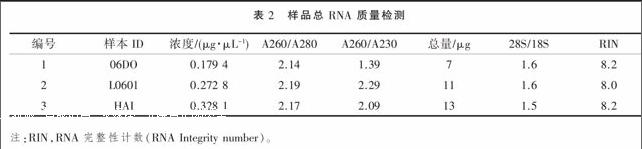
试验制备的 RNA 的纯度、浓度、完整性和总量均符合后续研究要求,见表2。另外,利用 Agilent 软件对杂交芯片扫描图进行质量分析,表明芯片样本背景信号值与噪点值都在适当范围内,芯片数据质量较高。芯片数据的散点图评估得出各组数据总体分布趋势正常。
2.2 差异表达基因筛选与GO富集分类
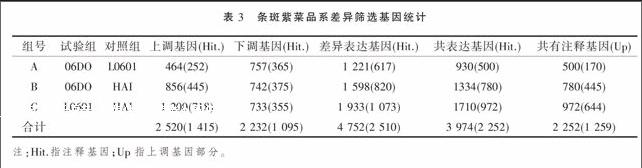
根据基因芯片上的序列信息,及在NCBI数据库中查询表达序列的功能信息,共获得差异未筛选基因19 884个,其中有注释基因10 913个(占54.88%)。表3为各组比较的结果统计,在3个样本中皆有表达的差异基因为900个,其中注释基因486个,C组差异表达基因数最多(1 710个),3组得到的差异表达基因总共有2 252个(表3)。从基因差异水平的分布统计表4中得出,A组差异水平最大,其下调表达幅度最大,C组上调表达基因最多。
利用基因富集分析与GO分类标准从CC、BP、MF等3方面对差异表达基因的功能注释分类,结果表明:基因的GO富集结果主要表现在为MF和BP两大类,其生物学功能均比较集中,主要与光合作用、蛋白质代谢等相关,同时不同组间的差异表达基因富集上各有侧重,A组比较中,没有属于CC的基因分类,C组中没有属于MF的基因分类。
2.2.1 A组(06DO / L0601)的分析 两样本差异表达基因1 221个,占总基因(19 884个)表达比为6.14%。其中,得到注释基因有617个,包括上调的252个基因(54.53%),及下调的有注释基因365个(48.22%)(表3)。上调幅度FC≥10的注释基因中,Cell wall-associated hydrolase表达量最大(412.98),其次是Reverse transcriptase family protein(210.22),Ankyrin repeat-containing protein(100.39),见表5。在上调幅度最大前50个基因中,有28个为蛋白质直接关系基因。在757个下调表达差异基因分布中,差异倍数小于-10的有104个(13.74%),小于-30的有32个,可见在L0601样本中优势表达的基因数量较多,且处于较高水平。这些优势基因中有过半与蛋白质(Protein)直接相关,如:Zinc finger bed domain-containing protein 1-like(-39.23)、60s ribosomal protein(-41.04)、40s ribosomal protein(-39.61)、zinc transporter(-44.05)、 heat shock protein 70(HSP)(-33.53)。这些功能基因中,锌指结构基因具很重要的调控功能,负责与DNA结合而改变基因的表现功能[8];核糖体蛋白质相关基因,主要参与蛋白质的生物合成;HSP则主要与抗旱、高温等逆境胁迫密切联系[9],大量研究表明该基因的高水平表达有助于提高植物的耐热性[10],L0601为高温胁迫筛选得到,在这方面具有更高优势。品种06DO在其它方面具有优势表达基因及表达水平,从这些差异表达基因中反映两品系间差异性状与蛋白质代谢密切联系。
将这些差异表达基因通过GO分析获得MF与BP两大功能分类(图1,图2)。其中:属于MF的有33类(62.26%),主要是DNA聚合酶、化合物活性及离子绑定等相关分子功能;属于BP的有20类(37.74%),多种分子功能有序组成,主要包括有DNA复制、营养物质合成过程等。比较分析的结果表明有关CC的差异基因表达不明显。
将33个MF中的GO基因集归类到5条代谢通路,其中包括3个单一的代谢路径,其一为:GO:0008270、GO:0043169、GO:0046872、GO:0046914及GO:0008270位于同一代谢路径,以基因集GO:0043167末节(Ion binding)连接到GO:0005488(Binding)节点;其二为:GO:0003964、GO:0034061、GO:0016779、GO:0016772及GO:0016740(Ransferase activity),再连接到催化活性GO:0003824(Catalytic activity)节点;其三为:GO:0004190、GO:0004175(或GO:007001)、GO:0070011、GO:0008233及GO:0016787(Hydrolase activity),或由GO:0004519、GO:0004518、GO:0016788到GO:0016787。这些节点中,GO:0016740、GO:0016787、GO:0005488处于关键代谢位置。
BP中,主要功能分类多包括Macromolecule metabolic process(GO:0043170)、Nitrogen compound metabolic process (GO:0006807)及Organic cyclic compound metabolic process(GO:1901360),这些过程与高分子、氮或有机环状化合物代谢相关;并且这些代谢路径呈现相互交错,处于较近层次。
2.2.2 B组(06DO /HAI)的分析 两样本差异表达基因共有1 598个,占筛选基因总数的8.04%,其中共有的差异表达基因为1 334个。有功能注释的占56.82%(908个),690个未知功能基因(Unknown function)占到43.18%。FC≥5的差异表达基因218个;FC≥10的共有85个。
在有共表达的注释780个差异基因中,与蛋白质合成相关基因占有较大比例,上调基因中前50个基因中有23个为蛋白质直接相关基因,包括:Protein product、Reverse transcriptase family protein,见表6;下调幅度最大的50个中,有33个与蛋白质直接相关,如:40s ribosomal proteins13-like、Retrotransposon-derived protein peg10-like、Pol polyprotein、Retrotransposonnucleocapsid protein等。这方面与A组结果相似,而且在上调或下调的差异表达基因中,有部分基因分别与A组相同的(表6中,标为灰色基因)。上调表达量最大的前50个基因中,有16个基因,如:Reverse transcriptase family protein,下调前50个基因中有12个相同,如40s ribosomal protein s13-like,这些基因可能与品系的优势作用基因或反映品系的性能趋势;此外,06DO上调差异基因也同样多在相对较低差异水平,只有4.32%的基因FC≥10;HAI中优势表达基因,其中有 6.47% 的基因FC≥10以上。
将差异表达的注释基因(56.82%)进行GO 功能富集分类,有43.32% 属于BP,共27类(占总的24.61%),主要涉及光合作用及营养盐代谢方面(图3);52.65%属于MF,共38类(占总的29.91%),主要涉及有机杂环化合物质合成、利用等(图4);只有3% 属于CC(占总的1.7%),共有4类,包括:Chloroplast stroma、 Chloroplast、Plastid stroma及Apoplast等叶绿体及质体方面细胞组件。从这些GO富集得到的基因功能分类中也不少与A组的相同,如:BP中有10类相同的,MF中有11类功能相同的,见图3、图4。
2.2.3 C组(L0601/HAI)的结果分析 本组比较得到1 933个差异表达基因,其中有注释的1 073个(55.56%)。两者虽然有较多差异表达基因,但差异表达水平较低。其中,上调基因共表达的644个预测功能基因中,FC>10的有21个,FC >5的90个;下调的328个基因中,FC < -10的只有4个,FC < -5的有19个。上调或下调幅度最大的50个差异基因中,皆有过半为蛋白质直接相关基因,如Predicted protein,Actin,Zinc finger protein等(表7)。
从GO归类得到的功能总共有12类,分属于BP与CC,且均是与光合作用相关的细胞组件及生物学过程(见表8),这反映出样品L0601与HAI的性状较为相近。另外,从这两样本在分别与06DO的比较中发现也有不少相同的差异表达基因,这些相同的差异表达基因可能是各个品系的特色性状相关的品系优势基因,如Zinc transporter、Zinc finger bed domain- containing protein 1-like、Zinc finger protein 524、Heat shock protein70、Fructose- bisphosphatase均在L0601中为优势基因。在B组与C组的比较中,HAI样本均表现有较大优势基因的有:40s ribosomal protein s13-like、60s ribosomal protein、Cell wall-associated partial、Conserved domain protein、Desumoylatingisopeptidase 1-like、Elongation factor tugtp-binding domain-containing protein 1等。
3 结论与讨论
基因芯片技术也称DNA微阵列 (DNAmieroarray),可在短时间内平行地、大量地检测基因表达水平的变化;通过对来源不同的个体、组织等的基因表达情况进行对比分析,对基因群在这些不同状况下的变化特征进行描述,来分析比较差异基因的生物学意义。随着微阵列芯片技术的成熟,基因芯片技术将被用来筛选作物的基因表达水平、基因突变及多态性,并寻找高产量、抗干旱的相关基因[11-13]。利用基因表达谱分析,结合代谢组学和蛋白组学研究,已在阐明植物抗逆机制和发掘植物逆境胁迫响应相关基因方面取得重要进展[14]。
生物的遗传基因决定其生长、物候以及适应性差异。大型海藻的生长,涉及到众多基因的表达与调控。周晓君等[15]选取 467个单个基因的 EST 制备cDNA表达谱芯片,研究不同世代的条斑紫菜基因表达差异,分析发现 55个基因在配子体中表达量上调,86个基因在孢子体中表达量上调。王孟强[16]利用462个位点的cDNA芯片研究了条斑紫菜配子体的在不同失水过程中的基因表达,结果有8.74%~11.09%的基因上调,而下调基因的数量在各个阶段变化较大,同时得到了一批与抗失水胁迫相关的基因。为了研究条斑紫菜无性孢子形成过程中的基因表达,Kitade等[17]选择 4 896 条非重复的 EST 作为探针,结合RT-PCR 或 Northern,分析了条斑紫菜4个不同发育阶段的不同表达候选基因的特异表达。这些研究有助于开发适应于不同生境与品质需求的优良新品种[18-19]。相比野生品系,童冠文通过遗传力分析得出:5个条斑紫菜栽培品系的配子体长宽比性状的差异、单位面积湿质量、干质量以及干湿质量比主要跟品系本身有关[20]。而利用基因芯片检测差异基因表达情况,是一种查找、鉴定相关功能基因,分析品系特色性状的分子机制的高效技术方法。
本文中两个优良新品系06DO与L0601,系江苏南通条斑紫菜主产区人工栽培群体选育的、具有明显特色的优良栽培新品。品系L0601的出苗效果、抗逆水平及栽培生长性状等均表现良好;06DO新品种具有原藻色泽深、品质优良及增产表现等特征。通过以本地优势原种HAI为对照进行比较分析,采用品系在实验室培育的无污染自由丝状体样本,初步分析品系在孢子体阶段的基因差异表达。由于06DO是通过诱变获得,与对照样本差异最多(见表4),其FC小于-10的下调基因有104个。B与A两组中,上调或下调的差异表达基因皆有部分相同,上调基因中皆有大量与蛋白质合成等有直接关系的,在下调基因中均有60s ribosomal protein、Heat shock protein等,但差异基因的表达水平及频率分布均不同;两组基因集的GO分类也各有异同点,根据其功能推测与藻类耐旱机理相关,如光合作用相关基因Polyubiquitin等(表5)。由于品系的不同遗传特性,L0601与 HAI相比较基因差异表达水平较低,且归集的生物学功能简单。
目前,紫菜属已知基因序列信息仍有限,本研究中虽然获得大量差异基因,但有43.18%基因属未知功能。杨惠把获得的序列与数据库比对之后发现,有 56.6%的Unigene没有找到同源序列[21]。随着越来越多的植物全基因组测序的完成,许多重要的功能基因得到克隆和功能解析,为作物改良提供了丰富的基因资源,将对经济植物种类产量、品质、抗性等性状的改良起到越来越重要的作用[22]。
参考文献:
[1] Uji T, Sato R, Mizuta H, et al. Changes in membrane fluidity and phospholipase D activity are required for heat activation of PyMBF1 in Pyropiayezoensis (Rhodophyta) [J]. J Appl Phycol, 2013, 25:1 887-1 893.
[2] Kitade Y, Nakamura M, Uji T, et al. Structural features and gene-expression profiles of actin homologs in Porphyrayezoensis(Rhodophyta) [J].Gene, 2008, 423(1):79-84.
[3] 牛建峰, 高胜寒, 骆迎峰, 等. 条斑紫菜低覆盖度基因组草图分析[J].海洋科学, 2011, 35 ( 6 ): 76- 81.
[4] San C, Mi SH, Sungoh I, et al.Transcriptome sequencing and comparative analysisof the gametophyte thalli of Pyropiatenera under normaland high temperature conditions[J]. J Appl Phycol, 2013, 25:1 237-1 246.
[5] Nakamura Y, Sasaki N, Kobayashi M, et al. The first symbiont-free genome sequence of marine red alga, susabi-nori Pyropiayezoensis[J].PLoS ONE,2013, 8(3):57 122 .
[6] Robinson N, Winberg P, Kirkendale L. Genetic improvement of macroalgae: Status to date and needs for the future[J]. J Appl Phycol, 2013, 25: 703-716.
[7] 刘思言, 沈铖武, 王丕武. 基因芯片技术在植物中的应用研究进展[J].广东农业科学, 2013(8): 136-138.
[8] 沈志锦, 彭克勤, 周浩, 等. 植物微量元素锌的研究进展[J].湖南农业科学, 2007(3): 110-112.
[9] 杨柳, 张振乾, 宋继金, 等. 植物抗逆基因研究进展[J].作物研究, 2010, 24(1): 126-129.
[10] 魏思佳, 戴绍军. 藻类响应环境胁迫的蛋白质组变化研究进展[J].现代农业科技, 2013(3): 244-245.
[11] 孙兵,闫彩霞,张廷婷, 等.基因芯片技术在植物基因克隆中的应用研究进展[J].基因组学与应用生物学,2009,28(1): 153-158.
[12] 贾琪, 吴名耀, 梁康迳, 等. 基因组学在作物抗逆性研究中的新进展[J].中国生态农业学报, 2014, 22(4): 375-385.
[13] 孙丽静,张玮,纪军,等.利用基因芯片分析科农9204小麦高产氮高效机制[J].华北农学报,2014(4):213-220.
[14] 雷东阳, 旷浩源, 陈立云. 利用基因芯片研究植物非生物逆境响应基因表达的进展[J]. 湖南农业大学学报:自然科学版,2012,38(2): 156-161.
[15] 周晓君, 庄筠昀, 茅云翔, 等. 条斑紫菜功能基因芯片研制与应用[J].高技术通讯, 2006, 16(12): 1 233-1 237.
[16] 王孟强. 条斑紫菜功能基因组特性与抗逆相关基因表达分析[D].青岛:中国海洋大学, 2007.
[17] Kitade Y, Asamizu E, Fukuda S, et al. N: Identification of genes preferentially expressed during asexual sporulation in Porphyrayezoensis gametophytes (Bangiales, Rhodophyta). [J]Journal of Phycology, 2008, 44:113-123.
[18] 王华芝, 严兴洪, 李琳. 条斑紫菜(Porphyrayezoensis)耐高温品系的筛选及特性分析[J]. 海洋与湖沼, 2012, 43(2): 363-369.
[19] 付春辉, 严兴洪, 黄林彬.条斑紫菜(Porphyrayezoensis)选育品系壳孢子的放散量与耐高温性研究[J].海洋与湖沼, 2011, 42(3): 461-466.
[20] 童冠文. 条斑紫菜经济性状研究进展[J]. 现代农业科技, 2010(11): 344- 345.
[21] 杨惠. 条斑紫菜功能基因组及重复序列特征研究[D]. 青岛:中国海洋大学, 2011.
[22] 吴健,刘学,王永红.植物重要功能基因研究进展及其应用[J].生命科学,2011,23(2):168-178.
天津农业科学2015年4期
