多糖添加量对玉米醇溶蛋白-葡聚糖接枝物理化特性的影响
摘要:玉米醇溶蛋白(Zein)因水溶性差等问题,限制了其应用。为了解决这一问题,对其糖基化改性,通过接入多糖来改善它的功能特性,扩大其应用范围。采用美拉德湿法利用葡聚糖(DX)对Zein进行糖基化改性,研究不同DX添加量(蛋白、多糖质量比分别为4:1、2:1、1:1和1:2)对Zein改性的影响,通过接枝率、FTIR、溶解度和乳化性等指标对美拉德接枝物的结构和性质进行表征。糖基化改性后,Zein的溶解性、分散性、乳化性等均有较大改善,且改善效果与DX添加量呈正相关。利用美拉德反应DX能与Zein共价连接,亲水性多糖的接入能显著改善Zein的溶解性和乳化性等功能特性,是改善Zein理化特性的有效方法。
关键词:玉米醇溶蛋白;葡聚糖;美拉德反应;理化特性
中图分类号:TS201.2 文献标志码:A DOI:10.16465/j.gste.cn431252ts.20240524
基金项目:沈阳市粮油深加工重点实验室课题基金资助(2023002)。
Effect of polysaccharide addition on physicochemical properties of zein - dextran grafts
Wang Dexiong,Xiao Zhigang,Zhang Yifan, Li Jianan, Zhu Minpeng
(College of Grain Science / Shenyang Key Laboratory of Grain and Oil Deep Processing, Shenyang Normal University, Shenyang, Liaoning 110034)
Abstract: The application of zein was limited due to its poor water solubility. In order to solve this problem, the glycosylation of zein was modified to improve its functional properties and expand its application range by adding polysaccharide. The glycosylation of zein was carried out using dextran (DX) by Maillard method, and the effects of different DX supplemental levels (protein, polysaccharide mass ratio 4:1, 2:1, 1:1 and 1:2, respectively) on zein modification were studied. The structure and properties of Maillard grafts were characterized by grafting rate, FTIR, solubility and emulsification. After glycosylation, solubility, dispersion, emulsification properties of zein were greatly improved, and the improvement effect was positively correlated with the added amount of DX. The addition of hydrophilic polysaccharide can significantly improve the solubility and emulsification of zein, which is an effective method to improve the physicochemical properties of zein.
Key words: zein; glucan; Maillard reaction; physicochemical properties
玉米醇溶蛋白(Zein)是从玉米胚乳中提取出的醇溶性蛋白,是玉米加工副产物玉米黄粉中的主要蛋白质,因其低经济成本,良好的生物降解性和生物相容性,成为流行且用途广泛的生物聚合物之一[1]。同时Zein还是美国食品药品监督管理局(FDA)批准口服使用的少数非亲水蛋白之一。Zein中含有大量的疏水性氨基酸,其中亮氨酸、脯氨酸等疏水性氨基酸占比超过50%,故而使得Zein具有极强的疏水性。这种疏水性结构赋予了Zein出色的物理、化学特性,如能作为乳化剂吸附在油水界面从而稳定乳液。此外,Zein被认为是亲脂性化合物(如维生素D3和β-胡萝卜素)的有效载体,可以保护它们并提高它们的稳定性[2]。一方面因其物理疏水能力使Zein能够构造出负载不同功能成分的输送体系,但另一方面,Zein过强的疏水性成为它应用于食品工业的限制因素[3]。因此,改善其水溶性是扩大Zein应用范围的重要手段。
近年来,蛋白质的糖基化修饰被认为是改善蛋白质性质一个有效方法。通过物理、化学或酶处理将多糖引入到蛋白质结构中,使得蛋白质糖基化产物表面具有更多的亲水性基团和更为疏松的表面结构,从而具有更好的溶解性和乳化性[4]。Kim 等[5]报道牛血清白蛋白和岩藻多糖形成共价复合物后,牛血清白蛋白的热稳定性、乳化活性和乳化稳定性均得到改善。在Zein和大豆多糖的糖基化反应中发现,大豆多糖与Zein通过美拉德反应进行糖基化接枝后,Zein的润湿性和乳化性都有较大的改善[6]。
美拉德反应是食品加工中的一种常见的褐变反应,因为主要是羰基化合物(还原糖)和氨基化合物(蛋白质和氨基酸)之间的反应,所以又称为羰氨反应[7]。通过与多糖发生美拉德反应来改善蛋白质的功能特性,其核心是引入多糖丰富的亲水性羟基,来改善美拉德接枝物的亲水亲油平衡。葡聚糖(DX)是一种水溶性多糖,其具有简单的直链结构和良好的水溶性及稳定性,因此被广泛应用于蛋白质的糖基化研究中。
本研究通过湿法美拉德反应,利用葡聚糖对玉米醇溶蛋白进行糖基化接枝改性,引入亲水性羟基来改善玉米醇溶蛋白的理化特性,扩大其应用范围,并探究了不同玉米醇溶蛋白、葡聚糖反应底物质量比对美拉德接枝物理化性质的影响,为更好地改善玉米醇溶蛋白理化性质提供了理论和实践借鉴。
1 材料与方法
1.1 材料和试剂
玉米醇溶蛋白(Zein)(纯度≥ 99.5%):美国Sigma公司;葡聚糖(DX)(相对分子质量: 20 kDa,纯度≥ 99.5%)、邻苯二甲醛(OPA)、β-巯基乙醇、蛋白Marker:上海麦克林生化科技有限公司;氢氧化钠、盐酸、十二烷基硫酸钠(SDS)、Tris、TEMED、双缩脲试剂、磷酸盐缓冲液、溴酚蓝、甲醇、无水乙醇、乙酸:国药集团化学试剂有限公司;牛血清白蛋白(BSA)、乙醇(95%)、丝氨酸标准品:上海阿拉丁有限公司,本研究中使用的化学试剂均为分析纯。
1.2 仪器与设备
UV-1200S型紫外可见分光光度计:上海奥仪电器有限公司;Scientz-10N普通型真空冷冻干燥机:宁波新芝生物科技股份有限公司;Mini-PROTEAN Tetra System型化学发光凝胶成像系统:美国伯乐公司;Nicolet 5700型傅立叶变换红外光谱仪:美国 Nicolet 公司;F97型荧光光谱仪:上海棱光科技有限公司;pHS-3E型酸度计:上海仪电科学仪器股份有限公司;数显恒温磁力搅拌水浴锅:上海汗诺仪器有限公司;H1850型高速离心机:湖南湘仪集团。
1.3 实验方法
1.3.1 玉米醇溶蛋白-葡聚糖接枝物的制备
根据Hu等[8]的研究方法并稍加修改,通过美拉德反应制备得到玉米醇溶蛋白-葡聚糖接枝物。将不同质量比的玉米醇溶蛋白和葡聚糖(4 : 1、2 : 1、1 : 1和1 : 2)分别溶解在95%的乙醇溶液和去离子水中(1 : 10,质量浓度)。待溶解后,将玉米醇溶蛋白和葡聚糖溶液混合,用0.1 mol/L NaOH将混合溶液调节pH至9.0后搅拌10 min。然后在85 ℃水浴中热处理2 h,冰水浴冷却至室温,8 000 r/min离心5 min分离取上清液,调节pH至7.0,冷冻干燥即得玉米醇溶蛋白-葡聚糖美拉德接枝物,接枝物储存在-18 ℃备用。在不添加葡聚糖的条件下,用相同方法处理玉米醇溶蛋白,作为对照。玉米醇溶蛋白(Zein):经过热处理的玉米醇溶蛋白,不添加葡聚糖。玉米醇溶蛋白-葡聚糖接枝物(Zein-DX):根据蛋白、多糖质量比(4 : 1、2 : 1、1 : 1和1 : 2)分别标记为Zein-DX(4 : 1)、Zein-DX(2 : 1)、Zein-DX(1 : 1)和Zein-DX(1 : 2)。
1.3.2 接枝度测定

式中:DG为接枝度%;AC为对照样品的吸光度;AS为样品的吸光度。
1.3.3 褐变强度的测定
参考赵城彬等[9]的方法,采用0.1 g/100 mL的SDS溶液将样品溶液稀释至蛋白质量浓度为0.2 g/100 mL,空白样为SDS溶液,在420 nm波长处测定吸光度A420 nm,以A420 nm表示褐变强度。
1.3.4 SDS-PAGE 分析
采用Laemmli等[10]的方法对玉米醇溶蛋白与多糖的美拉德接枝物进行SDS-PAGE凝胶电泳分析。分离胶浓度为12%,浓缩胶浓度为5%,将Zein与Zein-DX接枝物溶于上样缓冲液中,配制浓度为1 mg/mL,然后在100 ℃下沸水浴中加热5 min,上样量为15 μL。在tris-甘氨酸-SDS样品缓冲液中以80 V和120 V电压进行电泳。最后使用化学发光凝胶成像系统获取凝胶图像。
1.3.5 FTIR 分析
参考邓瑜等[11]的方法,对其进行修改后,按照1∶100的质量比称取样品和溴化钾粉末并混合,充分研磨后称取 80 mg,用压片机压成薄片,装入夹具后用傅里叶红外光谱仪进行扫描。扫描范围为4 000~500 cm-1,扫描次数为32,分辨率为4 cm-1。使用Origin 2021软件收集和处理数据。
1.3.6 蛋白质溶解度和分散性

其中,C1为样品总蛋白含量,C2为上清液中蛋白含量。
将样品分散于浓度为1 mg /mL的蒸馏水中,搅拌1 h。静置5 min后,通过分析样品分散体在600 nm波长下的浊度,并拍摄样品分散体的照片来分析蛋白在水溶液中的分散性。
1.3.7 乳化性(EAI)和乳化稳定性(ESI)测定

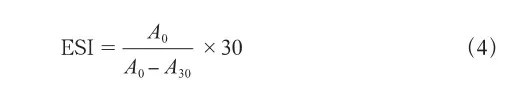
式中:A0和A30分别为第0、30 min时的吸光度;DF为稀释倍数(100);C为蛋白质质量浓度(g/mL);φ为乳状液中油相所占比例(0.5)。
1.3.8 统计分析
每组实验重复3次,采用SPSS V17.0软件进行ANOVA差异显著性分析,作图采用Origin 2021软件完成,P<0.05为显著性差异。
2 结果与分析
2.1 Zein-DX糖基化产物接枝度和褐变强度分析
美拉德反应是使多糖的还原端羰基共价连接在蛋白质的游离氨基上的反应[13]。因此,可以通过糖基化程度或褐变程度来表示蛋白与多糖的接枝程度。由图1可知,随着葡聚糖质量比的增加,接枝物的接枝度逐渐增加,在葡聚糖与玉米醇溶蛋白的质量比为 2∶1 时接枝度最大为28.1%。糖基化反应过程中能够产生褐色物质,将各自的美拉德接枝物稀释后,在其典型的表征褐变的420 nm波长测其吸光度,颜色越深,吸光度越大,表明反应越剧烈,反应越充分。如图1所示,420 nm波长处吸光值的增加表明褐变程度与葡聚糖添加量呈正相关,随着葡聚糖添加量的增大,玉米醇溶蛋白和葡聚糖的糖基化反应生成的接枝产物增多。

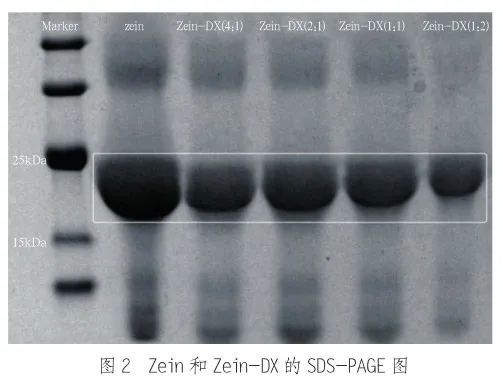
2.2 SDS-PAGE分析
为了进一步确认Zein与DX之间美拉德的反应,对Zein-DX进行了SDS-PAGE研究。图2为Zein以及不同DX质量比条件下制备的Zein-DX电泳图。对照组Zein的主带对应于20~25 kDa的位置,这是α-玉米醇溶蛋白的典型特征。而Zein-DX的条带均出现在Zein的上方,这说明接枝物相对分子质量大于Zein的相对分子质量,证明了多糖的接入使产物相对分子质量的增加。并且DX的质量比越大,产物的相对分子质量也越大,其电泳条带越靠近上方,这可归因于玉米醇溶蛋白-葡聚糖接枝物接枝度的提高。当与葡聚糖结合时,燕麦分离蛋白也有类似的结果[14]。值得注意的是,上样液中的SDS和β-巯基乙醇可以破坏蛋白质与多糖之间的非共价相互作用,所以玉米醇溶蛋白与葡聚糖的共价结合(美拉德反应)是美拉德接枝物相对分子质量增加的主要原因。
2.3 FTIR 光谱分析
蛋白质红外光谱中有几个易于识别的区域,包括酰胺Ⅰ带(1 700~1 600 cm-1)、酰胺Ⅱ带(1 600~ 1 500 cm-1)和酰胺Ⅲ带(1 500~1 200 cm-1)[15]。这些特殊区域通常用于蛋白质的分析,因为形成酰胺基团(C—O、N—H、C—N)键的特征带与美拉德反应产物有关。如图3,对于Zein-DX接枝物来说,1 654 cm-1 和 1 540 cm-1 处的吸收峰分别代表酰胺I带中C=O 伸缩振动与 N-H 伸缩振动,其吸收峰显著增强,这可能是美拉德反应中葡聚糖与蛋白的游离氨基作用的结果[6]。同时,美拉德反应过程中可生成吡嗪(C—N)、席夫碱(C = N)等物质,而导致了峰强度和位置的改变。在研究大豆分离蛋白和羧甲基纤维素的糖基化产物时,也观察到了相同的现象[16]。与Zein相比,Zein-DX糖基化产物在1 012 cm-1附近都出现了新的吸收峰,此为C—N糖苷键的特征吸收峰,说明Zein和DX间形成了共价键。此外,接枝物在3 700~3 200 cm-1区域的吸收峰强度增加,此区域吸收峰是—OH伸缩振动引起的,表明糖基化产物中羟基含量增加,其原因是引入的DX自身携带了大量的羟基。
2.4 蛋白质溶解度和分散性
溶解性是蛋白质最重要的性质之一,对其许多功能特性和应用都有重要影响。Zein分子含有50%以上的非极性和疏水性氨基酸残基,这种独特的氨基酸组成,使其在水中的溶解性较差,只溶于55%~90%的乙醇-水溶液以及强碱溶液等,使其应用受到限制[17]。由图4可知,Zein几乎不溶于水,而与DX发生糖基化反应之后,其溶解度显著提高,DX的添加量越大则Zein-DX的溶解度越高。Zein-DX(1:2)的溶解度为16.6%是Zein溶解度(1.6%)的十倍。其主要原因是通过美拉德反应将更多的葡聚糖的亲水性羟基连接到了蛋白质的氨基酸残基上,改善了Zein的亲水性,从而提高了蛋白质的溶解度,同时DX与Zein结合后提供的空间效应也可能抑制Zein在水中由于静电作用而产生地再聚集效应。Wang等[18]在Zein和壳聚糖的糖基化研究中发现,使用不同的蛋白、多糖摩尔比(1∶1、1∶2、1∶3、1∶4、1∶5)均能显著提高Zein的溶解性。以蛋白质溶液表征了Zein-DX接枝物在水中的分散性。如图5所示,Zein在水中分散性较差,静置10 min 后,大部分Zein 都沉到底部,故溶液的吸光度较低,而Zein-DX接枝物,在水中分散性明显增强,大部分Zein-DX接枝物颗粒能够在水中均匀分散,溶液的吸光度值也显著高于Zein,其原因可能是Zein通过与DX的糖基化反应引入了更多的亲水性羟基,在提高了溶解性的同时,其在水中的分散性也得到了改善。

2.5 乳化性与乳化稳定性
蛋白质的乳化特性是指其使水和油混在一起成为乳状液的能力,包括乳化活性和乳化稳定性。由图7可知,Zein的EAI和ESI分别为5.1 m2/g和13.7%,无法形成稳定的乳液,而Zein糖基化后的产物的EAI和ESI均显著提高,且随着DX用量的增加,EAI和ESI不断增大。 其中Zein-DX(1∶2)改善效果最好,其EAI和ESI能达到18.6 m2/g和42.4%。Zein-DX乳化性能提高的主要原因是亲水性的增加,使得美拉德接枝物具有良好的亲水、亲油平衡,蛋白质-多糖接枝物能够在液滴附近形成混合的多分子层结构,从而降低液滴的聚集程度,达到改善乳化性的目的[19],其次与多糖的糖基化反应可能改变蛋白质的结构和表面携带的电荷,蛋白质分子间静电斥力的增加产生空间位阻,导致形成更小的液滴,减少液滴的絮凝和聚集,从而增加乳液的稳定性[20]。
3 结 论
利用湿法美拉德的反应,制备了玉米醇溶蛋白-葡聚糖接枝物,并研究了葡聚糖/玉米醇溶蛋白质量比对美拉德接枝物结构和功能特性的影响。研究结果表明,糖基化反应的接枝度和产物的褐变强度都与葡聚糖的添加量呈正相关,同时蛋白质表现出相对分子质量的增加和结构上的改变,在糖基化作用下,蛋白质的C=O伸缩振动与 N—H伸缩振动增强,并新出现了C—N糖苷键的特征吸收峰。糖基化反应能够显著,提高其在水中的溶解度和分散性,这主要是因为亲水性多糖的接入所导致的。同时溶解度的增加使得接枝物拥有更好的乳化性能,随着葡聚糖质量比的增大,糖基化接枝对Zein的乳化性能的改善也愈发显著。表明对Zein进行糖基化处理,能够显著改善其理化性质和功能特性,为Zein作为乳化剂应用在食品领域提供了理论支持,拓宽了玉米醇溶蛋白的应用范围。


参 考 文 献
[1] SUN Y, WEI Z, XUE C. Development of zein-based nutraceutical delivery systems: a systematic overview based on recent researches[J]. Food Hydrocolloids, 2023, 137: 108368.
[2] SOUZA E M C, FERREIRA M R A, SOARES L A L. Pickering emulsion stabilized by zein particles and their complexes and possibilities of use in the food industry: a review[J]. Food Hydrocolloids, 2022, 131: 107781.
[3] BA C, FU Y, NIU F, et al. Effects of environmental stresses on physiochemical stability of β-carotene in zein-carboxymethyl chitosan-tea polyphenols ternary delivery system[J]. Food Chemistry, 2020, 311: 125878.
[4] KAN X, CHEN G, ZHOU W, et al. Application of proteinpolysaccharide Maillard conjugates as emulsifiers: source, preparation and functional properties[J]. Food Research International, 2021, 150: 110740.
[5] KIM D Y, SHIN W S. Functional improvements in bovine serum albumin–fucoidan conjugate through the Maillard reaction[J]. Food chemistry, 2016, 190: 974-981.
[6] YAO L, WANG Y, HE Y, et al. Pickering emulsions stabilized by conjugated zein-soybean polysaccharides nanoparticles: fabrication, characterization and functional performance[J]. Polymers, 2023, 15(23): 4474.
[7] 罗章, 辜雪冬, 张玉凤,等. 咸蛋清蛋白酶解液美拉德反应条件优化及挥发性风味物质分析[J].粮食科技与经济, 2020, 45(9): 118-125.
[8] HU B, WANG K, HAN L, et al. Pomegranate seed oil stabilized with ovalbumin glycated by inulin: Physicochemical stability and oxidative stability[J]. Food Hydrocolloids, 2020, 102: 105602.
[9] 赵城彬,张浩,许秀颖,等.不同分子质量葡聚糖对玉米醇溶蛋白糖基化产物结构和功能性的影响[J].食品科学, 2018, 39(16): 68-73.
[10] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227(5259): 680-685.
[11] 邓瑜,孔令艳,薛梅,等.基于Pickering乳液模板法制备的芝麻素微胶囊性能表征[J].粮食科技与经济, 2023, 48(3): 108-111.
[12] MOLINA E, PAPADOPOULOU A, LEDWARD D A. Emulsifying properties of high pressure treated soy protein isolate and 7S and 11S globulins[J]. Food Hydrocolloids, 2001, 15(3): 263-269.
[13] DE OLIVEIRA F C, COIMBRA J S R, DE OLIVEIRA E B, et al. Food protein-polysaccharide conjugates obtained via the Maillard reaction: a review[J]. Critical Reviews in Food Science and Nutrition, 2016, 56(7): 1108-1125.
[14] ZHANG B, GUO X, ZHU K, et al. Improvement of emulsifying properties of oat protein isolate–dextran conjugates by glycation[J]. Carbohydrate Polymers, 2015, 127: 168-175.
[15] BYLER D M, SUSI H. Examination of the secondary structure of proteins by deconvolved FTIR spectra[J]. Biopolymers: Original Research on Biomolecules, 1986, 25(3): 469-487.
[16] SU J F, HUANG Z, YUAN X Y, et al. Structure and properties of carboxymethyl cellulose/soy protein isolate blend edible films crosslinked by Maillard reactions[J]. Carbohydrate Polymers, 2009, 79(1): 145-153.
[17] XU Y, WEI Z, XUE C, et al. Assembly of zein- polyphenol conjugates via carbodiimide method: evaluation of physicochemical and functional properties[J]. LWT-Food Science and Technology, 2022, 154: 112708.
[18] WANG X J, ZHENG X Q, LIU X L, et al. Preparation of glycosylated zein and retarding effect on lipid oxidation of ground pork[J]. Food Chemistry, 2017, 227:335-341.
[19] PUGNALONI L A, DICKINSON E, ETTELAIE R, et al. Competitive adsorption of proteins and low-molecular-weight surfactants: computer simulation and microscopic imaging[J]. Advances in Colloid and Interface Science, 2004, 107(1): 27-49.
[20] WANG Y, LI D, WANG L J, et al. The effect of addition of flaxseed gum on the emulsion properties of soybean protein isolate (SPI)[J]. Journal of Food Engineering, 2011, 104(1): 56-62.

