离子液体辅助药物经皮递送的研究进展
江紫荆,淦甜甜,孙勇兵,张琦,金一,奉建芳,3,涂亮星
(1.江西中医药大学中药固体制造技术国家工程研究中心,江西 南昌 330006;2.江西中医药大学生命科学学院,江西 南昌 330006,3.广西中医药大学药学院,广西 南宁 530200)
经皮给药系统具有避免肝脏首过效应、胃肠道酶解、持续的治疗作用和较好的患者依从性等优点,被认为是安全、无创给药的有效途径[1]。然而,由于皮肤具有复杂的结构,特别是最外层角质层,阻碍了药物向皮肤更深层次渗透[2⁃3]。原料药、小分子和生物制品因其巨大的尺寸和物理化学性质而不具备独立穿透皮肤角质层的能力,需要与皮肤微环境兼容的递送载体来促进药物透皮吸收。
基于皮肤的独特结构以及药物的理化性质,研究人员提出了各种方法来改善药物的渗透,包括物理方法(电穿孔、超声渗透)、化学方法(化学渗透促进剂)和制剂(微乳、固体脂质纳米粒)[4]。在某些情况下,离子液体(ionic liquids,ILs)具有比其他传统增强策略更有效的增强效果,这归因于其改变皮肤屏障功能和改变药物物理化学性质的多重功能:可逆改变皮肤最大屏障角质层,促进药物透皮吸收;由相对较大体积的不对称阳离子和阴离子组成,熔点一般小于100 ℃[5];通过改变阴阳离子比、阴离子烷基链、阴阳离子种类调整其性质,从而改善药物的溶解性[6⁃7];在经皮给药系统中既是促进剂又是溶剂,可使局部高浓度持续可控给药,能够深入皮肤且显示抗菌活性[2];可以制成胶束、乳剂等,或与其他技术结合促进药物透皮吸收[8]。
本文综述了皮肤结构,适用于经皮递送的ILs阴阳离子种类及其优缺点,药物经皮吸收的途径,及ILs 促进药物透皮吸收的机制,分类介绍了影响ILs 促进药物皮肤吸收的因素,以期为透皮制剂研究提供新的思路。
1 皮肤结构及ILs的阴阳离子种类
1.1 皮肤的结构
皮肤覆盖全身表面,保护人体免受外部病原体侵入和避免体内水分蒸发[9⁃10]。皮肤主要分为3 层:表皮、真皮和皮下组织。表皮主要由角质形成细胞、朗格汉斯细胞和黑色素细胞组成[11],从外向里分为角质层(最外层)、透明层、颗粒层、棘层和基底层(最内层),见图1[12]。皮肤最大的屏障是角质层(stratum corneum,SC),在没有SC 的情况下,药物的透皮将增强约1 000倍[13]。SC的厚度约为10~20µm,由14~18 层扁平状的角质细胞组成。角质细胞是富含角蛋白的细胞,由角质体相互连接。角质细胞间的间隙范围为0.5~40 nm,充满着脂类、角蛋白细丝、微丝及其降解产物[14⁃16]。3~10 个角质细胞组成群形成了“簇”,而簇间的路径对分子通过的阻力较小[17]。细胞间脂类是有序的双层脂质阵列,主要包括胆固醇、游离脂肪酸和神经酰胺[18-19]。神经酰胺结构的多样性可能提供了这些脂质屏障的“缓冲”能力,使它们能够适应环境变化以及在一定程度上可逆改变屏障完整性的情况下渗入外来物质。SC被认为是一个脂类隔室,SC下面的组织即真皮和皮下组织本质上是亲水性的。因此,亲脂分子能够快速、更容易地渗透到SC 中,真皮组织和皮下组织有利于极性分子的进入[20]。
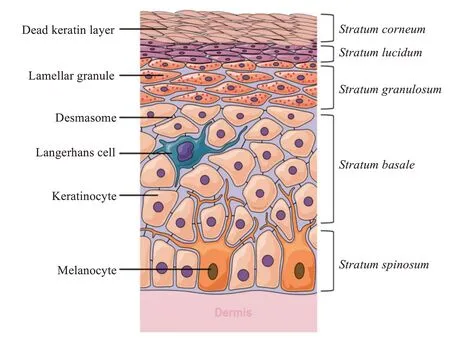
图1 皮肤的表皮结构[20]Figure 1 Epidermal architecture[20]
1.2 经皮递药系统中ILs的阴阳离子种类
传统来说,适用于经皮给药的阴离子一般有香叶酸、苹果酸、氨基酸、脂肪酸等,阳离子一般为胆碱、咪唑、吡啶等。基于这些阳离子和阴离子组成的ILs 具有显著的皮肤渗透促进作用。Lim 等[21]研究表明:咪唑类ILs 中的阳离子(OMIM+)与模型膜内阳离子相互作用促进了氨等小分子药物通过膜的渗透;OMIM+具有很高的膜插入倾向,膜内的平衡阳离子浓度是ILs 溶剂中的47 倍;膜内磷脂带负电荷的磷酸盐被夹在2 个OMIM+之间,形成能量上有利的OMIM+⁃磷酸⁃OMIM+类型的配位;由于与脂类脂肪酸相比,阳离子烷基链的长度较短,在膜的疏水核心中会产生空洞,导致膜变薄0.6 nm,因此促进了药物分子透皮。虽然咪唑类离子液体对氨等小分子药物有明显的促进透皮吸收作用,但同时具有毒性和较低的生物相容性[22]。胆碱是生物体中的常见成分,是维生素B 的基本成分[23]。胆碱还是生物膜的组成成分,可以通过和生物膜的相互作用增强药物分子透皮渗透的作用。与含有咪唑阳离子或吡啶阳离子的ILs 相比,基于胆碱阳离子的ILs具有低毒性、生物相容性和可生物降解性,但是还未证实在皮肤真皮以下部位是否会对药物造成分解[24]。
2 药物的经皮吸收途径
对于大多数药物分子来说,角质层是经皮吸收的最大屏障。药物通过角质层主要有3 条途径,如图2A、C、D 所示:A 是皮肤附属器途径,经毛囊汗腺途径被认为是进入皮肤的较短途径[25];C 是细胞旁途径,药物分子穿透该途径需要经过角质细胞以及SC 中角质细胞间隙;D 是跨细胞途径,是一条富含角蛋白的细胞之间周围曲折的脂质途径。图2B 是SC 脂质双层中水孔和窝陷途径[26⁃28],由于只占皮肤吸收的0.1%~1%[29],被认为起次要作用。图2 中药物通过4 种途径都能到达皮肤真皮部位,直至毛细血管到达全身循环。

图2 ILs促进药物经皮吸收及药物经皮吸收途径Figure 2 ILs promote drug percutaneous absorption and the pathways of percutaneous absorption
2.1 皮肤附属物
皮肤附属物主要是毛囊和汗腺,它们可以作为药物进入点,如图2A 所示,2 个箭头所指分别是毛囊和汗腺。毛囊由毛发、相关的皮脂腺和毛囊皮肌组成,可直接通向毛细血管[11]。此外,毛囊的外根鞘与表皮是连续的,可能会增加皮肤表面以下可供吸收的表面积。毛囊的毛孔直径为10~70 μm 不等,汗腺为60~80 μm 不等,它们的密度因皮肤部位的不同而不同,大多分别占皮肤表面的0.1% 和0.01%[30⁃33]。毛囊包括潜在的药物靶向区域:皮脂腺、隆突区、漏斗和毛发基质细胞。漏斗下部被高密度的免疫细胞包围,这是疫苗靶向的潜在部位[34]。毛囊生长于真皮区域,可以直接接触到毛细血管,因此可以使药物更快和更有效吸收。
2.2 水孔和窝馅
SC脂质双层中存在水孔和窝陷,水孔和窝陷是一种尚未完全了解的复杂途径[26,35],如图2B 所示。水孔位于SC 脂质基质的头部区域,据报道范围从0.3 nm 到(2.8±1.3)nm[36]。要穿过这些孔,药物粒径必须小于孔的直径。据报道,窝陷的宽度约为(48.1±12.09)nm,长度约为(183.9±95.03)nm[35]。
2.3 细胞旁途径
细胞旁途径是通过角质细胞的缝隙,细胞间隙的宽度为纳米级[36]。因此,这种途径阻碍了大分子的渗透。另一方面,由于这种途径是通过细胞间的脂质双层进行的,所以要穿透该途径的药物分子必须具有平衡的脂/水溶解性。如图2C 所示,细胞旁途径的角质细胞间的扩散途径是高度曲折的,增加了药物穿透皮肤的距离,其路径长度远远大于角质层厚度。因此,遵循细胞旁途径的药物还必须克服孔隙中的尺寸排斥效应、角质细胞表面的吸附和脂/水相变步骤[37⁃38]。
2.4 跨细胞途径
跨细胞途径是穿过细胞的途径,如图2D 所示。虽然跨细胞途径比细胞间途径短,但涉及多种不同的环境,包括水合角蛋白填充的细胞内部、高度交联的蛋白质细胞包膜、角质细胞表面的共价脂质单层(脂质包膜)以及细胞间游离脂质,药物分子在亲水(水合角蛋白)和亲脂(脂质基质)部分之间的连续分配有利于通过这种途径渗透。该途径涉及亲水和亲脂结构域的多个分配⁃扩散步骤,药物分子的物理化学性质将会影响该途径,亲水性药物在拟稳定状态下可能有利于这一途径。脂质双层被认为是这一途径经皮渗透速率的决定步骤[39]。Korting等[40]已经在人类角质形成细胞中证实了这种摄取途径,即通过吞噬作用跨细胞摄取完整脂质体。Nagai等[41]报道了在去除SC 的皮肤中细胞吸收酮洛芬纳米粒小窝介导的内吞作用、笼状蛋白介导的内吞作用和微吞饮作用。
3 ILs促进药物透皮的吸收机制
透皮吸收途径虽然有多种,但每种途径都阻碍了药物分子往皮肤深层渗透。ILs 的出现极有可能促进药物穿透这些途径。ILs 可逆地改变皮肤最大的屏障角质层的结构,促进药物往皮肤深层扩散。ILs 被认为是一种有效的功能成分,具有较高的载药量,同时维持制剂的稳定性[42]。
3.1 提高药物溶解度
大量的药物由于水溶性差,分子量高,很难溶解在传统有机溶剂中,导致经皮吸收不理想[43⁃44]。在透皮给药系统中,ILs 能够提高药物的溶解度,主要是因为ILs 中的阴阳离子一部分与药物相互作用形成多重氢键,另一部分破坏了药物间原有的相互作用力。
Yuan等[45]制备了2种胆碱ILs,分别是胆碱甘氨酸([cholinium][glycinate],[Ch][Gly])ILs 和胆碱丙氨酸([cholinium][analinate],[Ch][Ala])ILs,实验结果表明2种ILs都提高了药物布洛芬的溶解度,对布洛芬透过聚醚砜(PES)膜都有明显的促进作用,但[Ch][Gly]ILs 对布洛芬溶解度提高更明显,这是因为[Ch][Gly]ILs的摩尔质量比[Ch][Ala]ILs的小且亲水性强。Huang 等[46]研究超声辅助ILs 对大豆分离蛋白(soy proteinisolate,SPI)的溶解度、粒径及巯基(SH)含量的影响,结果显示超声辅助ILs 后SPI 比单一ILs处理的SPI粒径小,SPI的溶解度以及SH含量显著增加,特别是在超声与低浓度的ILs 联合处理后。超声波可以产生高剪切能和湍流,从而将大的蛋白质分子转化为小的蛋白质分子,SH含量的变化与SPI 溶解度的变化一致,主要原因是二硫键转化为SH,导致蛋白质展开和解离[47]。
3.2 改变皮肤角质层
ILs在与水接触时解离为离子[48]。疏水性ILs辅助药物透皮给药时,扩散到角质层,削弱脂间相互作用,并将脂质成分提取到皮肤表面的ILs 库[49]。ILs 提取角质层中的脂质且阴阳离子与皮肤组织液中的水相形成氢键,角质层被暂时改变,从而促进了药物渗透到角质层[50]。亲水性ILs 打开角质层内的紧密连接并增强皮肤流态化[51],促进药物细胞旁及跨细胞转运,使药物向皮肤深层扩散。如图2E所示,ILs 通过改变角质层细胞排列的规律性和致密性,使皮肤结构更具有渗透性,从而使药物能更好地渗透到皮肤深层。大多数药物会受到酸性或碱性环境的影响,这些环境会改变其固有特性[52]。基于弱酸性或碱性成分的ILs有可能用于改变皮肤pH微环境以提高药物稳定性。这些ILs 可以用作缓冲剂,并在药物周围维持理想的pH 环境,以保护其免于降解[53]。Mehkam 等[54]研究了基于IL 的pH 敏感型纳米载体递送萘普生,将模型药物萘普生包裹在这些对pH 敏感的正电荷纳米载体中,分别考察了该药物在无酶模拟胃液(SGF,pH=1)和模拟肠液(SIF,pH=7.4)中的体外释药特性。结果显示在SIF中观察到了较高的药物释放百分比,表明ILs 可能改变皮肤酸碱值,从而影响药物的透皮吸收。
4 影响ILs促进药物透皮吸收的因素
ILs 是由阳离子和阴离子在不同比例下组成的,这使得ILs 与传统有机溶剂相比具有很大的可调节性[55]。ILs的渗透增强能力因阴阳离子比、阴离子的烷基链、阴阳离子种类不同而不同[56]。通过筛选合适的阴阳离子制备ILs,可以准确地调节所需的溶剂性质,以期在透皮领域发挥最大功效[57]。
4.1 ILs的阴阳离子种类
Almeida 等[58]研究制备了5 种不同的ILs,咖啡因和水杨酸被用作模型药物,3 种为基于咪唑的[C2mim][Br]ILs、[C4mim][Br]ILs 和[C6mim][Br]ILs,2 种为基于胆碱的[Cho][Phe]ILs 和[Cho][Glu]ILs。基于胆碱的ILs 被证明更适合作为功能性成分,因为它们对药物溶解度的影响更大,细胞毒性更低。在咪唑类ILs,观察到烷基链的大小影响它们增强亲水性药物咖啡因的溶解和渗透的能力,同时也增强了ILs 的细胞毒性。基于胆碱的ILs 作为功能成分优于基于咪唑的ILs,具有更高的药物溶解性、渗透性和较低的细胞毒性。基于脂肪酸的ILs已被证明可以改善酸性药物的经皮吸收[59]。Wu等[56]研究基于胆碱的8 种不同ILs 对药物透明质酸的皮肤输送,实验发现8种ILs均能增强透明质酸的穿透能力,其中胆碱柠檬酸在体外和体内结果中均发挥了最明显的增强作用。
4.2 ILs的阴阳离子比
Tanner 等[60]通过改变胆碱和香叶酸的比例,将胰岛素装载到不同比例的胆碱香叶酸ILs变体中,通过一系列实验检验不同比例的胆碱香叶酸ILs 对胰岛素透皮吸收的效果。结果表明阴阳离子比中含有过量但不是单独香叶酸的ILs(1∶2,1∶4)具有更好的促进药物透皮的能力,且每种变体ILs 都有不同的性质。ILs 中的过量香叶酸在促进胰岛素透皮时分成两部分,一部分与胰岛素水分形成氢键,促进了胰岛素溶解;另一部分与皮肤中的水分形成氢键,避免了皮肤内的水分对胰岛素结构的破坏。
4.3 ILs的烷基链
Wu等[61]采用Franz扩散池研究不同烷基链胆碱类ILs对酮康唑(Ketoconazole,KCZ)体外透皮吸收情况,结果显示:胆碱香叶酸ILs能促进KCZ在不同皮肤层(SC、表皮和真皮)的渗透,是对照组的2 倍,且在所有ILs 中表现出最强的渗透促进能力;另外,胆碱香叶酸ILs对KCZ的增溶能力最强。烷基链对ILs 的溶解度起着至关重要的作用,基于羧酸的ILs中,烷基的长度和支化程度以及羟基和羧基数目的不同都会导致KCZ 的溶解度不同。胆碱柠檬酸ILs的透皮效果较差与其对KCZ的低溶解度有关。
Wu等[56]通过实验探究8种不同的ILs促进透明质酸(hyaluronic acid,HA)的透皮效果,结果表明8种ILs均能促进HA 经皮给药,但不同有机酸的促进作用有显著差异,对渗透起主要促进作用的基团是烷基链中的羧基和双键基团。
探究ILs 的阴阳离子配比,可以更好地将ILs 技术应用于经皮给药系统。已有一些相关文献证实了ILs 的阴阳离子不同对药物溶解及透皮效果不同,见表1。
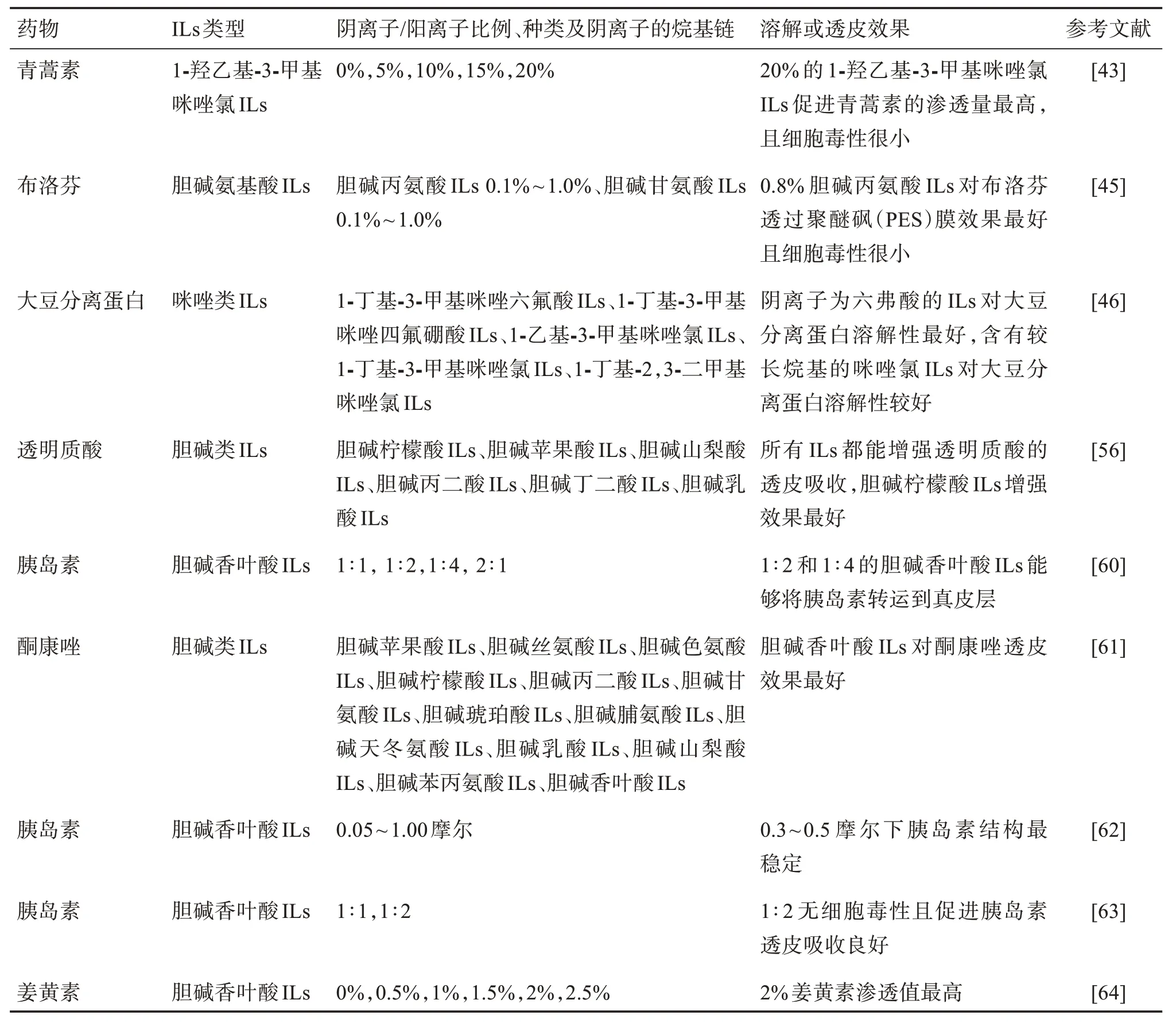
表1 ILs的阴阳离子对药物溶解及透皮的影响Table 1 The effects of anions and cations of ionic liquids on drug dissolution and transdermal penetration
5 展望
ILs作为新兴化合物,能够通过改变其自身组成离子来调整其性质,与传统有机溶剂相比具有优异的溶剂化性能。ILs应用于透皮给药系统时,可通过防止药物降解、延长药物释放时间来增强药物吸收。ILs 充当载体或包封体,保护药物不被微环境降解,并促进其控释放机制。尽管ILs 具有独特的特点和优势,但它们应用于经皮给药系统仍然存在许多挑战。目前,ILs 与皮肤屏障的特定相互作用知之甚少,而这些相互作用对于药物给药设计非常重要。ILs 的可电离离子在皮肤表皮以下不明确的作用机制,可能会对人体造成伤害,仍需进行长期的研究。ILs 的稳定性有待进一步提高,现有的研究表明ILs的储存需要过多的惰性气体或低温环境。提高ILs在皮肤中以及储存中的稳定性,减少药物沉淀风险,是ILs 应用于药物透皮给药亟待解决的问题。尽管仍存在以上局限性,到目前为止研究证明ILs在非侵入性药物输送中的作用具有积极的前景,有可能在提高安全性和有效性的同时改进传统治疗方法。

