牛肠道大肠杆菌的分离鉴定及耐药性分析
郑启铭,梁纤纤,李晓卓,李 月,刘文锴,韩翔舒,冯继红,翟少华*,夏 俊*
(1.新疆农业大学动物医学学院,乌鲁木齐 830000;2.新疆草食动物新药研究与创制自治区重点实验室,乌鲁木齐 830000;3.新疆畜牧科学院兽医研究所/新疆畜牧科学院动物临床医学研究中心,乌鲁木齐 830000;4.农业农村部草食动物疫病防控重点实验室(省部共建),乌鲁木齐 830000;5.石河子大学动物科技学院,新疆 石河子 832061;6.新疆维吾尔自治区呼图壁县农业农村局,新疆 昌吉 831100)
细菌性疾病引起的犊牛腹泻,其多数由大肠杆菌、沙门氏菌、弯曲杆菌、产气荚膜梭菌等肠道致病菌引起[1],其中大肠杆菌是引起腹泻的主要病原菌。犊牛大肠杆菌病又称犊牛白痢,在临床上是一种常见疾病,一年四季均可发生,一般在气温多变的冬末春初发病率较高。感染途径主要是通过消化道,子宫和脐带。该病一旦发生,病死率很高,有时可达100%,牛羊发病时呈地方流行性[1]。犊牛感染后主要临床表现为体温升高、腹泻、脱水等急性肠炎症状。腹泻粪便的状态多变,有腐臭味,且会黏附在犊牛尾部和后肢。病牛精神沉郁,继而发生脱水和酸中毒[2]。轻度感染的犊牛可能自愈,严重感染的犊牛如果不及时治疗,几天内就会死亡。
大肠杆菌根据致病性分型为肠致病性大肠埃希菌(EPEC)、产志贺毒素大肠埃希菌(STEC)、产肠毒素大肠埃希菌(ETEC)、肠聚集性大肠埃希菌(EAEC)、肠出血性大肠埃希菌(EHEC)、侵袭性大肠埃希菌(EIEC)等[3]。各种致病类型的大肠杆菌中的毒素和黏附素等毒力因子是导致牛发生腹泻等症状的主要原因。黏附素性菌毛是产肠毒素性大肠杆菌特有的一类菌毛,主要包括K88(F4)、K99(F5)、987P(F6)及F41,其中以K99 和F41 最为常见[4]。本研究对新疆昌吉地区某牛场腹泻犊牛的分离菌株进行致病性试验、耐药性分析,为该地区牛场治疗犊牛腹泻提供用药依据,同时为该地区致病性大肠杆菌的进一步研究提供参考。
1 材料与方法
1.1 材料
1.1.1 样品来源
采自新疆昌吉市某牛场腹泻犊牛粪便样品(包括稀便、血便),共30份。
1.1.2 主要试剂
BHI 液体培养基、马丁肉汤琼脂培养基、麦康凯琼脂培养基、革兰氏染色试剂盒、DL2000 核酸Marker、200 μL 移液器、100 μL 移液器、10 μL 移液器、药敏纸片。50×TAE 电泳液按本实验室常规方法配置,1×TAE:用规格100 mL 的量筒称取20 mL 的50×TAE,再加入980 mL 的蒸馏水混匀,使其稀释到1×TAE备用。
1.1.3 试验动物
清洁级昆明雄鼠10 只,35 日龄,体重大致在22~25 g,购自新疆疾病预防与控制中心实验动物中心。
1.2 方法
1.2.1 细菌分离
将每份粪便样品加入5 mL BHI 液体培养基过夜培养后,采用固体平板划线法将菌液接种于麦康凯琼脂培养基中,经37 ℃恒温培养箱过夜培养后,挑取粉红色单菌落接种于5 mL BHI液体培养基进行纯化,置于37 ℃恒温摇床培养18 h并观察细菌生长情况。
1.2.2 革兰氏染色及镜检
移液器取适量纯化培养后的细菌培养液,依据革兰氏染色试剂盒的染色步骤进行革兰氏染色,染色完成后经显微镜镜检观察细菌形态特征。
1.2.3 细菌及毒力基因鉴定
1.2.3.1 引物设计与合成 参考文献进行设计引物,引物由上海生工生物工程有限公司合成,引物合成后按照所提供的引物合成单进行各引物稀释,将上、下游引物稀释成10 μM浓度,稀释完后将其置于-20 ℃冰箱中保存备用。引物序列见表1。

表1 引物列表
1.2.3.2 PCR 扩增 使用大肠杆菌鉴定引物用于PCR 鉴定,经鉴定为大肠杆菌后再使用K88、K99、F41 毒力基因引物进行PCR 鉴定。采取25 μL 的常规反应体系,上、下游引物各1 μL,2×Taq MasterMix12.5 μL,模板1 μL,水9.5 μL,瞬离后混匀置于PCR扩增仪中进行PCR扩增。扩增条件为:95 ℃预变性3 min,之后94 ℃循环变性30 s,退火温度为58 ℃,复性20 s,72 ℃延伸1 min,共进行30个循环,72 ℃终延伸5 min,最后于4 ℃保存。
1.2.4 致病性试验
10 只小鼠随机分为试验组及对照组,每组5 只。试验组小鼠腹腔注射分离菌株菌液,每只0.2 mL;对照组小鼠腹腔注射无菌PBS,每只0.2 mL。
1.2.5 药敏试验
采用K-B 纸片法对分离菌株进行抗菌药物敏感试验。用移液器吸取200 μL 细菌培养液,之后均匀涂布于马丁肉汤琼脂培养基上,待吸收完全后,将药敏片等距放置于培养基上进行药敏试验。于37 ℃恒温箱培养18 h后判定其结果,药敏结果判定按CLSI标准。
2 结果与分析
2.1 细菌分离
细菌在麦康凯琼脂培养基上为边缘整齐、表面光滑的圆形或椭圆形粉红色菌落,见图1。革兰氏染色镜检可见单个存在的红色革兰氏阴性短杆菌,见图2。

图1 麦康凯琼脂培养基培养结果

图2 革兰氏染色镜检图片(100×)
2.2 细菌及毒力基因鉴定
进行大肠杆菌及毒力基因的PCR检测后,结果显示有效扩增出大小为200 bp和543 bp的目的条带,见图3、图4,分离菌株为携带毒力基因K99的大肠杆菌。

图3 细菌大肠杆菌PCR鉴定结果

图4 细菌毒力基因PCR鉴定结果
2.3 致病性试验
试验组小鼠腹腔注射菌液4 h后,陆续开始出现精神沉郁、排黏液性粪便、被毛粗乱等症状,12 h后开始陆续死亡。对照组5只全程健康状况良好,无死亡。
2.4 药敏试验
药敏试验结果显示,该分离株对多黏菌素B 中介;对青霉素、氨苄西林、头孢唑林、头孢他啶、头孢哌酮、链霉素、庆大霉素、卡那霉素、阿米卡星、四环素、阿奇霉素、克林霉素、氯霉素、氟苯尼考、诺氟沙星、环丙沙星、左氧氟沙星等抗菌药物耐药,见表2、图5、图6。

图5 药敏试验1
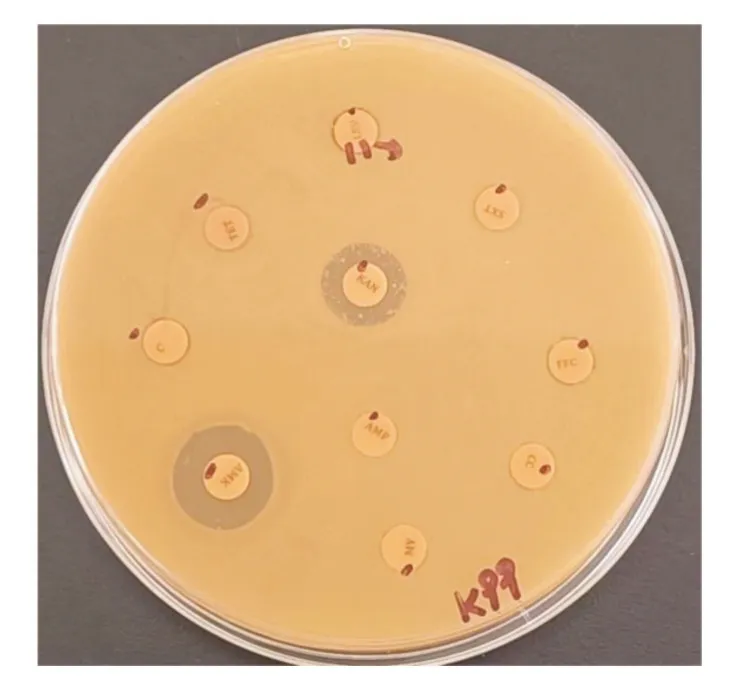
图6 药敏试验2

表2 药敏试验结果
3 讨 论
犊牛腹泻是基层牛场常见的流行病,多发于冬末春初等气温多变的季节。根据犊牛腹泻的发病原因及发病特点,可将其分为消化不良腹泻与传染性腹泻。消化不良性腹泻常呈现散发性,一般出现一过性腹泻,对牛场养殖不会造成较大的损失。传染性腹泻又可分为病毒性腹泻、细菌性腹泻、寄生虫性腹泻以及混合感染性腹泻。其中较常引起细菌性腹泻的病菌包括大肠杆菌、沙门氏菌、弯曲杆菌、产气荚膜梭菌等肠道致病菌[5]。这些致病菌中,大肠杆菌为引起犊牛腹泻最主要的致病菌。以产肠毒素性大肠杆菌最为常见,导致犊牛发生腹泻的原因主要为产肠毒素大肠杆菌所携带的毒素及黏附素基因,主要包括K88(F4)、K99(F5)、987P(F6)及F41,其中以K99 和F41 最为常见[6]。此次在牛源腹泻粪样中检出的E.coli携带的毒力因子为K99,通过致病性试验结果表明此次分离菌株有致病性。
对本次分离出的K99 菌毛大肠杆菌进行药物敏感试验,结果显示该分离菌株对青霉素、氨苄西林、头孢唑林、头孢他啶、头孢哌酮、链霉素、庆大霉素、卡那霉素、阿米卡星、四环素、阿奇霉素、克林霉素、氯霉素、氟苯尼考、诺氟沙星、环丙沙星、左氧氟沙星等抗菌药物均耐药。以上十七种抗菌药物涉及八类,但均显示不同程度的耐药。该分离菌株只对多黏菌素b 中介。杨艳丽[7]等研究发现新疆地区牛源E.coli 对喹诺酮类药物诺氟沙星、环丙沙星、左氧氟沙星均产生不同程度的耐药性。许淑芸[8]等的研究显示石河子地区牛源E.coli 对β-内酰胺类药物头孢唑林、阿莫西林、青霉素、头孢他定等抗生素耐药性较高。郭庆勇[9]等的研究显示伊犁某牛场的粪源大肠杆菌不同生长阶段均对氨基糖苷类及β-内酰胺类抗生素耐药。本试验检测分离的E.coli 也对各类抗菌药物表现出不同程度的耐药性,与三人的研究结果基本一致,同时对四环素类、林可酰胺类及大环内酯类同样存在耐药性,这一现象可能是由于该地区牛场使用这些抗菌药物较多。本次分离菌株的耐药性试验可为该牛场犊牛细菌性腹泻防控工作提供用药选择依据,并为制定合理的抗菌治疗方案提供参考。
综上所述,在防控细菌流行病时,由于抗菌药物滥用易导致致病菌耐药性增加从而给牛场防控疫病的工作开展造成困难。在治疗细菌流行病时,应根据细菌药敏试验结果选择有效抗菌药物[10],并且制定合理的治疗方案,杜绝无理论依据和临床指症的抗菌治疗。目前市面上已经有效果较好的大肠杆菌疫苗及K99灭活苗,在防控大肠杆菌腹泻病时可选择灭活苗,有效做到未病先防。
4 结 论
本次从该牛场分离到的携带K99 毒力基因的大肠杆菌菌株,对小鼠有一定的致病力,并且药物敏感试验结果表明其对青霉素、头孢唑林、头孢他啶、头孢哌酮、链霉素等多种抗菌药物耐药。提示该地区导致犊牛腹泻的大肠杆菌耐药严重,防治过程中应根据药物敏感试验结果选药,并规范使用。此外,也提示大肠杆菌疫苗的开发或引进作为防控犊牛大肠杆菌病的另一个途径应该得到重视。

