TXNDC12在结直肠癌生长转移中的作用
黑 钰,徐向荣,田淑月,陈璇羽,张 静,王逢会*
(1延安大学医学院医学研究实验中心,延安 716000;2延安市真菌资源开发与生物防治重点实验室;*通讯作者,E-mail:wangfenghui2022@163.com)
全球癌症的最新统计结果显示,每年约有185万新发结直肠癌(colorectal cancer,CRC)患者,死亡率高达46%。高发病率和病死率使CRC成为世界第三常见和第四致命的癌症类型[1,2]。尽管CRC在临床诊断和综合治疗方面取得较大进展,部分患者的生存期延长,但转移的CRC患者预后仍然很差[3]。因此迫切需要寻找CRC新的分子作用机制,以开发针对CRC的潜在治疗策略。
硫氧还原蛋白结构域蛋白12(thioredoxin domain-containing protein 12,TXNDC12)是一种含有硫氧还蛋白结构域的蛋白质,也被称为ERp16、ERp18、ERp19或hTLP19,是蛋白质二硫化物异构酶(protein disulfide isomerase,PDI)家族的成员,也是硫氧还原蛋白(thioredoxin,Trx)超家族的一员。该蛋白在所有组织中广泛表达,在肝脏和胎盘中的表达最为丰富[4]。TXNDC12通过编码一种参与催化二硫键形成的蛋白质,以减少细胞内各种二硫化物来维持巯基稳态并防止氧化应激[5],TXNDC12还可与激活转录因子6α(activating transcription factor 6α,ATF6α)形成混合二硫化物,调节未折叠蛋白反应期间ATF6α的激活,参与内质网应激[6,7]。此外,多项研究证实TXNDC12在癌症的发生和发展中也起着重要作用[8,9],例如TXNDC12可通过FAK/ERK信号通路加速肿瘤细胞生长、迁移和侵袭促进人类胃癌的致瘤性[10];TXNDC12 58~115活性位点可以与β-catenin结合从而促进肝癌的转移[11];在胶质瘤的研究中发现TXNDC12显著高表达,且这种高表达与胶质瘤局部免疫微环境有关,提示该蛋白与胶质瘤患者的预后不良也相关[12]。虽然高表达的TXNDC12可在肿瘤中发挥重要作用,但有研究揭示低mRNA水平的TXNDC12也可在肺腺癌患者的不良预后中发挥提示作用[13],这与先前的研究相悖,可能与肿瘤异质性相关,同时也更加表明了TXNDC12在肿瘤发展的过程中的重要性。就目前研究而言,TXNDC12对结直肠癌的调控机制还未被触及,因此本研究拟通过生物信息学分析、细胞实验等探究TXNDC12在CRC中的表达,并观察其对CRC细胞增殖、迁移和凋亡等生物学功能的影响,为CRC的临床治疗和预后等发现有效靶点或有利因素提供基础理论依据。
1 材料与方法
1.1 材料
1.1.1 组织标本与细胞 选取2021年12月至2022年5月在延安大学附属医院接受治疗的8例结直肠癌患者组织和癌旁组织用于TXNDC12的表达测定,其癌组织标本均经临床病理诊断为结直肠癌。本研究经延安大学医学院伦理委员会批准(批准号:2022060),并征得所有患者同意且签署知情同意书。
人结肠癌细胞系HT-29、HCT116、RKO及人肠黏膜上皮细胞NCM460均由本实验室保存。
1.1.2 主要试剂 胎牛血清(FBS,04-001-1ACS)、DMEM高糖培养基(C3113-0500)、RPMI-1640(01-100-1ACS)、McCoy′s 5A(C3020-0500)和青霉素-链霉素溶液(10 mg/mL)购自以色列Biological Industries生物科技公司。Hochest 33258(RS6007)荧光染料购自西安睿思科生物技术有限公司;TXNDC12抗体(ab137035)购自美国Abcam plc公司;MMP-2(10373-2-AP)、MMP-9(10375-2-AP)、β-catenin(17565-1-AP)、N-cadherin(20874-1-AP)、Bax(50599-2-Ig)、Bcl-2(68103-1-Ig)、Caspase-3(19677-1-AP)抗体均购自武汉三鹰技术公司;β-actin(HC201-01)、辣根过氧化物酶标记的山羊抗兔抗体(HS101-01)、辣根过氧化物酶标记的山羊抗鼠抗体(HS201-01)、RT-qPCR定量试剂盒(AQ601)购自北京全式金生物技术有限公司;反转录试剂盒(AE311)购自大连宝生物工程有限公司;转染试剂购于北京百灵克生物科技有限公司;CCK-8试剂购于上海陶术生物科技有限公司;siRNA序列设计及合成由上海吉玛制药技术有限公司完成;RT-qPCR相关引物均由西安奥科鼎盛生物科技公司合成。
1.2 方法
1.2.1 数据库分析TXNDC12在结直肠癌组织及淋巴结转移的结直肠癌患者中的表达情况 利用不同生物数据库分析TXNDC12的表达情况,具体操作如下:①TCGA(https://portal.gdc.cancer.gov/)和GTEx(https://www.gtexportal.org)数据库筛选结直肠癌肿瘤组织的相关数据资料,并通过GEPIA(http://gepia.cancer-pku.cn/)[14]在线分析比较TXNDC12在275例结直肠癌组织样本和349例正常结直肠组织样本中的表达差异,最后利用统计学方法对TXNDC12在结肠癌中的差异表达结果进行描述;②利用UALCAN(https://ualcan.path.uab.edu/)数据库中TCGA结肠腺癌数据集分析TXNDC12在淋巴结转移的结直肠癌患者中的表达情况。
1.2.2 Sanger Box数据库分析TXNDC12与结直肠癌患者免疫浸润的关系 利用Sanger Box(http://sangerbox.com/home.html)数据库中的免疫浸润分析模块分析TXNDC12表达水平与结直肠癌免疫评分、基质评分、免疫基质联合评分的相关性;通过免疫细胞分析(EPIC)模块预测TXNDC12与几种常见的免疫细胞(CD4+T细胞、CD8+T细胞、巨噬细胞、自然杀伤细胞)浸润丰度的关系。
1.2.3 引物和siRNA的设计与合成 从NCBI数据库查找TXNDC12(Gene ID:51060)的mRNA序列。设计合成其特异性检测引物(序列见表1),以GAPDH作为内参基因。结合目的基因CDS区域进行小干扰RNA设计并合成2条TXNDC12 siRNA用于后续实验,siRNA及对照(si-NC)序列见表2。

表1 TXNDC12和GAPDH引物序列

表2 TXNDC12 siRNA序列
1.2.4 细胞培养 将液氮储存的HT-29、RKO、HCT116和NCM460细胞复苏后使用10%胎牛血清(FBS)和1%(10 mg/mL)青链霉素配置的McCoy′s 5A、DMEM和RPMI-1640培养基,置于含5% CO2的37 ℃培养箱培养,待细胞长至密度达80%以上用胰酶消化传代。细胞处于对数生长期时接种至6孔板,5% CO237 ℃培养箱中培养24 h后收集细胞提取RNA,48 h后提取蛋白,开展TXNDC12 mRNA及蛋白水平检测。
1.2.5 敲低TXNDC12细胞模型的构建 取生长状态良好的HT-29和RKO细胞接种于6孔板,密度达70%~80%时进行转染,空白对照组(MOCK组)不做任何处理,对照组(NC组)转染si-NC 150 pmol,敲低组(si-TXNDC12-2组)转染si-TXNDC12-2 150 pmol,转染6 h后进行换液,继续培养相应时间进入后续实验。
1.2.6 实时荧光定量PCR(RT-qPCR)检测TXNDC12在结直肠癌细胞中的mRNA表达水平 采用Trizo1法提取各处理组细胞的总RNA,并以总RNA为模板,在37 ℃ 15 min,85 ℃ 5 s,4 ℃ 10 min条件下反转录合成cDNA;然后以cDNA为模板,利用目的基因TXNDC12 mRNA特异性引物以及GAPDH的特异性引物进行RT-qPCR检测实验组与对照组目的基因TXNDC12 mRNA的表达水平:RT-qPCR 20 μL的反应体系为cDNA 4 μL,2×TransStart top Green qPCR Supermix 10 μL,上下游引物各1.5 μL,无酶水3 μL;配好的反应体系经94 ℃预变性5 min;94 ℃ 30 s,58 ℃ 15 s,72 ℃ 30 s,循环扩增40次后得到每孔循环数值,通过相对定量法2-ΔΔCt分析实验数值。
1.2.7 Western blot检测TXNDC12、迁移相关蛋白以及凋亡相关蛋白的表达水平 各组细胞转染48 h后提取蛋白,用预冷PBS洗净细胞表面培养基后,加入细胞裂解液(裂解液与蛋白酶抑制剂比例为100∶1),将细胞收集在离心管中,置于冰上10 min,剧烈震荡30 s,重复5次后,14 000 r/min离心15 min,上清即为提取的蛋白质。收集好的蛋白通过BCA法检测其浓度,调整各组上样量至30 μg。经高温变性,SDS-PAGE凝胶电泳、转膜、封闭后,进行TXNDC12(1∶2 000)、MMP-2(1∶1 000)、MMP-9(1∶1 000)、β-catenin(1∶3 000)、N-cadherin(1∶2 000)、Bax(1∶5 000)、Bcl-2(1∶1 000)、Caspase-3(1∶1 000)和内参β-actin(1∶4 000)的一抗孵育,用TBST清洗一抗,然后将膜与稀释的兔二抗或鼠二抗(1∶4 000)室温孵育1.5 h,洗去膜上残余二抗后进行曝光显影,通过Image J软件对条带进行统计分析。
1.2.8 CCK-8法检测结直肠癌细胞的增殖能力 取对数生长期的细胞以3 000个/孔铺于96孔板中。每组设置5个复孔,培养24 h后转染(此时为0 h),然后继续培养24,48,72 h后,每孔加入10 μL CCK-8试剂,37 ℃避光孵育2 h在450 nm处测定其吸光度,并计算细胞增殖率,细胞增殖率=(si-TXNDC12-2组吸光度-背景值吸光度)/(NC组吸光度-背景值吸光度)×100%,最后采用GraphPad 7.00软件绘制细胞增殖曲线。
1.2.9 克隆形成实验检测结直肠癌细胞的集落形成能力 各处理组细胞转染24 h后以1 000个/孔接种到12孔板中,每组3个复孔,置于含5% CO2的37 ℃培养箱中培养,每隔3~4 d换液,培养约10 d出现肉眼可见的细胞集落即形成克隆,停止培养,PBS洗净培养基后4%多聚甲醛固定30 min,然后使用0.1%结晶紫染色30 min,用PBS缓冲液将染料清洗晾干,晾干后采集图像。
1.2.10 划痕实验检测结直肠癌细胞的迁移能力 将各组细胞以4×104个/孔接种于6孔板中,24 h后转染,转染后6~8 h沿孔的中间划痕(此时为0 h),用PBS冲洗脱落的细胞,然后在1%血清培养基中继续培养24,48,72 h,显微镜下观察细胞迁移情况,并用Image J软件对划痕图片进行统计分析。
1.2.11 Hochest染色检测结直肠癌细胞凋亡情况 各处理组细胞以1 000个/孔铺于6孔板中,转染48 h后用预冷PBS洗净细胞表面培养基,然后用4%多聚甲醛固定30 min,将1∶100稀释后的Hoechst染料500 μL加入6孔板中染色3~5 min,最后使用PBS洗涤2~3次,每次3~5 min,荧光显微镜下观察拍摄。
1.3 统计学处理

2 结果
2.1 TXNDC12在结直肠癌中的表达
GEPIA在线工具分析结果显示,相较于正常结直肠组织,TXNDC12在结直肠癌组织中表达显著升高(P<0.05,见图1A)。且UALCAN数据库分析结果表明,与正常患者相比,TXNDC12在不同N分期患者中的表达也升高(见图1B)。延安大学附属医院病理组织样本的Western blot结果证实,与癌旁组织相比,结直肠癌组织中TXNDC12高表达(见图1C)。以上结果表明TXNDC12在结直肠癌中高表达,且TXNDC12的高表达与结直肠癌患者淋巴结转移相关。

图1 TXNDC12在结直肠癌中表达Figure 1 The expression of TXNDC12 in colorectal cancer
2.2 TXNDC12 mRNA表达水平与结直肠癌免疫浸润的关系
鉴于肿瘤组织浸润的免疫细胞对肿瘤发生发展的重要作用,本研究通过Sanger Box网站对肿瘤微环境中的非肿瘤成分(免疫细胞、基质细胞)等进行评分,发现TXNDC12的mRNA表达水平与结直肠癌基质评分(stromal-score)、免疫评分(immune-score)以及免疫基质联合评分(estimate-score)呈负相关(P<0.001,见图2);此外,TXNDC12的表达水平与CD4+T细胞、巨噬细胞和非免疫细胞内皮细胞和成纤维细胞(CAFS)的浸润丰度也呈负相关(P<0.05,见图3)。综上所述,TXNDC12与结直肠癌组织免疫浸润呈负相关。
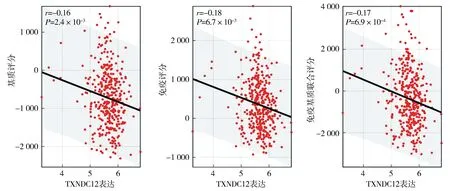
图2 基于TCGA数据库分析结直肠癌中TXNDC12表达水平与基质评分、免疫评分和基质免疫联合评分之间的相关性 (n=373)Figure 2 Correlations between TXNDC12 expression and stromal-score, immune-score, and estimate-score in colorectal cancer based on TCGA database (n=373)
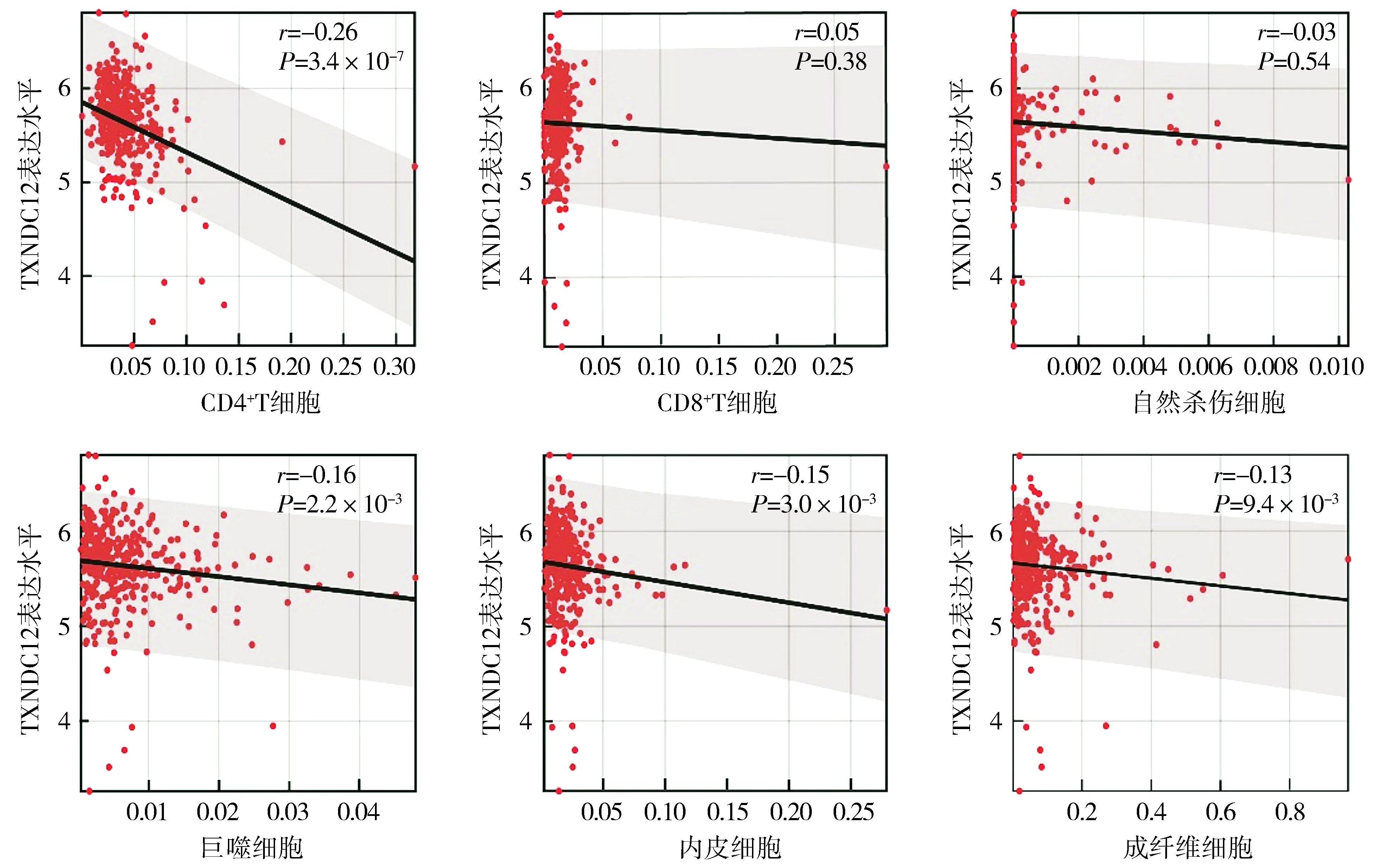
图3 基于TCGA数据库分析结直肠癌组织中TXNDC12表达水平与免疫细胞浸润的关系 (n=373)Figure 3 Relationships between TXNDC12 expression level and immune cell infiltration in colorectal cancer tissues based on TCGA database (n=373)
2.3 TXNDC12在正常结直肠上皮细胞和结直肠癌细胞系中的表达
Western blot检测结直肠癌细胞系中TXNDC12蛋白的表达情况,结果显示,与正常肠上皮细胞NCM460相比,TXNDC12在HT-29、RKO和HCT116等结直肠癌细胞系中表达显著升高(P<0.05,见图4A)。RT-qPCR结果显示TXNDC12在HT-29等结直肠癌细胞系中mRNA的表达量也显著高于正常肠上皮细胞NCM460(P<0.05,见图4B)。以上结果表明,TXNDC12在结直肠癌细胞中高表达,与上述数据库预测的表达差异结果一致。
2.4 敲低TXNDC12结直肠癌细胞模型的建立
Western blot和RT-qPCR结果显示,与NC组相比,si-TXNDC12-2组TXNDC12在HT-29和RKO细胞系中的蛋白和mRNA表达水平均显著下调(P<0.05,见图5)。因此,后续选择HT-29和RKO细胞作为功能实验的探究。
2.5 敲低TXNDC12对结直肠癌细胞增殖能力的影响
CCK-8结果显示,与NC组相比,si-TXNDC12-2组HT-29和RKO细胞的增殖能力受到显著抑制,差异具有统计学意义(P<0.05,见图6)。克隆形成实验结果表明,相较于NC组,si-TXNDC12-2组HT-29和RKO细胞的集落形成数量显著减少(P<0.01,见图7)。

注:与NC组比较,**P<0.01。图7 敲低TXNDC12对HT-29和RKO细胞克隆形成能力的影响Figure 7 Effect of TXNDC12 knockdown on clone formation in HT-29 and RKO cells
2.6 敲低TXNDC12对结直肠癌细胞迁移能力的影响
细胞划痕实验结果显示,与NC组相比,si-TXNDC12-2组HT-29和RKO细胞的迁移能力受到显著抑制(P<0.05,见图8)。且利用Western blot辅助检测迁移相关蛋白MMP-2、MMP-9等的表达,发现与NC组相比si-TXNDC12-2组迁移相关蛋白的表达显著降低(P<0.05,见图9)。以上实验结果表明,敲低TXNDC12可抑制结直肠癌细胞的迁移能力。
2.7 敲低TXNDC12对结直肠癌细胞凋亡蛋白的影响
Hochest 33258实验结果显示,与NC组相比,si-TXNDC12-2组HT-29和RKO凋亡细胞数增加(见图10)。Western blot结果显示,与NC组相比,si-TXNDC12-2组Bax、Caspase-3蛋白表达增加,而Bcl-2蛋白表达降低(P<0.05,见图11)。综上所述,敲低TXNDC12可能通过促进结直肠癌细胞凋亡来抑制肿瘤生长。
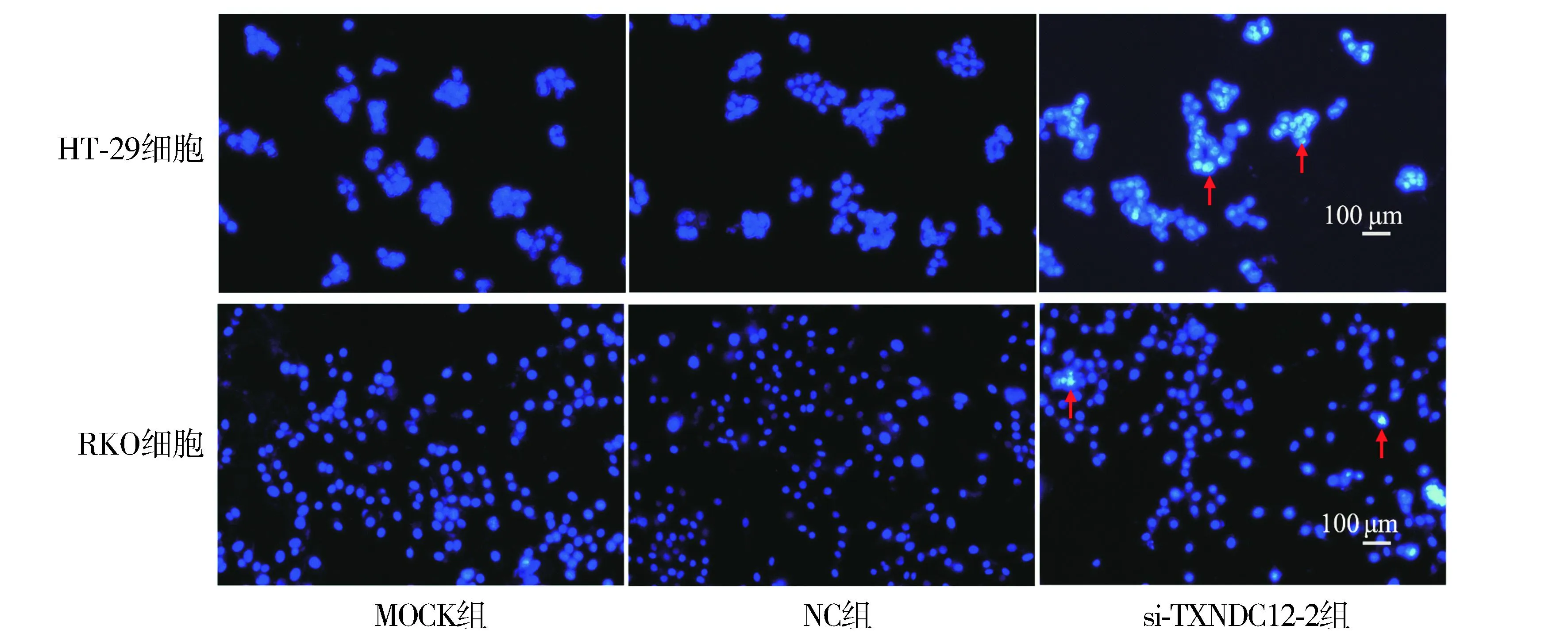
注:红色箭头指示呈亮蓝色荧光的细胞为凋亡细胞。图10 Hochest 33258染色检测HT-29和RKO细胞的凋亡水平Figure 10 Apoptosis of HT-29 and RKO cells by Hochest 33258 staining
3 讨论
结直肠癌因易发生远端转移和侵袭经常造成患者预后不良甚至死亡,且尚无特效靶点药物。因此要想改善此类疾病的临床现状,探究其精细调控机制,掌握其发生发展的规律异常重要。目前聚焦肿瘤基因层面的研究结果显示,结直肠癌的发生发展受多种信号通路调控,比如Wnt/β-catenin、PI3K-AKT-mTOR、MAPK[15-17]等,此类通路可以被不同基因激活或抑制从而促进或抑制结直肠癌细胞的增殖、EMT等恶性表型。但目前基于此类的诸多研究,能切实用于临床诊疗的并不多,所以近年来针对肿瘤的研究大多向免疫治疗研究领域转换,摒弃以往采取外源性措施直接攻击癌细胞的治疗方式,希望通过各种方式激活人体自身免疫系统来对抗肿瘤。此种新型癌症治疗方式同样适用于结直肠癌,而且由于肠道中免疫细胞较为丰富且炎症本身就是结直肠癌的一大诱因,因此免疫治疗在结直肠癌诊疗中更能发挥出巨大潜能。
近年来,PDI家族已被证实在癌症中发挥重要作用,然而其家族成员诸多且功能各不相同。TXNDC12作为PDI家族成员之一在胶质瘤、肺腺癌、乳腺癌等肿瘤中呈异常表达[12,13,18],并且参与到各肿瘤的增殖、转移或预后等生物学进程中。再结合上述结直肠癌的临床诊疗现状,我们在细胞层面对TXNDC12在结直肠癌中的影响进行了功能分析和探索,结果发现,TXNDC12在结直肠癌组织及细胞中呈异常高表达,并且敲低TXNDC12可抑制结直肠癌细胞的增殖和迁移,促进其凋亡。因此我们推断TXNDC12可能作为癌基因在结直肠癌的发展过程中发挥重要调控作用。此外,生物数据库分析显示,TXNDC12与结直肠癌患者淋巴结转移有关,深入研究或许可为解决该类疾病肿瘤细胞易转移、侵袭的特点提供基础理论依据和方向;针对肿瘤微环境的分析发现TXNDC12与结直肠癌组织中CD4+T细胞、NK细胞、巨噬细胞等免疫浸润丰度呈负相关,这与现有报道结直肠癌组织中T细胞和B细胞浸润比例低于正常组织,且在结直肠癌患者中,T细胞和B细胞的浸润对患者的预后有积极影响[19-21]的研究一致,据此推测TXNDC12可能通过抑制CD4+T细胞对肿瘤的杀伤作用促进肿瘤生长。这一发现可为丰富结直肠癌的发展机制再添视角,也可为结直肠癌的免疫治疗研究指出突破方向。
本研究利用常规肿瘤功能研究技术,从细胞层面探究了TXNDC12对结直肠细胞功能的影响,揭示了TXNDC12在结直肠癌的发生发展中可能作为癌基因的角色。然而本研究也存在一定局限性:TXNDC12具体的分子调控关系网络尚不明确,且仅进行了细胞层面的研究,未进行动物实验验证。今后我们将从不同层面继续全面探究TXNDC12对结直肠癌的具体调控机制,并且对TXNDC12在结直肠癌肿瘤免疫机制方面进行深入探讨,以期为改变结直肠癌的临床诊疗现状提供有力的理论基础和新视角。

