细胞蜡块和分子检测在恶性胸腔积液病理诊断中的应用
董燕 金晓燕 胡慧娣
胸腔积液细胞蜡块技术日渐成熟,国外已将其作为细胞学常规诊断技术,目前在国内大型医院运用的也越来越多[1]。胸腔积液是癌症晚期患者常见的临床表现,其中肺癌最常见[2]。对于细胞学涂片细胞量较少者、或难以通过活检及手术获取组织标本以及无法明确肿瘤来源的标本,胸腔积液细胞蜡块技术结合免疫组化及分子检测明显提高了诊断的准确性和特异度[3]。本文回顾性分析248例胸腔积液患者,制备细胞蜡块并行免疫组化及分子检测,以提高临床及病理医师对细胞蜡块技术在病理诊断、鉴别肿瘤来源及指导靶向治疗中应用的认知。
资料与方法
一、临床资料
收集南京市胸科医院于2018年12月~2022年7月期间通过常规细胞学或液基细胞学证实的恶性或可疑恶性胸腔积液的248例患者,其中男性119例,女性129例,男女比例约为12 ∶13,年龄30~93岁,平均64岁。248例病例后期均行活检或手术切除,以组织病理学诊断结果为金标准。本研究获得我院伦理委员会批准(2023-KL0015-01)。
二、方法
1. 液基细胞学及常规细胞学涂片
液基细胞学:将临床胸腔穿刺抽取(n=62)和引流袋(n=186)收集的胸水在4小时内进行如下处理:先将胸水混匀,取50~100mL离心沉淀后,经BD沉降式制片染色仪,按操作步骤进行制片,巴氏染色,封片,阅片。常规细胞学涂片:将胸腔积液混匀后取10mL离心,弃上清后将沉淀物均匀涂在玻片上,95%乙醇固定10min后,HE染色,封片,阅片。经处理后剩余的胸水置于4 ℃冰箱保存,用于细胞蜡块的制备。
2. 细胞蜡块的制作
将细胞学制片后剩余的胸腔积液置入50mL离心管中,离心机2000r/min,离心5min,弃上清,保留沉淀物(如沉淀物量不足可多次离心收集)。若为血性标本,加入3%冰醋酸乙醇液10mL,振荡均匀,离心机2000r/min,离心5min,去除红细胞,保留沉淀物。再向沉淀物中加入95%乙醇固定30min后,离心机2000r/min,离心10min后,弃上清,底部沉淀物用竹签取出,擦镜纸包好,常规组织处理仪进行脱水、浸蜡、包埋制成细胞蜡块。常规切片、染色、封片、阅片。
3. 免疫组织化学
将细胞蜡块切成4um的蜡片,用Roche BENCHMARK全自动免疫组化仪进行染色,一抗包括CK,CEA,CK7,CK5/6,CK20,EMA,NapsinA,TTF-1,P40,P63,WT-1,CR,SYN,CGA,CDX2,Villin,LCA,CD20,CD45,CD79α,CD56,CD3,ER,PR,GCDFP15,CA125,D2-40,PSA,Ki-67,所有一抗均购自福州迈新生物技术开发有限公司,二抗及显色试剂均为Roche 公司免疫组化仪配套试剂。PD-L1(22C3)试剂购自于美国安捷伦科技有限公司(DAKO公司),并由高年资病理医师按照PD-L1判读标准进行肿瘤比例评分(TPS),即部分或完整膜染色(≥1%)的肿瘤细胞占样本中存在的所有肿瘤细胞的百分比。结果判读:当TPS<1%时无PD-L1表达;TPS在1%~49%之间时PD-L1低-中等强度表达;TPS≥50%时PD-L1高表达。所有实验均设阴性及阳性对照,实验操作严格按照说明书进行。
4. 荧光定量微滴式数字PCR(droplet digital PCR,ddPCR)法及二代测序法(Next Generation Sequencing,NGS)
①ddPCR法:47例细胞蜡块样本使用人类EGFR基因突变检测试剂盒(荧光PCR法)进行基因检测,该试剂盒基于扩增阻碍突变系统(Amplification Refractory Mutaion System,ARMS)和荧光PCR技术实现样本DNA中EGFR基因的突变检测。取3-8张5μm石蜡切片进行DNA提取,DNA推荐浓度在2-3ng/μL,随后在基因公司进行检测。②NGS:33例细胞蜡块样本使用高通量测序技术进行全基因组分析。提取细胞蜡块中的总RNA进行逆转录后再加以修饰,构建cDNA文库。检测试剂盒均来自于深圳华大基因科技有限公司,并在该公司进行分子检测。
三、统计学方法
运用SPSS 26.0统计学软件进行数据分析,所有实验数据至少进行三次独立重复试验,两种方法比较采用诊断一致性检验(Kappa)分析,评价此两种检查方法是否有本质的不同。Kappa值>0.6时,表示一致性较可靠,Kappa值≤0.6时,表示一致性较差。P值<0.05表示差异有统计学意义。
结 果
一、常规细胞学组
细胞学组中肿瘤细胞量少,细胞存在严重的堆积重叠现象,细胞结构不清,难以辨别细胞核和染色质等,背景可见较多杂质(图1,5,9,13)。
二、细胞蜡块组
与常规细胞学组相比,细胞蜡块组中腺癌细胞常聚集成团,呈三维立体结构,外缘花瓣状,光滑,界限多清楚,可出现腺样、花球状,乳头状结构,细胞核偏位、染色质粗糙,有核仁,胞质内可出现黏液空泡(图2)。以肺腺癌为最多见。其次多见的是乳腺癌,结直肠腺癌,卵巢癌。乳腺小叶癌及胃癌可见“印戒细胞”;乳腺导管癌可见细胞球团结构,腺腔样,梅花样,核圆形或椭圆形(图6);结直肠腺癌细胞可呈栅栏状排列,形成细胞条索;浆液性腺癌伴沙砾体可提示为卵巢来源可能。腺癌细胞分化差时可散在分布,核异型性大,核仁明显。少见肿瘤有肺鳞状细胞癌,肺小细胞癌等。胸腔积液中的角化型鳞状细胞癌比较少见,其形态学表现:细胞单个散在或聚集,多形性明显,细胞核增大,不规则,深染,胞质嗜伊红(图10)。在胸腔积液中的非角化型鳞状细胞癌较角化型鳞状细胞癌常见,其细胞聚集成团,胞界不清,与腺癌细胞难以区分。胸腔积液中的小细胞癌形态学特征:细胞单个分散或紧密成群,镶嵌样排列;也可聚集成团呈“洋葱皮”样、“列兵样”排列;核染色质深,椒盐样,核仁不明显,胞质少,核质比高。间皮瘤细胞形态学特征(图14):细胞丰富,单个散在或成团,成团者可表现为扇形花边样的立体球状、乳头状或假腺泡样结构,细胞间可见“开窗”现象。瘤细胞较间皮细胞大,较腺癌细胞异型性小,核居中,边缘淡染。淋巴瘤细胞丰富,平铺,大小一致,呈圆形或卵圆形,胞质少,核染色质颗粒状。
三、常规细胞学组或细胞蜡块组检查结果比较
将248例胸腔积液标本经常规细胞学和细胞蜡块学检查,248例胸腔积液经组织学病理诊断为恶性肿瘤者240例,良性肿瘤者8例。常规细胞学组中恶性胸腔积液者212例,未能明确诊断者36例,细胞蜡块组中恶性胸腔积液者240例,8例未明确诊断胸腔积液中7例为良性胸水,1例恶性胸腔积液组织学病理诊断为良性肿瘤。常规细胞学组中恶性胸腔积液者212例,36例未明确诊断胸腔积液中30例为恶性胸腔积液,2例恶性胸腔积液组织学病理诊断为良性肿瘤(见表1)。常规细胞学检测和细胞蜡块学检测恶性胸腔积液的灵敏度、特异度及准确性分别为87%、75%、87%和99%、87%、99%。常规细胞学组与细胞蜡块组两种诊断方法存在一致性,但一致性较差(Kappa值为0.269)。常规细胞学和细胞蜡块诊断之间具有显著差异(P<0.05)。

表1 常规细胞学组或细胞蜡块学组诊断结果
四、细胞蜡块结合免疫组化后诊断结果
经Roche BENCHMARK全自动免疫组化仪染色证实肺腺癌211例;肺小细胞癌4例;肺鳞状细胞癌2例;找到恶性肿瘤细胞需排除其它来源23例,其中食管鳞癌1例,乳腺癌2例,胃肠道来源8例,恶性间皮瘤1例,淋巴造血系统肿瘤2例,卵巢来源6例,因细胞蜡块中肿瘤细胞数量少或标记不理想未能确定来源者3例;间皮增生8例(表2),肺腺癌通常CK7(图3),TTF-1(图4),NapsinA均阳性;乳腺癌通常GCDFP15(图7),CK7均呈阳性,不同程度表达ER(图8),PR;胃肠道腺癌通常CK20,CDX2,Villin阳性;肺鳞状细胞癌通常CK5/6,P63(图11),P40(图12)阳性;肺小细胞癌通常表达TTF-1,SYN,CGA,CD56阳性;恶性间皮瘤通常CK5/6,WT-1(图15),CR(图16),D2-40,EMA阳性;淋巴造血系统肿瘤通常表达LCA,CD3,CD20等。
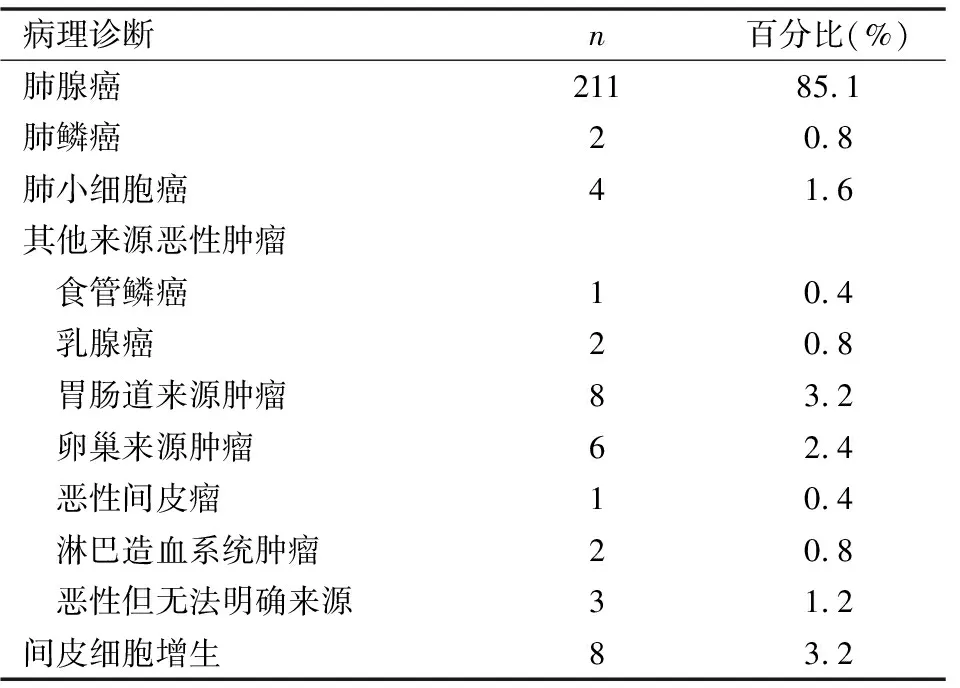
表2 细胞蜡块免疫组化诊断结果
五、细胞蜡块结合分子检测技术结果
80例患者胸水细胞蜡块行ddPCR及NGS检测,其中27例出现EGFR基因突变(图17)(EGFR 第18号外显子p.G719A突变1例,EGFR第20号外显子p.T790M突变3例,EGFR第19号外显子19del突变4例,EGFR第19号外显子 p.L747_A750delinsP突变2例,EGFR 第19号外显子p.E746_A750del突变1例,EGFR 第21号外显子p.L861Q突变1例,EGFR 第21号外显子p.L858R突变15例)。KRAS基因突变3例、TP53基因突变4例、NF2基因突变1例及BRAF第15号外显子 p.V600E基因突变1例。EML4-ALK基因融合1例。26例细胞蜡块行免疫组化PD-L1检测,7例检出阳性(5例PD-L1呈低-中等强度表达,2例PD-L1呈高表达)。
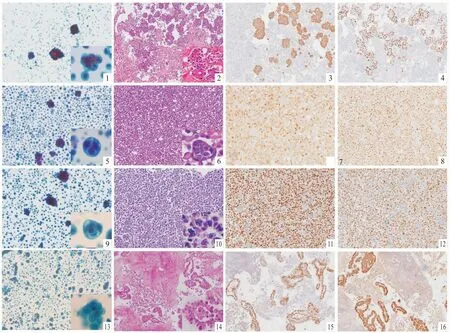
图1-16 胸腔积液常规细胞学形态及细胞蜡块学形态和免疫表型 图1,5,9,13:分别为常规细胞学中肺腺癌,乳腺癌,鳞癌和间皮瘤细胞学形态,细胞数量少,细胞堆积重叠,细胞排列及染色质结构不清,小图为HE高倍放大;图2:胸水细胞蜡块中肺腺癌细胞呈三维立体结构,外缘花瓣状,HE中倍放大,小图为HE高倍放大;图3,4:癌细胞CK7和TTF-1呈强阳性表达;图6:胸水细胞蜡块中乳腺癌细胞可见细胞球团结构,腺腔样,梅花样,核圆形或椭圆形,HE中倍放大,小图为HE高倍放大;图7,8:癌细胞高表达GCDFP15和ER,HE中倍放大;图10:胸水细胞蜡块中癌细胞单个散在或松散聚集,细胞核增大,深染,胞质红染,HE中倍放大,小图为HE高倍放大;图11,12:癌细胞表达P63和P40,HE中倍放大;图14:胸水细胞蜡块中间皮瘤细胞丰富,单个散在或成团,成团者表现为扇形花边样的立体球状或假腺泡样结构,细胞间可见“开窗”现象,HE中倍放大,小图为HE高倍放大;图15,16:肿瘤细胞WT-1和CR表达阳性
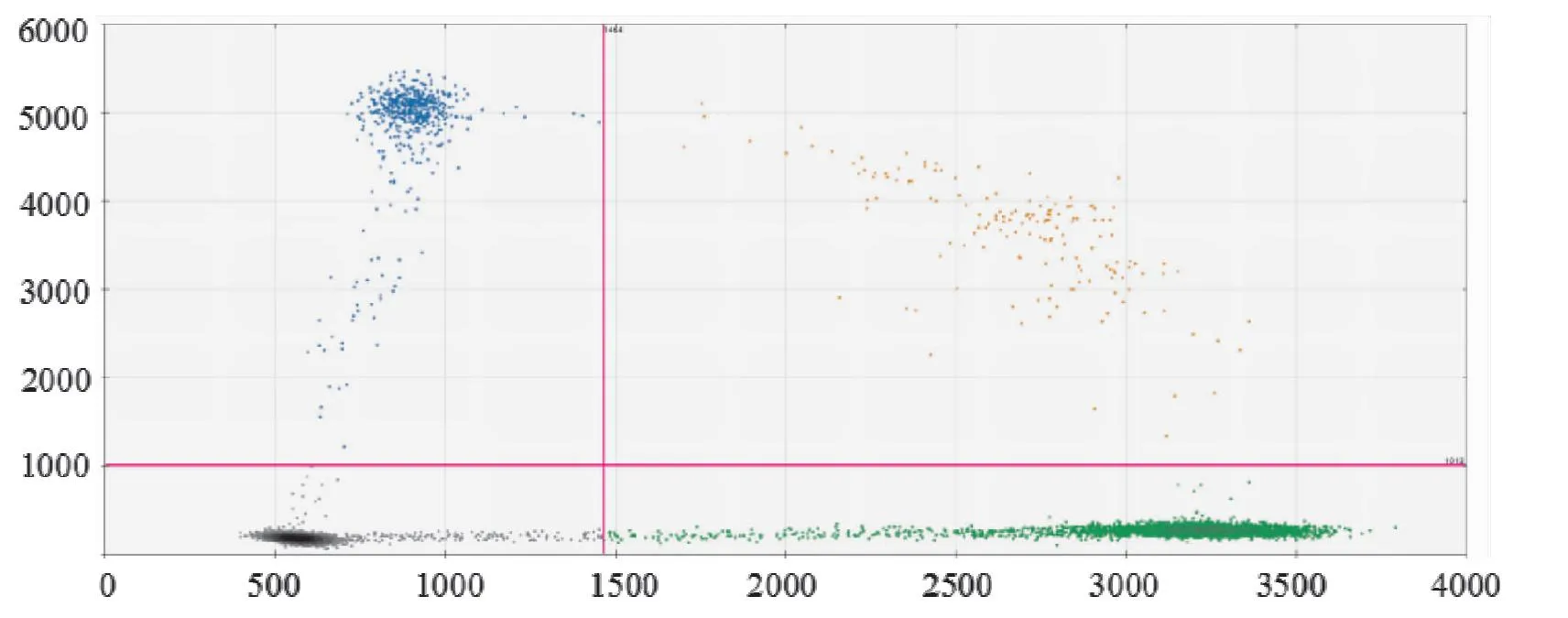
图17 ddPCR基因检测EGFR p.L858R突变阳性(蓝色信号)
讨 论
胸腔积液是恶性肿瘤的常见临床体征。胸水的脱落细胞学检查是判断良、恶性的主要手段[4]。传统的细胞学检查及液基细胞学方法虽快速、简单、经济,但有时由于收集的细胞量少,涂片易厚薄不均,细胞形态不典型,背景杂质多,给诊断带来困扰[5],鉴别肿瘤细胞来源困难无法给临床提供更多有效的信息。细胞蜡块包埋技术在许多国家已成为细胞学常规诊断技术[1]。回顾性分析我院恶性或可疑恶性胸腔积液标本248 例,对常规细胞学或液基细胞学与细胞蜡块HE染色进行对比,结果显示细胞蜡块中肿瘤细胞数量多,细胞结构清晰,并能形成一定的组织学结构和排列,有利于细胞学诊断,从而提高细胞学诊断的灵敏度和准确性[6,7]。在胸腔积液中,腺癌约占90%以上,以肺癌最为多见。腺癌细胞形态多样,可单个散在也可成团排列。单个散在的肿瘤细胞增大,核浆比倒置,核膜不规则,染色质增粗,可有核仁及核内假包涵体。成团的肿瘤细胞可呈乳头状,花环状,彩团状,腺腔样等,具有三维立体结构。这些形态在肺癌,乳腺癌,卵巢癌中具有相似的形态学特征,仅靠光镜观察形态不易明确诊断。
随着细胞学技术的迅速发展,免疫组化技术已逐步应用于细胞学的诊断中[8]。用常规涂片或液基细胞学做免疫细胞化学染色,常因收集的细胞数量少,不足以明确诊断[9];或因背景较脏容易造成非特异性染色,影响病理医师的判断。而细胞蜡块的优点是可以做连续切片,切片数量多可以满足诊断的需要。常规细胞学组与细胞蜡块组两种诊断方法存在一致性,但一致性较低。相较于常规细胞学,细胞蜡块具有一定的诊断价值(P<0.05),对细胞学阴性者,或可作为良好的补充。
结合免疫组化染色,可以帮助判断恶性肿瘤细胞的来源,为临床的治疗提供依据[10]。本组实验中248例恶性胸腔积液大多能明确判断肿瘤细胞的类型和来源。与常规细胞学相比,细胞蜡块技术提高了诊断的准确性,灵敏度和特异度。其中常规细胞学诊断为可疑肿瘤细胞22例和核异型细胞7例经细胞蜡块免疫组化检测后均能被明确诊断为恶性肿瘤细胞,1例少数异型细胞被明确为间皮细胞增生。29例明确为恶性肿瘤细胞,其中肺鳞癌2例,小细胞癌4例,食管鳞癌1例,乳腺癌2例,胃肠道腺癌8例,恶性间皮瘤1例,淋巴造血系统肿瘤2例,卵巢癌6例,仅有3例细胞蜡块诊断为恶性肿瘤,但因细胞蜡块中肿瘤细胞数量少或标记不理想未能明确肿瘤来源。
随着分子生物学的快速发展,分子靶向治疗和免疫治疗已广泛应用于临床[11,12]。对于恶性肿瘤晚期患者,如何获取可靠的检测样本至关重要[13]。文献报道,尽管肿瘤组织标本是分子病理诊断的首选,但对于大多数癌症晚期患者来说,胸腔积液和细胞液体活检似乎是其唯一可获取的样本[14]。此外,原发肿瘤组织与胸腔积液样本之间基因突变具有高度一致性,特别是肺腺癌EGFR的基因突变[15]。近年来,程序性死亡配体1(PD-L1)抑制剂在多种实体肿瘤免疫治疗中表现出优越的临床疗效,包括非小细胞肺癌(NSCLC)[16]。然而目前关于胸腔积液细胞蜡块行PD-L1免疫组化的数据量较少[17]。
本组80例患者中47例胸水细胞蜡块行ddPCR基因检测,33例胸水细胞蜡块行二代测序(NGS)检测。分子基因检测阳性患者37例,约占46%,以EGFR突变最常见(约为34%),略低于文献报道[18]。本组EGFR突变以EGFR第21号外显子p.L858R突变为主。其中1例恶性间皮瘤患者发生NF1突变。1例胸水蜡块免疫组化ALK阳性的患者经基因检测证实为EML4-ALK融合。其中26例患者行免疫组化PD-L1检测,检出阳性者7例(约为27%),且TPS评分PD-L1高表达的患者为1例肺腺癌和1例肺鳞癌,低于胸腔积液细胞蜡块免疫组化PD-L1检出率[19]。我们分析其原因可能是胸水细胞块检测PD-L1的检测样本数量不足,或由于本组研究中胸腔积液以肺腺癌原发为主,肺鳞癌少见。由此可见,难以耐受手术或活检的癌症晚期患者,胸水细胞蜡块行分子检测技术可以满足临床诊断、精准化治疗和预后评估的需求。
综上所述,细胞蜡块结合免疫组织化学及分子检测技术可提高胸腔积液常规细胞学诊断的灵敏度和准确性,在明确肿瘤细胞来源的基础上,进一步为临床靶向治疗及预后评估提供可靠的依据。
——以“蜡块的运动”演示实验为例

