饲料中添加有机酸复合物对凡纳滨对虾生长、营养物质利用、血清生化指标和肠道微生物的影响
柯虹瑜,王瑗瑗,张 鑫,姚文祥,李小勤,冷向军,2,3
(1.上海海洋大学,水产科学国家级实验教学示范中心,上海 201306;2.上海海洋大学,农业农村部鱼类营养与环境生态研究中心,上海 201306;3.上海海洋大学,水产动物遗传育种中心上海市协同创新中心,上海 201306)
凡纳滨对虾(Litopenaeusvannamei)是世界范围内最为重要的对虾养殖品种,也是我国养殖产量最高的对虾品种。2021年,我国凡纳滨对虾养殖产量达到了197万吨[1]。高密度集约化养殖模式下,养殖环境的恶化导致凡纳滨对虾自身免疫力下降,容易诱发各种疾病。为解决以上问题,抗生素被大量使用,由此严重影响了水产品质量安全。因此,寻找抗生素的替代品,一直是行业关注的热点。已有研究表明,有机酸及其盐类有望成为虾类养殖中的绿色饲料添加剂[2]。
富马酸是一种酸性较弱有机酸,长久以来一直被用作食品添加剂。其在畜禽饲料中的应用较多,在水产饲料中应用较少[3]。研究表明,饲料中添加富马酸可提高非洲鲶(Clariasgariepinus)抗温和气单胞菌能力,具有替代抗生素的潜力[3]。三丁酸甘油酯是丁酸的前体物质,其释放的丁酸具有较强酸性,能有效抑制肠道致病菌的增殖[4]。柠檬酸可平衡肠道菌群,促进对维生素、矿物质的吸收,由此提高动物的生长性能[5]。苹果酸在机体的三羧酸(TCA)循环代谢过程中发挥着重要作用,有研究表明,饲料中添加苹果酸能提高真鲷(Pagrusmajor)对磷的利用率[6]。各种有机酸的作用机理可能不完全相同,将其复合后,有可能发挥协同效应,产生更好的作用效果。ROMBENSO等[7]研究发现,复合酸组(丁酸、琥珀酸、富马酸)斑节对虾(Penaeusmonodon)的存活率显著高于单独添加组(富马酸)。目前,在凡纳滨对虾上研究报道过的有机酸有柠檬酸[8]、丁酸钠[2,9]等,但均为单独添加,尚未见有关富马酸和三丁酸甘油酯等有机酸联合添加的研究。
有机酸直接添加到饲料中,会造成损失,减弱作用效果。使用微囊化技术处理有机酸,是有机酸应用的一个发展趋势。因此,本实验以凡纳滨对虾为研究对象,在饲料中添加不同水平的微囊化有机酸复合物(organic acids complex,OC,主要成分为富马酸、三丁酸甘油酯等),考察对凡纳滨对虾生长性能、营养物质利用率、肝胰腺酶活、血清非特异性免疫酶活性和肠道微生物组成的影响,为有机酸在凡纳滨对虾养殖中的合理应用提供依据。
1 材料与方法
1.1 实验设计和实验饲料
微囊化有机酸复合物由加拿大集富动物营养公司(JefoNu-trition Inc.,Canada)提供,产品颗粒大小为80目,有机酸含量为50%,包括富马酸(16%)、三丁酸甘油酯(12.5%)和少量山梨酸、苹果酸、柠檬酸等,包被材料为氢化油脂,占微囊化有机酸复合物的50%。
设置鱼粉含量为10%的基础饲料(对照组),在此基础上添加0.05%,0.10%,0.15%的微囊有机酸复合物,制成4组等氮等脂饲料:OC-0,OC-5,OC-10,OC-15组。各饲料添加0.05%的三氧化二钇作为指示剂,用于测定营养物消化率。各饲料原料粉碎后过60目筛,逐级混匀,90 ℃制粒,95 ℃后熟化20 min,晾干至水分约10%,密封保存备用。配方组成及常规营养组成见表1。

表1 实验饲料配方及营养水平(风干重,%)Tab.1 Ingredients and proximate composition of experimental diets(air dry basis,%)
1.2 实验虾与饲养管理
凡纳滨对虾虾苗购自上海青浦某育苗基地,在水泥池中进行前期暂养,投喂商品饲料(苏州通威特种饲料有限公司生产,粗蛋白含量≥42%)50 d。正式实验前24 h停止投饵,挑选大小均匀的健康对虾1 000尾初始平均体重[(1.0 ±0.1)g],随机分配到20口网箱(1.0 m×1.0 m×1.2 m),置于4口水泥池(5 m×3 m×1.2 m)中,每口水泥池中放置5口网箱,每口网箱50尾虾。实验共设置4个处理组,每个处理组5个平行。养殖期间,每日投喂量为虾体重量的3%~10%(前期投喂高,后期低),分4次投喂(6:00、12:00、17:00和23:00)。根据对虾的进食情况和天气情况及时调整具体投喂量,各网箱投饲量基本一致,并确保饲料在投喂后2小时内被采食完;昼夜充气,采用虹吸法吸走网箱底部粪便,养殖前期每周吸污一次,换水1/3,所用水源为沉淀后池塘水。实验期间,水温27~32 ℃、盐度0.5‰~1.0‰,溶氧≥5.6 mg/L,pH2)1 kg矿物质预混料含钾200.00 g、镁58.200 g、铜3.550 g、锌5.400 g、锰1.950 g、钴0.198 g、硒0.040 g、碘0.248 g。
值7.8~8.5,氨氮≤0.2 mg/L,亚硝酸盐≤0.05 mg/L。饲养实验共持续56 d。于上海海洋大学滨海养殖基地进行。
1.3 粪便收集
养殖实验结束前一周,于每次投喂2 h后收集网箱底部包膜完整的粪便,105 ℃干燥,密封存放于-20 ℃冰箱中,以进行营养物质表观消化率的测定分析。
1.4 样品采集
养殖实验开始前,随机取60尾虾保存于-20 ℃冰箱,用于初始常规成分测定。养殖实验结束后,实验虾进行24 h饥饿处理,计数并称量总重;每网箱随机取13尾虾并于静脉窦处取血淋巴,离心(5 000 r/min,10 min),取血清保存备用。每网箱取4尾对虾于-20 ℃保存,用于全虾常规成分分析。另取9尾对虾进行肝胰腺采样,每3个肝胰腺汇集为1个样本,-80 ℃保存,用于消化酶活性测定。另根据生长性能,选对照组和OC-10组,每网箱取3尾已抽血对虾,将全肠(未冲洗)汇集成一个样本,用作肠道微生物组成分析。
1.5 测定指标与方法
1.5.1 生长性能
生长性能指标,包括存活率(SR)、增重率(WGR)、饲料系数(FCR)、蛋白质沉积率、脂肪沉积率,计算如下:
SR=终末尾数(尾)/初始尾数(尾)×100%
WGR=[终末体质量(g)-初始体质量(g)]/初始体质量(g)
FCR=摄入饲料量(g)/[终末体质量(g)-初始体质量(g)]
蛋白质沉积率=全虾蛋白增加量(g)/总蛋白摄入量(g)×100%
脂肪沉积率=全虾脂肪增加量(g)/总脂肪摄入量(g)×100%
1.5.2 全虾和饲料的常规成分
饲料、全虾和粪便常规分析采用国际标准方法(AOAC,2005)。水分含量通过烘箱在105 ℃下烘干至恒重测定;在测量水分含量之后,收集干燥的饲料、全虾样品,将其研磨成粉末,以测定粗蛋白,粗脂肪和灰分含量。粗蛋白质含量采用自动凯氏定氮仪(2300-Auto-analyzer,Foss Tecator,Sweden)测定;粗脂肪含量采用氯仿-甲醇法测定;粗灰分含量是将样品碳化后放置550 ℃马福炉中灼烧6 h后测得。
1.5.3 营养物质利用率
饲料和粪便中钇元素的含量采用等离子原子发射光谱法(VistaMPX,Varian Alo Alto,California,American)进行测定。
干物质表观消化率、蛋白质表观消化率、脂肪表观消化率、磷表观消化率,计算公式如下:
饲料干物质的表观消化率=(1-饲料中Y2O3含量/粪便中Y2O3含量)×100%
各营养成分的表观消化率=[1-(粪便中某营养成分含量/饲料中某营养成分含量)×(饲料中Cr2O3含量/粪便中Cr2O3含量)]×100%
1.5.4 消化酶活力
蛋白酶:称取虾肝胰腺组织,加入9倍预冷生理盐水,在4 ℃条件下匀浆,离心15 min(3 000 r/min)。取上清液用福林-酚试剂法测定酶活力。
淀粉酶:取0.1 g肝胰腺组织,加入9倍预冷生理盐水,剪碎后加入钢珠,于组织研磨仪进行研磨,冷冻离心(4 ℃,3 000 r/min,10 min),取上清液测酶活力。
酶活力定义如下:
淀粉酶(U/gprot):底物与1×10-3g蛋白在37 ℃下反应30 min,酶活单位以水解的0.01 g淀粉为1单位。
蛋白酶(U/mgprot):以2%酪蛋白溶液为底物,每1×10-3mg组织蛋白在pH 7.2,37 ℃条件下,每分钟分解酪蛋白生成10-3mg酪氨酸的浓度。
1.5.5 血清生化指标
血清生化指标:采用2,4-二硝基苯肼法测定谷草转氨酶活性(GOT,U/L),谷丙转氨酶活性(AST,U/L)测定采用赖氏比色法,超氧化物歧化酶(SOD,U/mL)活性和碱性磷酸酶(AKP,金氏单位/100 mL)活性分别采用黄嘌呤氧化酶法和对硝基苯磷酸盐法测定。所有指标均采用南京建成生物工程研究所生产试剂盒测定。
1.5.6 肠道微生物
肠道微生物由上海美吉生物医药科技有限公司进行分析测定。采用16S rDNA基因V3、V4高变区特异性引物338F(ACTCCTACGGGAGGCAGCAG)和806R(GGACTACHVGGGTWTCTAAT)对细菌基因组DNA进行扩增,通过Illumina MiSeq platform(Illumina)平台对肠道菌群进行高通量测序,原始数据经处理得到优化序列,对获得的不同相似度水平序列,以97%的相似水平对OUT进行划分。在Majorbio Cloud Platform(www.majorbio.com)基于OTU进行alpha多样性使用UPARSE(V7.1)分析菌群丰度(Chao 指数)和菌群多样性(Shannon指数、Simpson指数)。不同分类的鉴定结果以OUT注释为基准进行划分,统计分析。
1.6 数据分析
数据以均值±标准差(mean±SD)表示。采用SPSS25.0统计软件统计分析。所有数据均采用单因素方差分析(ANOVA),用Tukey氏法对数据进行多重比较(肠道微生物采用Majorbio Cloud Platform的T检验)。当P<0.05时,认为平均值有显著差异。
2 结果
2.1 生长性能
由表2可知,饲料中添加了有机酸复合物后,OC-10和OC-15组的WGR较对照组提高了18.7%和17.9%,FCR降低了16.1%和18.5%。各组蛋白质沉积率、脂肪沉积率、SR无显著差异。

表2 饲料中添加有机酸复合物对凡纳滨对虾生长性能的影响Tab.2 Effect of organic acids complex supplementation on growth performance of L.vannamei
2.2 全虾体成分
由表3可知,各组对虾全虾水分、粗灰分含量与对照组相比均无显著性差异。饲料中添加OC后显著降低了全虾粗脂肪含量。OC-5和OC-10组粗蛋白较对照组显著提高。

表3 饲料中添加有机酸复合物对凡纳滨对虾体成分的影响(湿重)Tab.3 Effect of organic acids complex supplementation on body composition of L.vannamei(wet weight) %
2.3 营养物质利用率
由表4可知,在饲料中添加有机酸复合物对凡纳滨对虾的干物质消化率、蛋白质消化率、脂肪消化率和磷消化率无显著影响。

表4 饲料中添加有机酸复合物对凡纳滨对虾营养物质利用率的影响Tab.4 Effect of organic acids complex supplementation on nutrient utilization of L.vannamei %
2.4 肝胰腺消化酶
由图1可知,饲料中添加0.05%~0.15%有机酸复合物,均显著提高了对虾肝胰腺淀粉酶活性,但对肝胰腺蛋白酶活性无显著影响(图2)。

图1 饲料中添加有机酸复合物对凡纳滨对虾肝胰腺淀粉酶的影响Fig.1 Effect of dietary organic acids complex on amylase activity in hepatopancreas of L.vannamei
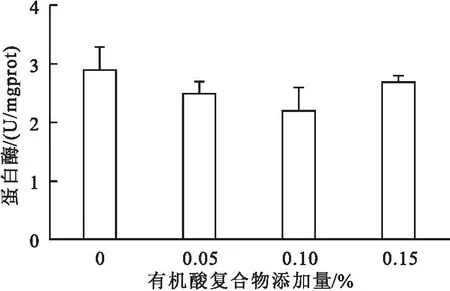
图2 饲料中添加有机酸复合物对凡纳滨对虾肝胰腺蛋白酶的影响Fig.2 Effect of dietary organic acids complex on protease activity in hepatopancreas of L.vannamei
2.5 血清生化指标
由表5可知,各有机酸复合物添加组超氧化物歧化酶均较对照组显著提高,各组碱性磷酸酶、谷草转氨酶、血清谷丙转氨酶无显著差异。
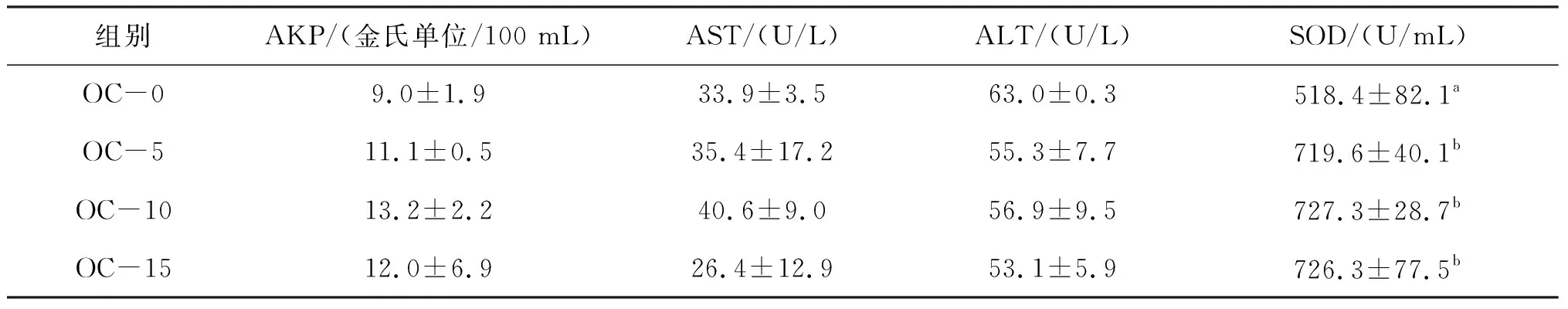
表5 饲料中添加有机酸复合物对凡纳滨对虾血清生化指标的影响Tab.5 Effect of organic acids complex supplementation on serum biochemical parameters of L.vannamei
2.6 肠道微生物
由表6可知,OC-0组和OC-10组物种覆盖率接近1,说明已经将群落菌体充分采样。数据可以代表细菌种群。OC-10组的Chao指数在数值上高于OC-0组。

表6 饲料中添加有机酸复合物后凡纳滨对虾肠道微生物多样性指数Tab.6 Diversity index of intestinal microbial of L.vannamei fed diets with organic acids complex supplementation
OTU的韦恩图如图3所示,OC-0组和OC-10组共有OUT数目为819个,OC-0组和OC-10组各特有OUT数目为250个和86个。
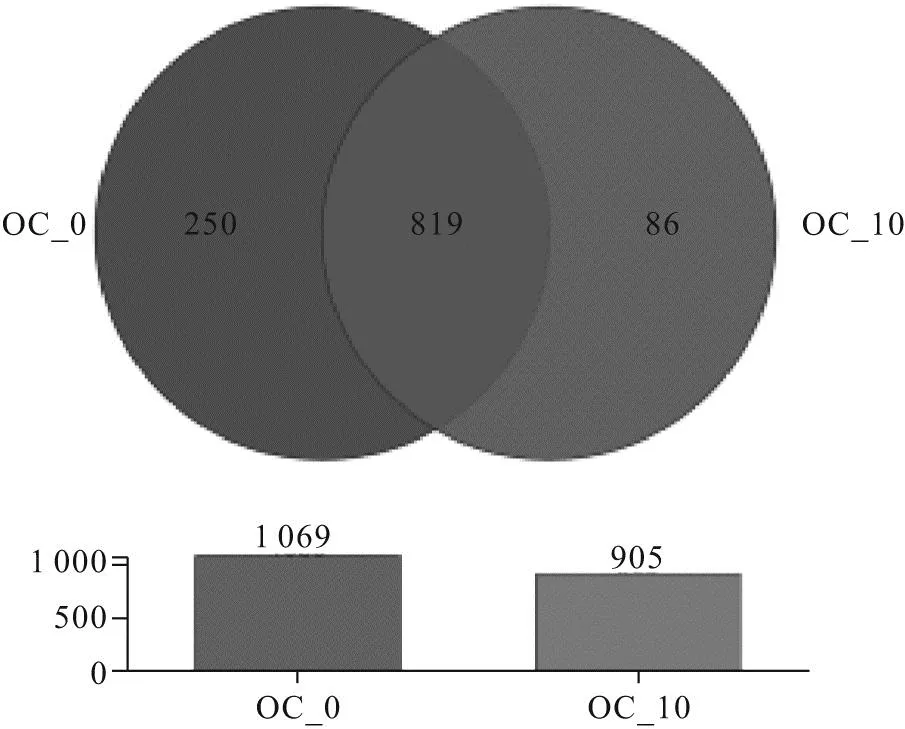
图3 OTUs的韦恩图Fig.3 Venn diagram of OTUs
由图4知,OC-0组和OC-10组在门水平上主要有变形菌门(Proteobacteria)、放线菌门(Actinobacteriota)、厚壁菌门(Firmicutes)和绿弯菌门(Chloroflexi)、蓝藻菌门(Cyanobacteria)、拟杆菌门(Bacteroidota)。其中,变形菌门、放线菌门、厚壁菌门是OC-0组的优势菌门,分别占细菌总数的53.54%,15.94%,10.67%。OC-10组的优势菌门有变形菌门,占细菌总数的53.79%,以及放线菌门(19.97%)和绿弯菌门(7.81%)。放线菌门在两组中占比存在数值上的差异(图4,图5,表7)。
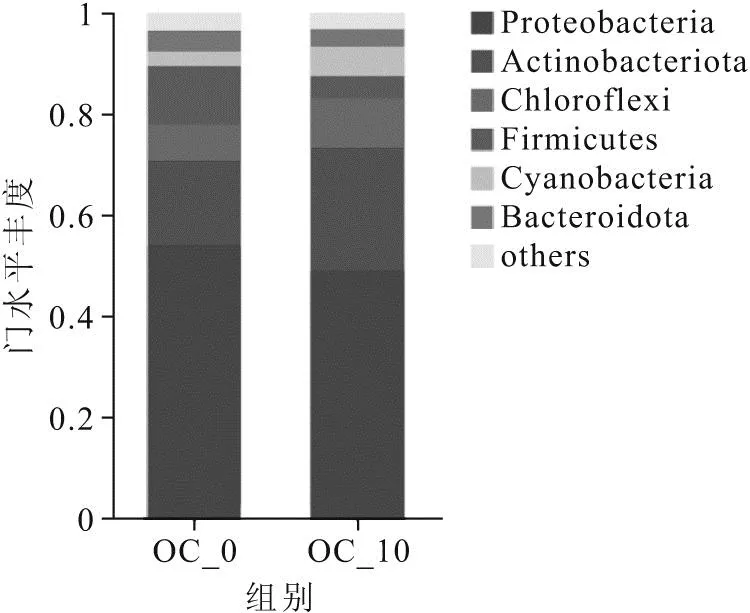
图4 饲料中添加有机酸复合物后凡纳滨对虾肠道菌群的门水平丰度Fig.4 Community abundance of intestinal microbiota at phylum level of L.vannamei fed diets with organic acids complex supplementation
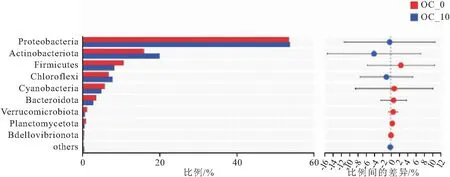
图5 凡纳滨对虾肠道微生物门水平上的差异检验Fig.5 The difference test of intestinal microbiota of L.vannamei at phylum level
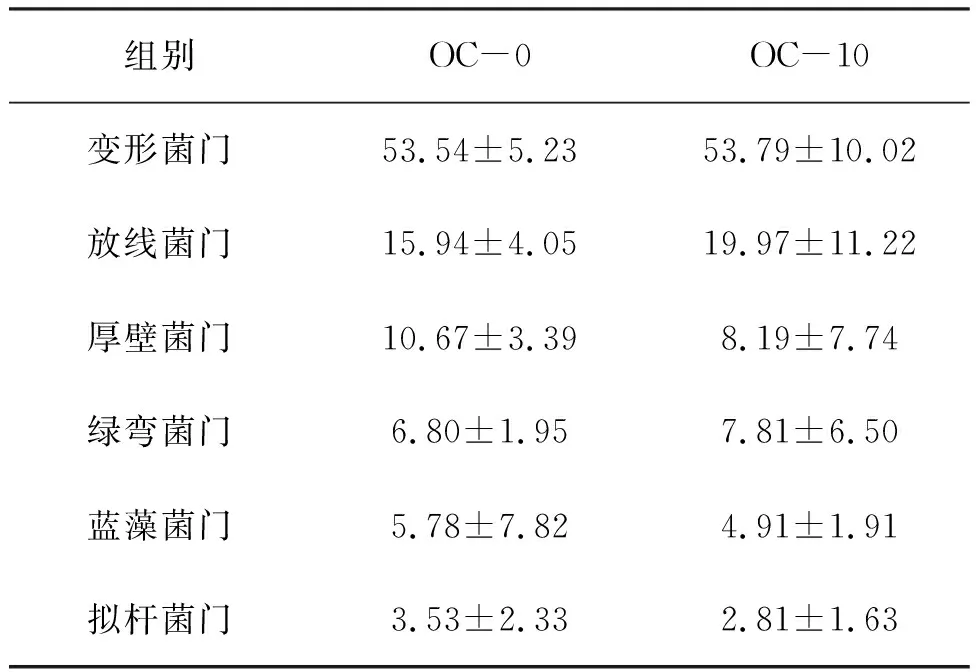
表7 凡纳滨对虾肠道菌群中主要菌门的占比Tab.7 The proportions of major intestinal flora of L.vannamei at phylum level %
在属水平上,芽殖杆菌属(Gemmobacter)是主要肠道微生物,占OC-0组16.34%,占OC-10组17.73%。此外,OC-0组的优势菌还有Arthrospira_PCC-7345(4.58%),而分枝杆菌属(Mycobacterium)是OC-10的优势菌。其中,OC-10组的分枝杆菌属较OC-0组显著增加(图6,图7,表8)。

图6 饲料中添加有机酸复合物后凡纳滨对虾肠道菌群的属水平丰度Fig.6 Community abundance of intestinal microbiota at genus level of L.vannamei fed diets with organic acids complex supplementation

图7 凡纳滨对虾肠道微生物属水平上的差异检验Fig.7 The difference test of the intestinal microbiota of L.vannamei at genus level

表8 凡纳滨对虾肠道菌群中主要菌属的占比Tab.8 The proportions of major intestinal flora of L.vannamei at genus level %
3 讨论
3.1 OC对凡纳滨对虾生长性能和体成分的影响
有机酸在饲料中的添加,能够起到促进水产动物生长的作用[10]。研究表明,在饲料中补充0.2%柠檬酸,显著提高了凡纳滨对虾增重率,降低了饲料系数[6]。唐启峰等[4]研究发现,饲喂含有三丁酸甘油酯的饲料后,凡纳滨对虾的周增重和蛋白质效率显著提高,饵料系数显著降低。本实验中,饲料中添加0.1%和0.15%有机酸复合物后,显著提高了虾体增重率,降低了饲料系数(P<0.05)。有机酸对生长性能的改善,可能与促进肠道有益菌的增长,促进其消化吸收有关[10]。此外,在含12%鱼粉的饲料中添加0.3%丙酸钠和富马酸,对凡纳滨对虾生长性能无显著影响[9]。不同的研究结果,可能与有机酸组成和基础配方不同有关。
在全虾体成分方面,OC的添加降低了粗脂肪含量(P<0.05),OC-5和OC-10组的粗蛋白含量显著增加(P<0.05)。粗蛋白含量的提高可能是由于有机酸复合物的添加降低了肠道内的pH值,使食物排空减慢,蛋白质在肝胰腺内停留时间延长导致[11]。在斑节对虾饲料中添加1%富马酸,对幼虾粗脂肪含量并无显著影响[7];在饲料中添加柠檬酸,对凡纳滨对虾体成分也无显著影响[8]。XU等[12]研究表明,丁酸可通过降低脂质合成相关基因的表达水平降低大黄鱼(Larimichthyscrocea)体脂含量。本实验中,全虾粗脂肪含量的降低,可能与OC促进了脂肪代谢有关,这有待进一步研究。
3.2 OC对凡纳滨对虾消化能力的影响
研究表明,在摄食了含有机酸的饲料后,水产动物的营养物质消化利用率会得到提高,这与有机酸种类和养殖对象密切相关[13]。WING等[14]发现,斑节对虾摄食了添加2%有机酸复合物(含甲酸、乳酸、苹果酸和柠檬酸)的饲料后,蛋白质消化率、干物质消化率、磷消化率均显著提高(P<0.05)。消化率的提高,可能与刺激了消化腺的分泌有关。然而,在建鲤饲料中添加0.25%的苹果酸、富马酸和丁酸钠,仅提高了干物质和粗蛋白消化率(P>0.05)[15]。本实验中,在饲料中添加有机酸复合物对凡纳滨对虾的干物质消化率、蛋白质消化率、脂肪消化率和磷消化率均无显著影响(P>0.05)。不同的作用结果,可能与有机酸与养殖对象种类有关。
凡纳滨对虾肝胰腺中消化营养物质的关键酶有蛋白酶、淀粉酶和脂肪酶。在饲料中添加OC后,凡纳滨对虾的淀粉酶活力显著提高。这与翟秋玲等[16]的结果一致。在菊黄东方鲀(Takifuguflavidus)[16]饲料中添加三丁酸甘油酯使回肠的脂肪酶活力、空肠和回肠胰蛋白酶活力以及肠道淀粉酶活力得到提高。在草鱼(Ctenopharyngodonidella)饲料中添加复合酸后,淀粉酶活力显著提高[17]。本实验中凡纳滨对虾的蛋白酶活性与对照组相比无显著差异,但在数值上出现了下降。甲壳动物胰蛋白酶的最适pH环境为7~9,摄入的酸过多可能会影响凡纳滨对虾肝胰腺内环境[11]。
3.3 OC对凡纳滨对虾血清生化指标的影响
凡纳滨对虾无特异性免疫系统,非特异免疫系统是其抵御病害的重要系统,肝胰腺是凡纳滨对虾极其重要的器官。为探究复合酸是否对肝胰腺产生作用,选取谷草转氨酶(AST)、谷丙转氨酶(ALT)来评价凡纳滨对虾肝胰腺健康程度。在无刺激环境下,转氨酶活性较低,心脏和肝脏组织细胞受到损伤,或者天气变化较大,血清转氨酶活性升高[18]。在对草鱼的研究中,程卓[19]发现三丁酸甘油酯并未影响谷丙转氨酶和谷草转氨酶活性。本实验中,各有机酸复合物添加组的AST、ALT与对照组相比无显著差异,表明OC并未对凡纳滨对虾肝胰腺产生不利影响。

3.4 OC对凡纳滨对虾肠道微生物的影响
本实验中,添加有机酸复合物后,OC-10组的Chao指数得到提高,表明菌群丰度提高,OC改变了肠道菌群组成[23]。已有研究证明,菌群多样性在维持生态功能方面有重要作用,提高菌群多样性可以提高菌群稳定性,减少机体患病风险[24]。门水平上,变形菌门(Proteobacteria)是凡纳滨对虾肠道中发现的核心细菌类群[25],厚壁菌门(Firmicutes)在草鱼肠道中占主导地位[26]。本实验中凡纳滨对虾肠道微生物菌群主要有变形菌门、厚壁菌门、放线菌门等,与吴金凤等[27]的研究结果相似。可见,保守性是凡纳滨对虾肠道微生物菌群组成的特点之一。厚壁菌门中产丁酸细菌可以产生短链脂肪酸,宿主可以利用这些脂肪酸促进肠粘膜的健康[28]。本实验中,变形菌门在菌门中占比明显高于厚壁菌门,LI等[25]在凡纳滨对虾中也有相似发现,这可能是由于两种细菌的生理功能差异以及其他影响因素,如饮食和栖息地。另外,本实验中,拟杆菌门也是OC-0组和OC-10组的优势菌群之一。当机体失衡时,拟杆菌门可能会成为致病菌[29],当机体维持正常时,则是凡纳滨对虾肠道菌群中的优势菌,能够从许多方面影响机体健康。

