婴儿血管瘤合并先天性门体静脉分流1例
杨星星, 罗丹, 刘凯林, 马岩, 梁丽俊
1.宁夏医科大学, 宁夏 银川 750004; 2.宁夏医科大学总医院,宁夏 银川 750000;3.西北大学附属医院 西安市第三医院,陕西 西安 710018
1 临床资料
患儿男,2个月7天,因全身皮肤散在红色肿物及黄染2个月余,加重1周就诊。患儿出生后发现全身散在红色斑片,且皮肤黄染,家属未予重视,后全身红色斑片增多增大并出现黄疸进行性加重,遂就诊我院。患儿系足月顺产,出生体重2.35 kg,无窒息抢救史、外伤手术史。其母怀孕期间无特殊用药史,家族中无传染病、遗传代谢性疾病及类似病史。孕母28周产检发现胎儿存在门体静脉分流;患儿出生后6 d查腹部彩超示:肝内多发婴儿型血管内皮瘤伴门体静脉分流。体格检查:T 37.2 ℃,P 121次/min,R 36次/min,体重 5 kg。肝脏肋下约4 cm,质中,边钝,脾脏肋下约2 cm,质软,边缘锐。皮肤科检查(图1A):患儿全身皮肤及巩膜可见轻度黄染,头皮、面颈部、胸部、背部、腹部、臀部、四肢散在大小不等红色、暗红色斑块,质软,界限清楚,共约54块,最大约1.5 cm×1.5 cm,触痛阴性,高出于皮面,压之褪色,无破溃。
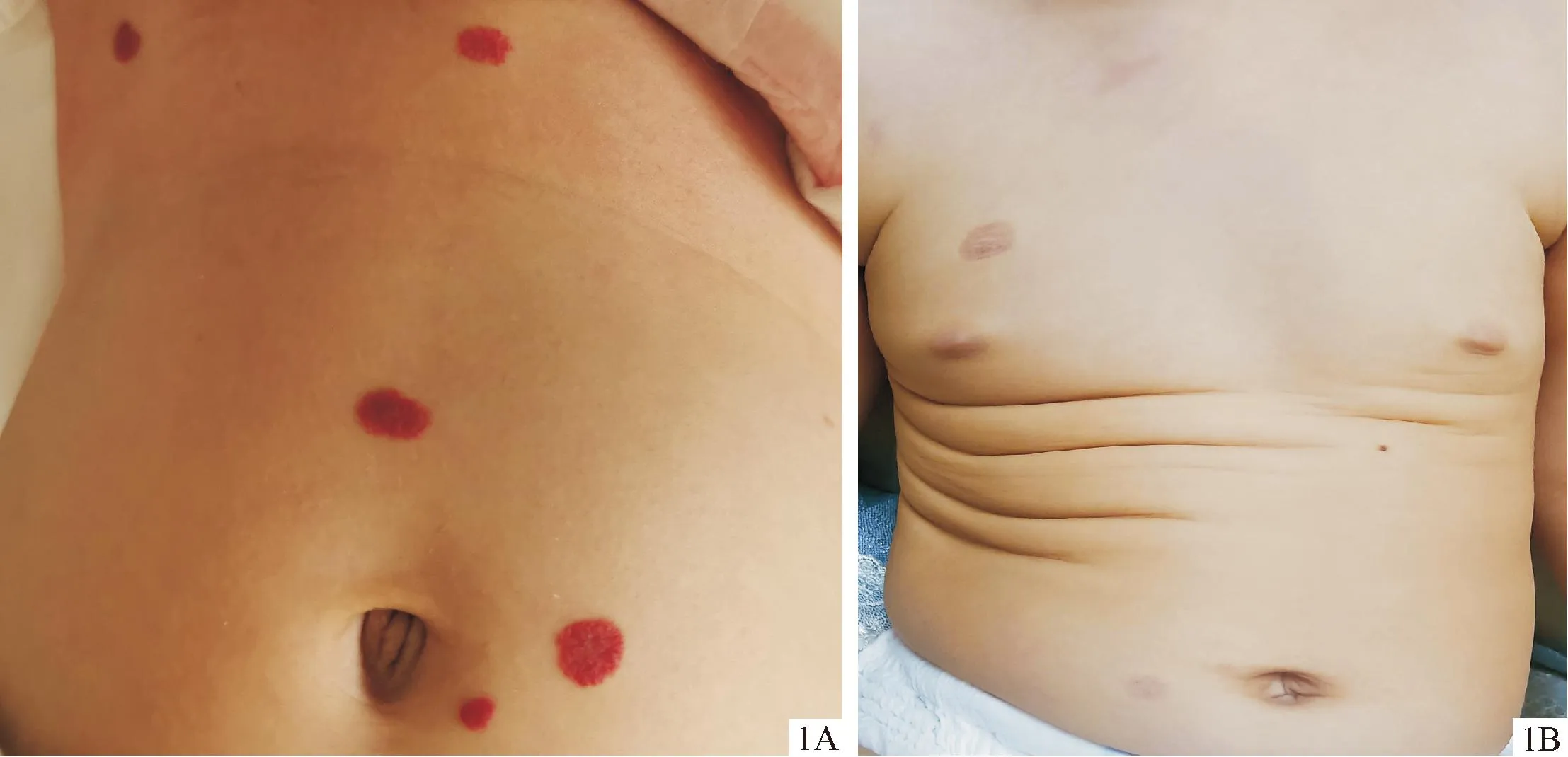
图1 婴儿血管瘤临床图片 1A:治疗前患儿全身可见大小不一红色斑块,凸起皮面; 1B:治疗8个月后,仅躯干可见少量血管瘤残留印记
实验室检查:血常规、肾功、甲功、心脏彩超、心电图、常规超声心动图均未见异常;凝血功能示:PT 13.6 s(参考值9.4~12.5 s),APTT 38.9 s(25.1~36.5 s),FIB 1.45 s(2.38~4.98 s),TT 19.7 s(10.3~16.6 s);肝功示:TBIL 160.4 μmol/L(3~22 μmol/L),BC 45.9 μmol/L(0~5 μmol/L),BU 63.4 μmol/L(0~19 μmol/L),AST 357.4 U/L(17~59 U/L),ALT 180.1 U/L(21~72 U/L);TORCH五项:CVM-IgM 140.83 AU/mL(<8 AU/mL)。浅表器官彩超检查示:右侧胸壁脂肪组织内可见高回声结节(14.4 mm×10.4 mm×4.1 mm),内部见点状、条索状血流信号,脐下皮下脂肪层内高回声结节(9.5 mm×5.4 mm×1.7 mm),内部见星点状血流信号。腹部彩超示:肝右叶见1 cm×0.8 cm高回声结节,边界欠清,内回声尚均匀;脾大,肋下4.2 cm,脾脏不均质回声结节,边界欠清,形态不规则,内回声不均,可见血管显示(图2A)。CDFI:血流信号丰富;肝中静脉增宽(图2B),PW部分管腔可测及中等流速、有搏动频谱;门静脉矢状部增宽,与肝中静脉多发交通支,较宽0.32 cm,内探及花色血流(图2C)。上腹部CT示:肝脏多发不规则低密度影,最大直径25 mm,增强扫描病灶明显强化,其内可见粗大血管。
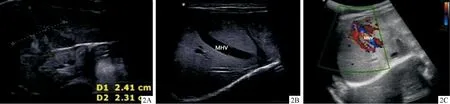
图2 腹部B超检查 2A: 脾脏中部见一不均质回声结节; 2B:肝中静脉宽0.62 cm;2C: CDFI:肝中静脉与门静脉矢状部间多发交通支形成,可见自门静脉分支至肝静脉的血流信号(MHV,肝中静脉)
诊断:①婴儿血管瘤;②先天性门体静脉分流(合并动静脉瘘);③巨细胞病毒病。
治疗:患儿入院时肝功能异常,且存在巨细胞病毒感染,遂给予静脉滴注更昔洛韦抗病毒[5 mg/(kg·次),每12 h 1次]、复方甘草酸苷及口服双环醇片保肝降酶治疗;待患儿黄疸完全消退,复查凝血功能及肝功能好转后,于入院后第14天,在持续心电监护下给予口服盐酸普萘洛尔2.5 mg口服, 每12 h 1次, 维持原剂量治疗2 d后,第3天加量至每次5 mg,分2次口服;用药期间监测患儿心率波动在115~150次/分,监测患儿血糖、血压、肝肾功能均未见异常。用药1周后患儿全身部分皮肤血管瘤颜色变淡,瘤体变软,遂出院,院外普萘洛尔量维持在2 mg/(kg·d)。用药1个月后患儿全身血管瘤无增大趋势,四肢血管瘤部分消退。用药2个月后,复查腹部彩超示脾肋下1.2 cm,肝、脾实质回声均匀,未见占位病变,肝中静脉与门静脉矢状部之间仍可见多发交通支。用药3个月后患儿头皮、面颈部、躯干血管瘤体积明显缩小,四肢血管瘤全部消退,复查上腹部CT示迂曲畸形血管影变化不明显。用药5个月后复查浅表器官彩超示右胸壁、脐旁6点、9点处血管瘤未见明显回声增强,未见血流信号,普萘洛尔剂量逐渐减少。用药8个月后患儿仅躯干可见少量血管瘤残留印记(图1B)。复查腹部彩超示:肝内不均质回声增强区,其内未见明显血流信号,门静脉主干内径正常;胆、胰、脾、双肾声像图未见明显异常。患儿停药。随访1年患儿生长发育同正常同龄儿,未观察到血管瘤反弹生长。
2 讨论
婴儿血管瘤(infantile hemangiomas,IH)是婴儿期最常见的良性肿瘤,发病率在5%~10%[1]。IH的前驱病变出生时即可存在,表现为充血性、擦伤样或毛细血管扩张性斑片,所有病变多在出生后几周内出现,具有独特的生长周期,即增殖期、消退期、消退完成期,瘤体免疫组织化学标记物GLUT1是阳性[1-2]。2014年国际脉管异常研究学会(The International Society for the Study of Vascular Anomalies,ISSVA)将IH根据其形态、范围或分布进一步细分为单发型、多发型、节段型、中间型,根据其在皮肤和/或皮下组织中的位置细分为浅表、深在、混合等其他类型[3]。浅表IH在临床中最常见,表现为淡红色至红色的斑点、丘疹、斑块,深部IH呈青色或淡蓝色的结节[2]。多发型IH指全身瘤体个数>5个以上的IH,常合并内脏血管瘤,最常见累及的器官是肝脏,也可见于胃肠道和肺,甚至包括中枢神经系统[4]。婴儿期的肝血管瘤生长迅速,在一部分患儿中,由于广泛的动静脉、动门静脉或门静脉分流,随着病情发展,可能会导致充血性心力衰竭,还可出现贫血、血小板减少、甲状腺功能减退、梗阻性黄疸和腹腔间隔室综合征等[5]。先天性门体静脉分流(congenital portosystemic shunts,CPSS)是罕见的门静脉系统发育畸形,指肝脏门脉系统与腔静脉系统或门脉属支与肝静脉系统之间存在短路血管,导致门静脉系统的血流部分或全部分流至全身血管。CPSS分为肝内和肝外门体静脉分流(Abernethy畸形),肝内分流更常见,在生命早期更容易闭合,而肝外分流很少自发闭合,常需积极治疗。CPSS可导致肝内灌注不足,引起肝功能受损和代谢功能异常,严重时可诱发肺动脉高压、肝肺综合征和肝性脑病,与CPSS相关的肝脏良恶性肿瘤的发病率也较高,包括腺瘤、血管瘤、肝母细胞瘤和肝癌等[6-8]。婴儿脾血管瘤极为罕见,目前缺乏相关报道。
超声是IH诊断的首选检查方式,目前临床上彩色多普勒在IH患儿中应用较多,增殖期的IH血流信号丰富[8]。对于全身多处皮肤血管瘤(≥5个)的患儿,要注意筛查是否合并内脏器官的血管瘤,尤其是肝脏血管瘤,其典型超声表现为单发或多发的均匀低回声或高回声肿块[9]。由于彩色多普勒超声可实时显示血管内径、血流方向和速度等信息,且便捷无创,也常作为诊断和随访CPSS的最佳检查手段[6-8]。
IH 需与先天性血管瘤(congenital hemangioma, CHs)、卡波西样血管内皮瘤等疾病相鉴别。CHs罕见,出生时即存在,不会出现IH特有的出生后的增殖期,并且其瘤体免疫组织化学标记物GLUT-1呈阴性[2,10]。卡波西样血管内皮瘤多表现为紫红色浸润性结节或斑块, 部分患儿可有疼痛、运动受限, 也可因卡梅现象(Kasabach-Merritt phenomenon, KMP)的发生,伴发血小板减少、微血管溶血性贫血和消耗性凝血功能障碍等一系列临床表现[10]。IH还需与脉管畸形相鉴别,脉管畸形是指血管或淋巴管的先天发育畸形。浅表型IH早期应与微静脉畸形区别,深在型IH应与静脉畸形、动静脉畸形及淋巴管畸形等区别。脉管畸形与患儿身体成比例增长,不能自行消退[10-11],超声图像上多可见迂曲扩张的管状结构或管道与软组织相间的回声,且内部血流信号少于IH[11]。
本例患儿就诊时全身多发皮肤血管瘤且伴发黄疸,腹部彩超显示有肝脾内结节,结合病史及影像学表现,考虑血管瘤。同时彩色多普勒可见自门静脉分支至肝静脉的红蓝交替的血流信号,属于先天性肝内门体静脉分流(congenital intrahepatic portosystemic venous shunt,CIPSVS)[8,12]。腹部CT提示动静脉瘘,肝动静脉瘘是肝动脉与门静脉或肝静脉之间不通过肝血窦而直接相通的畸形血管团,多继发于外伤、介入治疗、肝脏肿瘤等,10%为先天性发育异常,主要类型包括肝动脉-肝静脉瘘、肝动脉-门静脉瘘、门静脉-肝静脉瘘[13],其中门静脉-肝静脉瘘罕见,属于CIPSVS的一种。先天性肝动静脉瘘多因在婴幼儿或儿童时期表现出慢性心力衰竭、贫血、肝脏增大、肝脏血管瘤等而被发现,可通过行CT结合三维重建技术、MRI、血管造影进一步明确类型[14]。但本例患儿家属拒绝继续进行相关检查,未能进一步明确其具体类型。CIPSVS患儿部分可在1~2岁左右自发关闭[6-8],故本例患儿暂予观察并定期复查中。
IH主要以局部外用和系统用药为主,辅以激光治疗或局部注射等[10]。普萘洛尔是非选择性肾上腺β受体阻滞药,因其卓越的疗效和经过充分研究后的安全性,现已成为一线全身治疗药物,但治疗IH 的作用机制目前不完全清楚。迄今为止,普萘洛尔在治疗剂量方面尚未达成一致意见,但欧洲及中国的专家共识均建议住院患者以低剂量开始普萘洛尔的治疗,并分两次口服,逐渐增加至耐受的最大剂量[15-16]。低血糖、心动过缓、低血压、睡眠障碍、支气管痉挛和胃肠道不适等是普萘洛尔治疗的已知不良反应[10,15-16]。本病例应用普萘洛尔治疗取得较好疗效,且未出现不良反应。
综上所述,本研究报道1例临床罕见的多发型皮肤血管瘤,并累及内脏器官,有CPSS同时合并动静脉瘘。由于患儿发现较早、诊断及时并且是肝内分流,临床未发生严重并发症。彩色多普勒超声对于IH合并CPSS的诊断具有较高的准确性,有重要影像学价值,是随访观察的首选方法。同时本研究表明,持续予普萘洛尔为单一药物可以作为并发多发皮肤和肝脏婴儿血管瘤的安全有效的一线治疗。研究为婴儿脾血管瘤的药物治疗提供了一定的参考价值。

