蒲公英TmRAV1基因克隆及其响应脱落酸信号表达分析
吴志清, 亓希武, 房海灵, 于 盱, 李 莉, 柏 杨, 刘 群,①, 梁呈元,①
〔1. 南京中医药大学, 江苏 南京 210023;2. 江苏省中国科学院植物研究所(南京中山植物园) 江苏省植物资源研究与利用重点实验室, 江苏 南京 210014〕
蒲公英(TaraxacummongolicumHand.-Mazz.)为一种药食同源的多年生植物,全草入药,具有清热解毒、消肿散结等功效[1]。蒲公英主要有效成分为酚酸类、黄酮类和香豆素类等[2-3],具有抗菌、抗炎、抗氧化和抗肿瘤等药理作用[4-5]。目前,已开发出多种蒲公英产品,包括蒲公英根茶、蒲公英花茶、蒲公英挂面和蒲公英酵素等,市场需求量大[6]。蒲公英种质资源良莠不齐,其产量和质量难以稳定控制,因此,如何获得高品质的蒲公英新种质资源成为制约该产业发展的一个重要因子,利用生物技术改良蒲公英种质资源成为研究的热点之一[7]。
AP2/ERF(apetala2/ethylene responsive factor)转录因子家族成员能够响应多种生物和非生物胁迫,激活激素应答信号,从而参与调控植物的生长发育过程[8]。根据保守结构域的类型,AP2/ERF转录因子家族可分为4个亚家族:AP2(apetala2)、RAV(related to abscisic acid insensitive 3/viviparous 1)、ERF(ethylene responsive factor)和DREB(dehydration-responsive element binding protein)[9-11]。RAV转录因子含有N端的AP2结构域和C端的B3结构域[12],参与多种逆境胁迫。例如:在棉花(GossypiumhirsutumLinn.)中过表达拟南芥〔Arabidopsisthaliana(Linn.) Heynh.〕AtRAV1和AtRAV2能提高棉花的抗旱性,延迟开花时间并增加纤维长度[13];在拟南芥中过表达大豆〔Glycinemax(Linn.) Merr.〕GmRAV-03能够提高拟南芥的抗旱和耐盐能力,表现出对脱落酸(ABA)响应不敏感[14];在黄瓜(CucumissativusLinn.)中,CsRAV1响应脱落酸信号,从而提高黄瓜对盐胁迫的耐受性[15]。进一步研究发现,RAV转录因子还能参与植物对病原体的响应。例如:番茄(SolanumlycopersicumLinn.)SlRAV2受外源基因AtCBF1的调控,进而调控致病相关基因的表达,从而增强番茄对青枯雷尔氏菌(Ralstoniasolanacearum)感染的耐受性[16];木薯(ManihotesculentaCrantz)MeRAV1和MeRAV2通过调控褪黑素合成基因MeTDC2、MeT5H和MeASMT1的表达来提高木薯对细菌性枯萎病的抵抗能力,且MeRAV1、MeRAV2、MeRAV3、MeRAV4、MeRAV5、MeRAV6和MeRAV7能共同调节活性氧含量和下游抗病基因MebZIP5、MeNR2、MeIAA5和MeIAA17的表达,进而提高木薯的抗病能力[17-18]。水稻RAV在受到条纹病毒和黑条矮缩病毒侵染时其表达量显著变化[19]。
前期研究结果显示:脱落酸可以显著促进蒲公英次生代谢产物的积累,提高蒲公英的品质[20]。因此,本研究通过对脱落酸处理的蒲公英转录组数据进行分析,筛选出1个差异表达的RAV1基因,对该基因编码蛋白进行了氨基酸序列比对、系统进化关系、二级结构、三级结构以及亚细胞定位等分析,并分析该基因在蒲公英中的表达模式,验证其转录调控特性及蛋白互作的功能,以期为研究RAV转录因子参与蒲公英逆境胁迫的生物学功能提供依据。
1 材料和方法
1.1 材料
供试野生蒲公英植株和种子均采自南京中山植物园(东经118°49′48″、北纬32°03′00″,海拔106 m)。于3月至4月采集蒲公英全株,用蒸馏水清洗干净后分别取根、叶和花,液氮速冻后于-80 ℃保存,用于后续RNA提取。
于3月至4月采集蒲公英种子,于同年4月种植于有机质土壤(南京寿德生物科技有限公司)与蛭石(体积比1∶3)的混合基质中,种植15 d后,将蒲公英幼苗移栽至塑料盆(长10 cm、宽10 cm、高10 cm)中,每盆1株,然后置于人工培养箱(温度26 ℃、光照时间16 h·d-1)中培养60 d左右开始实验。共设置100 μmol·L-1脱落酸(ABA)、100 μmol·L-1茉莉酸甲酯(MeJA)、100 μmol·L-1赤霉素(GA)、100 μmol·L-1水杨酸(SA)和250 mmol·L-1NaCl 5个处理。选择长势基本一致的幼苗,每个处理用200 mL处理液将幼苗喷洒至叶湿润并灌根。分别于处理0、2、4、8和24 h采集叶,用液氮速冻后保存于-80 ℃冰箱,用于后续RNA提取。每个处理各处理时间取3株,作为3个生物学重复。
1.2 方法
1.2.1 总RNA提取、cDNA合成及基因克隆 取蒲公英新鲜叶片用液氮研磨,根据RNA提取试剂盒Eastep®Super Total RNA Extraction Kit (LS1040)〔普洛麦格(北京)生物技术有限公司〕的使用说明书提取蒲公英叶片的RNA,使用UniClone One Step Seamless Cloning Kit (SC612)(北京金沙生物科技有限公司)试剂反转录获得蒲公英cDNA。根据蒲公英RAV1的全长编码序列(CDS)设计特异性引物TmRAV1-F和TmRAV1-R(表1),以cDNA为模板利用高保真DNA聚合酶Phanta®Max Super-Fidelity DNA Polymerase (P505)(南京诺唯赞生物科技股份有限公司)进行扩增。扩增体系总体积25.0 μL,包括Phanta®Max Super-Fidelity DNA Polymerase 0.5 μL、2×Phanta Max Buffer 12.5 μL、dNTP Mix 1.0 μL、上游和下游引物各0.5 μL、cDNA 1.0 μL及ddH2O 9.0 μL。使用TC-E-48D基因扩增仪(杭州博日科技股份有限公司)进行PCR扩增。扩增程序:94 ℃预变性5 min;94 ℃变性30 s、54 ℃退火60 s、72 ℃延伸90 s,35个循环;72 ℃终延伸7 min。扩增产物使用质量体积分数1%琼脂糖凝胶进行电泳,使用SanPrep柱式DNA胶回收试剂盒(B518131)〔生工生物工程(上海)股份有限公司〕获得产物,将胶回收产物连接到TA克隆载体(C601-01)(南京诺唯赞生物科技股份有限公司)上,转化至大肠杆菌感受态DH5α(TSC-C01)(南京擎科生物科技有限公司),利用50 mg·mL-1卡那霉素进行筛选,获得阳性克隆,送至生工生物工程(上海)股份有限公司测序。

表1 用于蒲公英TmRAV1基因克隆和功能研究的引物相关信息
1.2.2 生物信息学分析 从NCBI网站(https:∥www.ncbi.nlm.nih.gov/)获得TmRAV1的同源序列,并进行保守结构域分析;在PlantTFDB网站(http:∥planttfdb.gao-lab.org/)下载拟南芥转录因子氨基酸序列;利用ProtParam在线工具(https:∥web.expasy.org/protparam/)分析蛋白质理化特性;利用Plant-mPLoc软件(http:∥www.csbio.sjtu.edu.cn/bioinf/plant-multi/)预测亚细胞定位;利用SignalP-6.0软件(https:∥services.healthtech.dtu.dk/service.php?SignalP-6.0/)分析信号肽;利用TMHMM2.0在线软件(https:∥services.healthtech.dtu.dk/services/TMHMM-2.0/)分析跨膜结构域;利用NetPhos-3.1网站(https:∥services.healthtech.dtu.dk/services/NetPhos-3.1/)预测磷酸化位点;分别利用在线软件SOPMA(https:∥npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa%20_sopma.html)和SWISS-MODEL(https:∥swissmodel.expasy.org/)分析二级结构和三级结构;利用GeneDoc软件进行同源序列比对分析;利用MEGA 7.0软件,采用邻接法绘制系统发育树,自展支持率(bootstrap value)为1 000。
1.2.3 实时荧光定量PCR(qRT-PCR) 根据TmRAV1的CDS序列设计荧光定量PCR引物qRT-TmRAV1-F和qRT-TmRAV1-R(表1),分别提取蒲公英不同组织和不同处理叶的总RNA,反转录获得cDNA。使用qRT-PCR酶GS AntiQ qPCR SYBR Green Master Mix(SQ412)(北京金沙生物科技有限公司)进行qRT-PCR分析。扩增体系总体积10.0 μL,包括SYBR 5.0 μL、cDNA 1.2 μL、上游和下游引物0.4 μL及RNAase-free ddH2O 3.0 μL。使用CFX-Opus 96荧光定量PCR仪(美国BIO-RAD公司)进行扩增。扩增程序:95 ℃预变性30 s;95 ℃变性10 s、58 ℃退火30 s、72 ℃延伸15 s,40个循环;在72 ℃采集信号。以β-Actin为内参基因,利用2-ΔΔCT计算相对表达量[21]。每个处理3个技术重复。
1.2.4 亚细胞定位分析 使用限制性内切酶XhoⅠ对pHellsgata8-GFP(35S:GFP)空质粒进行酶切,回收大片段。使用特异性引物pHellsgate-TmRAV1-F和pHellsgate-TmRAV1-R克隆获得TmRAV1编码序列,连接至pHellsgata8-GFP载体并转化至大肠杆菌感受态DH5α,使用载体上游引物35S-F和目的基因下游引物pHellsgata8-TmRAV1-R进行PCR验证,将验证成功的单菌落送交生工生物工程(上海)股份有限公司测序,测序成功的重组质粒pHellsgata8-TmRAV1-GFP通过农杆菌转化法转至根癌农杆菌感受态GV3101,挑取直径1~2 mm的农杆菌菌落进行PCR验证(载体下游引物35S-R和目的基因上游引物pHellsgata8-TmRAV1-F),验证成功的农杆菌在LB培养基中过夜培养至OD600值约0.8,于4 ℃、5 000 r·min-1离心3 min,去除上清液;使用重悬液〔含10 mmol·L-12-(N-吗啉代)乙烷磺酸(MES)、10 mmol·L-1MgCl2和0.2 mmol·L-1乙酰丁香酮〕进行重悬,使菌液OD600值约1.0,注射到本氏烟草(NicotianabenthamianaDomin)叶片背面进行瞬时表达,暗培养2~3 d后,使用LSM900激光共聚焦显微镜(德国Zeiss公司)观察结果。以注射含有pHellsgata8-GFP空质粒的农杆菌的叶片为对照,实验重复3次。
1.2.5 双荧光素酶(Dual-LUC)分析 根据蒲公英基因组(https:∥ngdc.cncb.ac.cn/search/)查找得到TmAREB1基因的启动子片段,利用primer5.0设计引物pGreen0800-TmAREB1-F和pGreen0800-TmAREB1-R,并按照“1.2.4”中载体构建的方法将proAREB1构建到pGreen0800(BamH Ⅰ酶切位点)载体上,得到pGreen0800-proTmAREB1重组质粒(用于驱动萤火虫荧光素酶报告基因),转至根癌农杆菌感受态GV3101;然后与含有pHellsgata8-TmRAV1-GFP重组质粒(用于驱动海肾荧光素酶报告基因)的农杆菌按照体积比1∶1共同注射于本氏烟草叶片背面。实验步骤参照“1.2.4”,暗培养2~3 d后,根据双荧光素酶试剂盒TransDetect®Double-Luciferase Reporter Assay Kit(AT321)(北京全式金生物技术股份有限公司)说明书对叶片进行处理,使用Tanon 5200 Multi全自动化学发光/荧光图像分析系统(上海天能生命科学有限公司)观察。将含有pHellsgata8-GFP空质粒与pGreen0800-proTmAREB1重组质粒的农杆菌按照体积比1∶1共同注射于本氏烟草叶片背面作为对照[21]。
1.2.6 酵母双杂交(Y2H)实验 在蒲公英基因组中,通过同源比对筛选获得脱落酸信号核心蛋白家族成员AtSnRK2.6的同源基因TmSnRK2.6。设计同源重组引物BD-TmSnRK2.6-F和BD-TmSnRK2.6-R将TmSnRK2.6连接到pGBKT7(EcoR Ⅰ酶切位点)载体上,同时设计引物AD-TmRAV1-F和AD-TmRAV1-R将TmRAV1构建到pGADT7(EcoR Ⅰ酶切位点)载体上,方法参照“1.2.4”。将构建好的pGADT7-TmRAV1和pGBKT7-TmSnRK2.6重组质粒共同转化至酵母菌感受态Y2H中,在SD/-Trp/-Leu培养基上生长3~5 d后转移至含X-α-gal的SD/-Ade/-His/-Trp/-Leu培养基上观察是否变蓝。pGADT7及pGBKT7空质粒共转化Y2H作为阴性对照。
1.2.7 双分子荧光互补(BiFC)分析 分别将TmRAV1和SnRK2.6构建到pXY104-cYFP(BamH Ⅰ酶切位点)和pXY106-nYFP(SalⅠ酶切位点)载体上,获得pXY104-TmRAV1-cYFP和pXY106-SnRK2.6-nYFP重组质粒,按照“1.2.4”中的方法转化至根癌农杆菌感受态GV3101,将含有pXY104-TmRAV1-cYFP和pXY106-SnRK2.6-nYFP重组质粒的农杆菌按照体积比1∶1混合后共同注射于本氏烟草叶片背面,暗培养2~3 d,使用LSM900激光共聚焦显微镜观察。cYFP和nYFP空质粒共同转化作为阴性对照。
2 结果和分析
2.1 TmRAV1基因克隆及蛋白质生物信息学分析
2.1.1 基因克隆及测序分析 以蒲公英叶片cDNA作为模板,使用特异性引物PCR扩增得到1条长度约1 000 bp的条带(图1),将胶回收片段连接转化后进行测序,测序结果与预期结果一致,TmRAV1开放阅读框(ORF)长度为1 026 bp,GC含量为47.95%,编码342个氨基酸(图2)。
M: DL2000 DNA marker; 1: TmRAV1.

图2 蒲公英TmRAV1的核苷酸序列及其编码的氨基酸序列
2.1.2 同源序列比对及系统发育树构建 蒲公英TmRAV1与其他植物RAV的氨基酸序列比对结果(图3)显示:蒲公英TmRAV1与其他植物的RAV具有高度保守的AP2和B3结构域以及核定位信号,且与莴苣(LactucasativaLinn.)LsRAV1(NCBI登录号XP_023746260.1)的同源性最高,一致性达85.88%。

Tm: 蒲公英Taraxacum mongolicum Hand.-Mazz.; Ls: 莴苣Lactuca sativa Linn. (XP_023746260.1); Cc: 朝鲜蓟Cynara cardunculus var. scolymus (Linn.) Benth. (XP_024988000.1); Ha: 向日葵Helianthus annuus Linn. (XP_022020644.1); Tc: 除虫菊Tanacetum cinerariifolium (Treviranus) Schultz Bipontinus (GEW18075.1); At: 拟南芥Arabidopsis thaliana (Linn.) Heynh. (AT1G13260). 括号中编号为NCBI登录号Nos. in the brackets are accession numbers in NCBI. AP2,B3: DNA保守结构域 DNA conserved domain; NLS: 核定位信号Nuclear localization signal.
将TmRAV1与莴苣等4个物种的RAV以及拟南芥AP2、ERF和RAV亚家族进行系统发育树的构建,结果(图4)显示:蒲公英TmRAV1与莴苣LsRAV1、朝鲜蓟〔Cynaracardunculusvar.scolymus(Linn.) Benth.〕CcRAV1、向日葵(HelianthusannuusLinn.)HaRAV1和除虫菊〔Tanacetumcinerariifolium(Treviranus) Schultz Bipontinus〕TcRAV1先聚在一起,再与拟南芥RAV亚家族聚为一支。
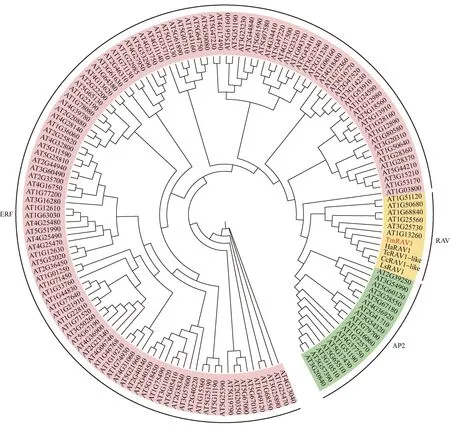
Tm: 蒲公英Taraxacum mongolicum Hand.-Mazz.; Ls: 莴苣Lactuca sativa Linn. (XP_023746260.1); Cc: 朝鲜蓟Cynara cardunculus var. scolymus (Linn.) Benth. (XP_024988000.1); Ha: 向日葵Helianthus annuus Linn. (XP_022020644.1); Tc: 除虫菊Tanacetum cinerariifolium (Treviranus) Schultz Bipontinus (GEW18075.1). 括号编号为NCBI登录号Nos. in the brackets are accession numbers in NCBI. 以“AT”开头的编号均为拟南芥中蛋白质的NCBI登录号Nos. starting with “AT” are all NCBI accession numbers of proteins in Arabidopsis thaliana (Linn.) Heynh.
2.1.3 蛋白质理化性质及结构分析 蒲公英TmRAV1的分子式为C1678H2654N486O517S10,理论相对分子质量为38 229,理论等电点为pI 9.20。TmRAV1中带正电荷和负电荷的氨基酸残基分别为49和40个。TmRAV1的不稳定指数为46.45,为不稳定蛋白;脂肪指数为66.93;总平均亲水指数(GRAVY)为-0.692,是亲水性蛋白。Plant-mPLoc预测结果显示TmRAV1是核定位转录因子。TmRAV1上没有跨膜结构域,也没有信号肽(图5-A,B)。TmRAV1上有44个磷酸化位点,其中丝氨酸23个,苏氨酸17个,络氨酸4个(图5-C)。二级结构预测结果显示:TmRAV1中含有27.49%α螺旋、7.31%β折叠、18.71%β转角和46.49%无规卷曲(图5-D)。以氨基酸相似性为77.27%的拟南芥AtRAV1(1wid.1.A)为模板分子构建TmRAV1的三级结构,预测结果(图5-E)显示:TmRAV1的三级结构也由α螺旋、β折叠、β转角和无规卷曲构成,与其二级结构预测结果一致。
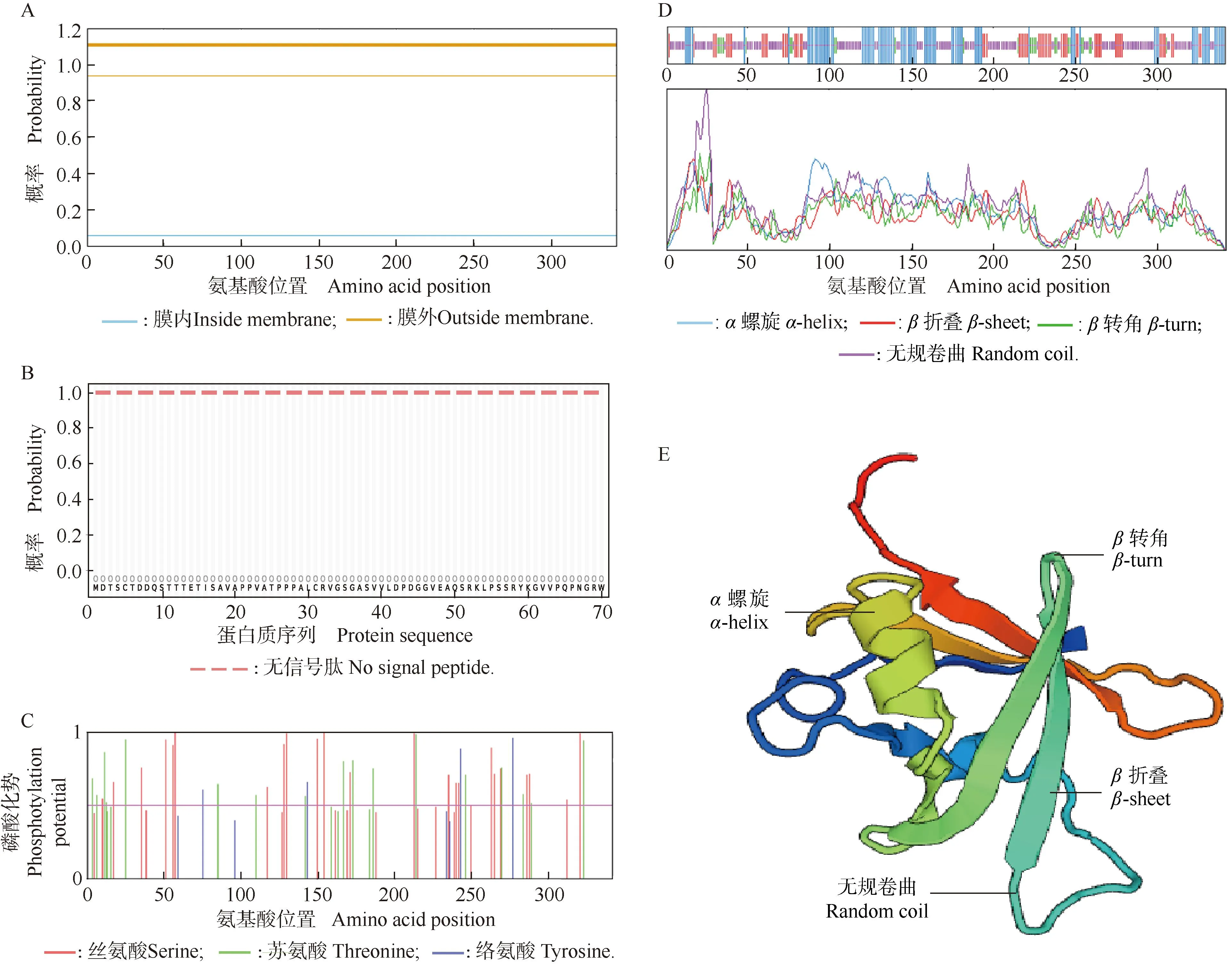
A: 跨膜结构域预测Prediction of transmembrane domain; B: 信号肽预测Prediction of signal peptide; C: 磷酸化位点预测Prediction of phosphorylation site; D: 二级结构预测Prediction of secondary structure; E: 三级结构预测Prediction of tertiary structure.
2.2 TmRAV1表达分析
蒲公英TmRAV1在不同组织和不同处理叶中的表达模式见图6。结果显示:蒲公英不同组织中TmRAV1的相对表达量由高到低依次为叶、花、根,且不同组织间差异达到显著(P<0.05)水平。在100 μmol·L-1脱落酸处理下,TmRAV1的相对表达量随着处理时间的延长整体呈先升高后降低的变化趋势,在处理2~8 h较高。在100 μmol·L-1茉莉酸甲酯处理下,TmRAV1的相对表达量随着处理时间的延长呈“升高—降低—升高”的变化趋势,在处理2 和8 h分别显著高于和低于其他处理时间。在100 μmol·L-1赤霉素处理下,TmRAV1的相对表达量随着处理时间的延长呈先升高后降低的变化趋势,在处理4 h达到最高。在100 μmol·L-1水杨酸处理下,TmRAV1的相对表达量随着处理时间的延长呈先升高后降低的变化趋势,在处理2 h达到最高。在250 mmol·L-1NaCl处理下,TmRAV1的相对表达量在处理24 h内呈逐渐升高的趋势。
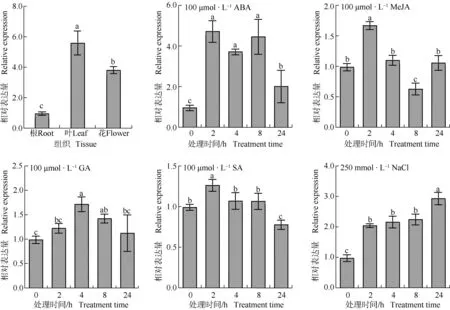
ABA: 脱落酸Abscisic acid; MeJA: 茉莉酸甲酯Methyl jasmonate; GA: 赤霉素Gibberellin; SA: 水杨酸Salicylic acid. 同一图中不同小写字母表示差异显著(P<0.05) Different lowercases in the same graph indicate the significant (P<0.05) differences.
2.3 TmRAV1亚细胞定位分析
蒲公英TmRAV1的亚细胞定位结果(图7)显示:对照组35S:GFP细胞膜和细胞核上有绿色荧光,而TmRAV1仅在细胞核中有荧光,说明TmRAV1定位于细胞核中。
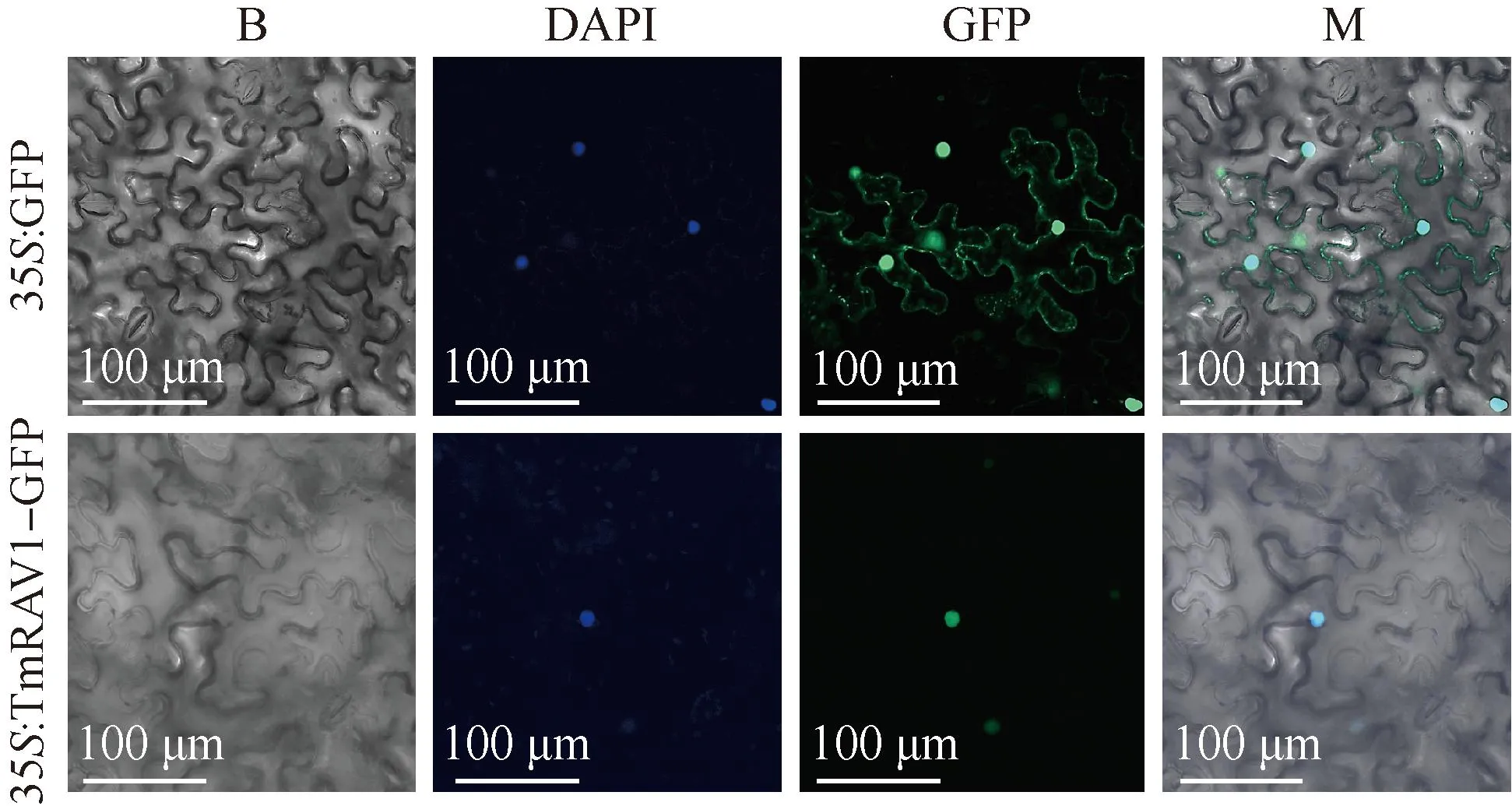
B: 明场Bright; DAPI: 4′,6-二脒基-2-苯基吲哚4′,6-diamidino-2-phenylindole; GFP: 绿色荧光蛋白Green fluorescent protein; M: 叠加视野Merged field.
2.4 TmAREB1启动子分析及TmRAV1双荧光素酶分析
蒲公英TmAREB1启动子含有多个顺式作用原件,其中包括2个TGTTG-motif、2个CAACA-motif、1个W-box、1个ABRE、1个G-box和1个TGACG-motif(图8)。
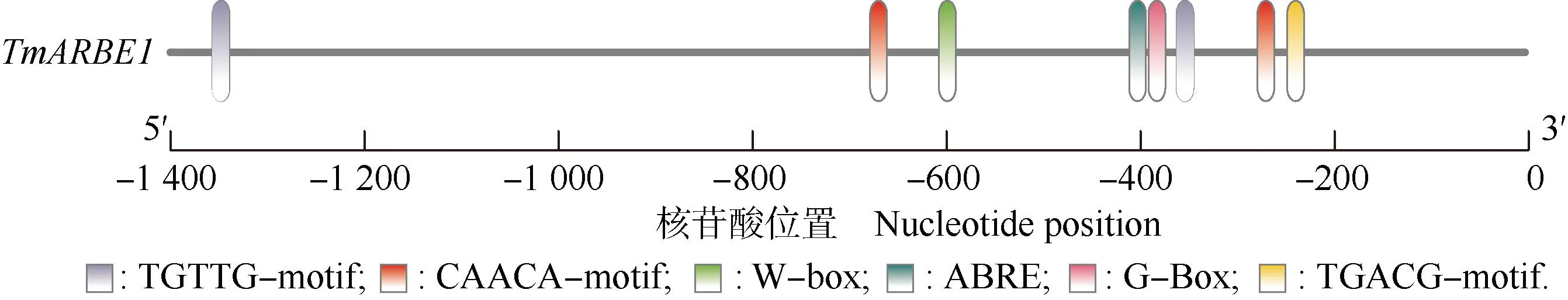
图8 蒲公英TmAREB1启动子分析结果
双荧光素酶分析结果(图9)显示:实验组(含有35S:TmRAV1-GFP与pGreen0800-proTmAREB1的农杆菌共同注射本氏烟草)的荧光素酶活性是对照组(含有35S:GFP空质粒与pGreen0800-proTmAREB1的农杆菌共同注射本氏烟草)的4.82倍,二者间存在显著(P<0.05)差异,说明TmRAV1能够显著上调TmAREB1的表达。
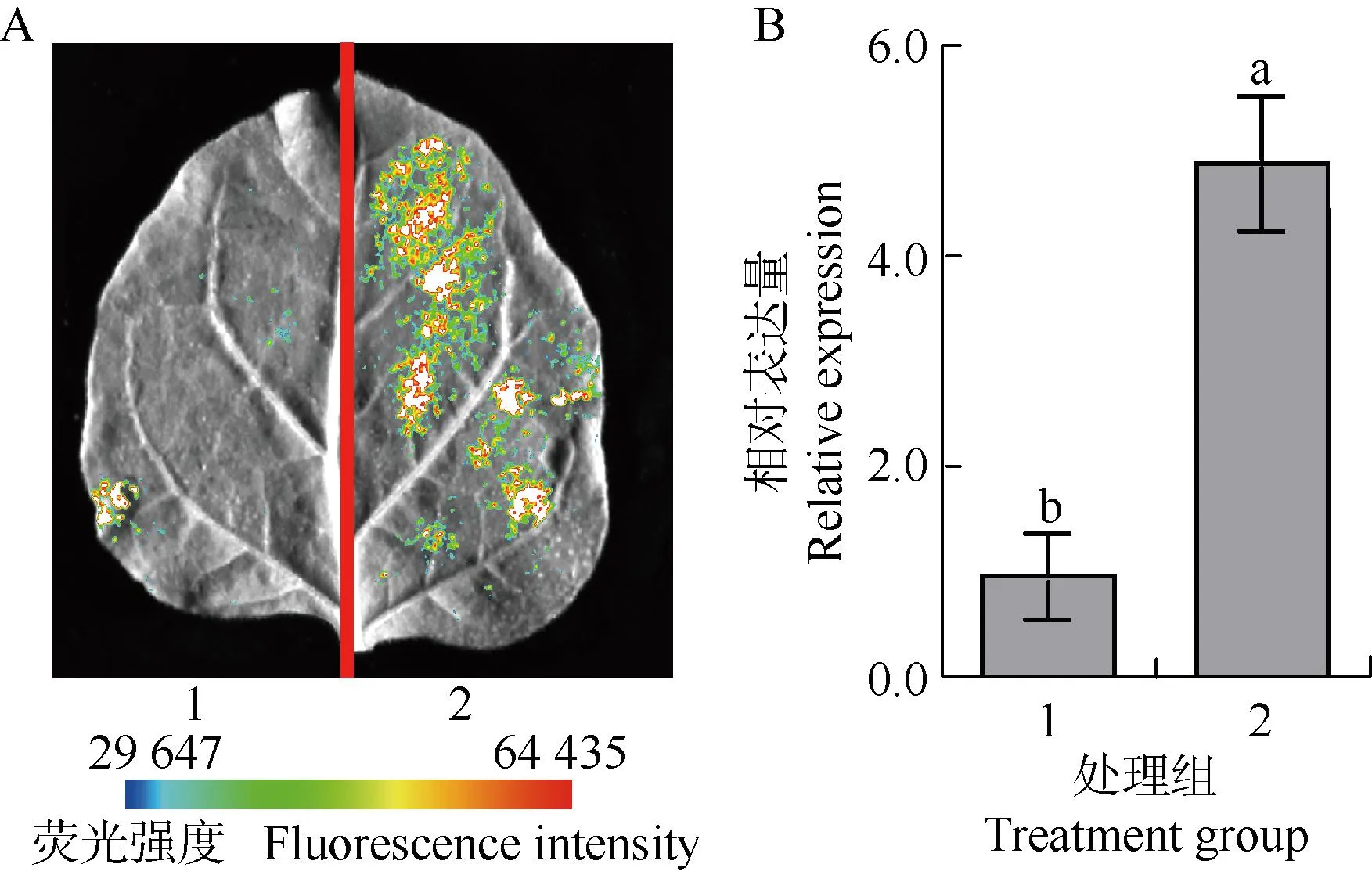
1: 对照组The control group; 2: 实验组Experimental group. 图B中不同小写字母表示差异显著(P<0.05) Different lowercases in the graph B indicate the significant (P<0.05) differences.
2.5 TmRAV1酵母双杂交分析
将蒲公英的脱落酸信号核心蛋白家族成员TmSnRK2.6与TmRAV1进行酵母双杂交分析,结果(图10)显示:TmRAV1与TmSnRK2.6能够在酵母体内互作。
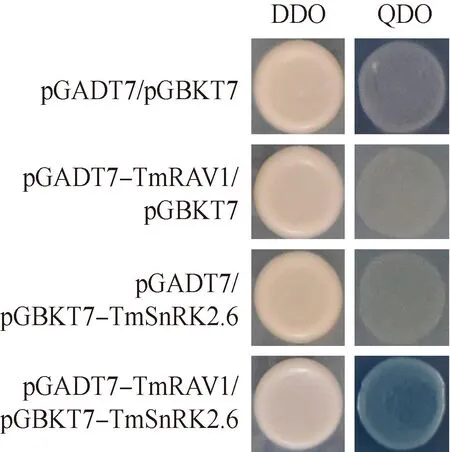
DDO: SD/-Trp/-Leu培养基SD/-Trp/-Leu medium; QDO: SD/-Ade/-His/-Trp/-Leu培养基(含X-α-gal)SD/-Ade/-His/-Trp/-Leu medium (containing X-α-gal).
2.6 TmRAV1双分子荧光互补分析
双分子荧光互补分析结果(图11)显示:将含有TmRAV1-cYFP和TmSnRK2.6-nYFP的农杆菌共同注射本氏烟草叶片时能够看到黄色荧光蛋白(YFP)荧光信号,但是cYFP和nYFP共同转化(阴性对照)中没有荧光信号,说明TmRAV1能够与TmSnRK2.6在本氏烟草体内形成异源二聚体。
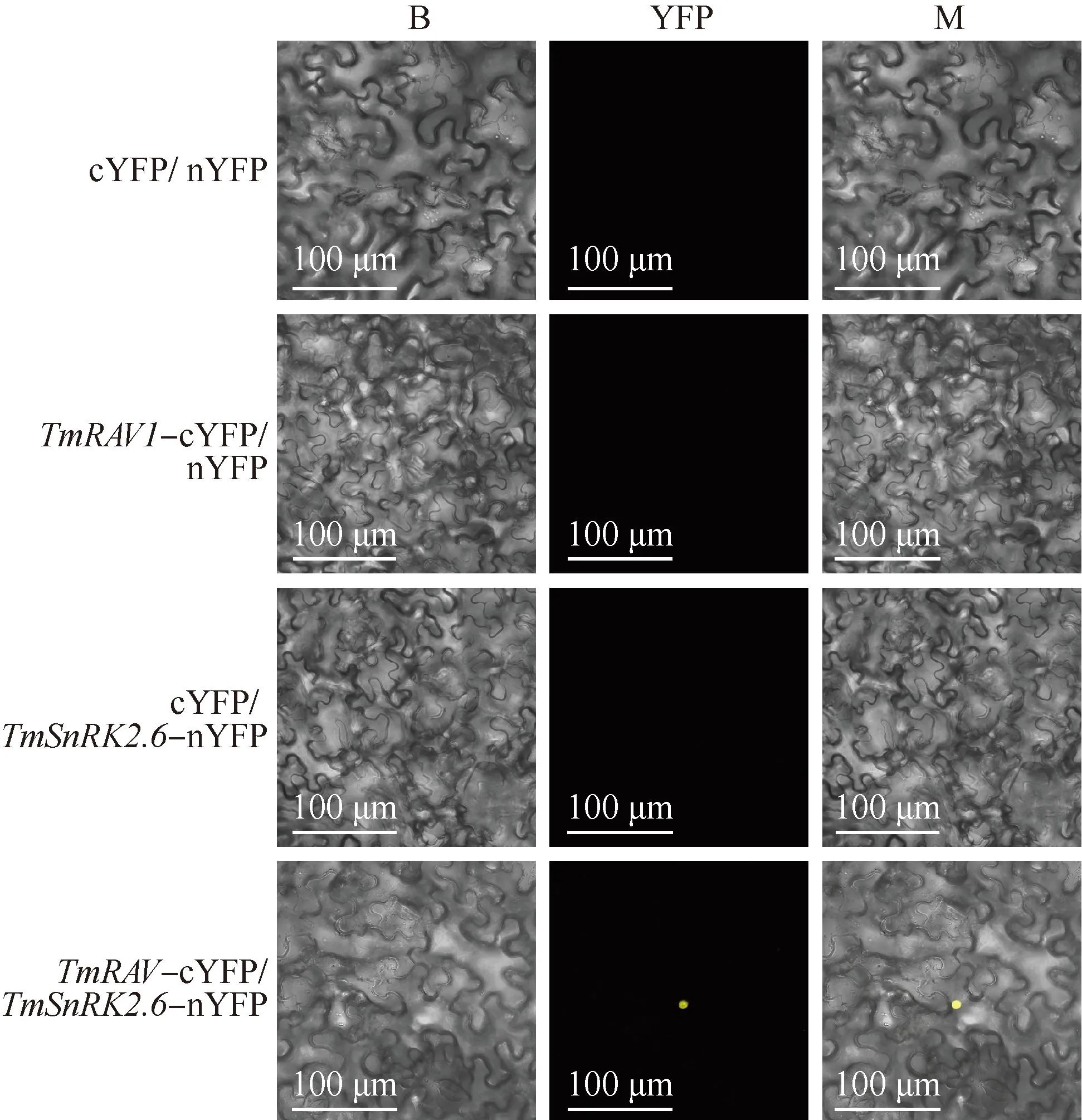
B: 明场Bright; YFP: 黄色荧光蛋白Yellow fluorescent protein; M: 叠加视野Merged field.
3 讨论和结论
AP2/ERF超家族成员RAV转录因子是植物中特有的一类转录因子,主要参与植物的生长发育及其非生物胁迫响应过程,已经在多种植物中有相关报道,如水稻(OryzasativaLinn.)、小黑杨(Populus×xiaoheiT. S. Hwang et Liang)、御谷〔Pennisetumglaucum(Linn.) R. Brown〕、枇杷〔Eriobotryajaponica(Thunb.) Lindl.〕、甘蔗(SaccharumofficinarumLinn.)等[11,22-25]。本研究从蒲公英中克隆得到1个RAV转录因子基因TmRAV1,TmRAV1与莴苣LsRAV1氨基酸序列的一致性达到85.88%,属于RAV亚家族。TmRAV1有44个磷酸化位点,因此可能被SnRK2等蛋白激酶磷酸化[26]。亚细胞定位结果显示TmRAV1定位于细胞核,这与转录因子在细胞核中发挥的作用一致,且与先前的预测结果相同。TmRAV1具有N端AP2结构域和C端B3结构域,与已有研究报道[27]一致,因此TmRAV1可能与AGCCGCC(GCC-box)、CAACA-motif和CACCTG序列结合[17,28]。
RAV参与调节激素、干旱和盐胁迫反应[29-30]。qRT-PCR结果表明蒲公英叶中的TmRAV1受多种激素和NaCl胁迫诱导。TmRAV1受100 μmol·L-1脱落酸的显著调控,其相对表达量在处理24 h内整体先升高后降低,在处理2~8 h较高,说明TmRAV1可能参与脱落酸信号通路。在250 mmol·L-1NaCl处理下,TmRAV1的相对表达量在处理24 h内持续升高,说明TmRAV1能够持续响应NaCl胁迫,后续实验需要降低NaCl溶液的浓度或者延长处理时间至3~5 d[15,31]。在100 μmol·L-1茉莉酸甲酯处理下,TmRAV1的相对表达量在处理0~8 h先升高后降低并在处理2 h达到峰值,而在处理24 h又再次升高,可能涉及茉莉酸信号负调控作用机制[32-33]。在100 μmol·L-1赤霉素处理下,TmRAV1的相对表达量在处理24 h内也先升高后降低,显示TmRAV1可能参与赤霉素信号通路。在水稻中水杨酸处理上调了OsRAV1、OsRAV3、OsRAV4、OsRAV7、OsRAV8、OsRAV11、OsRAV12和OsRAV13的表达,下调了OsRAV9、OsRAV14和OsRAV15的表达[19]。本研究中TmRAV1在100 μmol·L-1水杨酸处理下表达模式与100 μmol·L-1赤霉素处理相似。根据上述研究结果,TmRAV1受脱落酸调控最为显著,因而可能参与脱落酸信号转导。脱落酸信号是植物抵御环境胁迫的重要组成部分[34],因此,后续研究应聚焦于脱落酸对TmRAV1的调控机制。
脱落酸应答元件结合蛋白(AREB)是脱落酸敏感型转录因子。在拟南芥中,AtAREB1能够介导ABRE依赖性脱落酸信号转导,从而增强拟南芥的抗旱性[35]。丹参(SalviamiltiorrhizaBunge)中的SmAREB1能够响应脱落酸信号,调控酚酸合成[36]。在番茄中过表达SlAREB1能够提高植株在盐碱胁迫下的抗氧化能力[37]。因此,AREB转录因子参与植物抵抗逆境胁迫,并调控植物次生代谢。在拟南芥中,AtRAV1抑制AtABI5的表达,进而促进种子萌发和幼苗发育[38]。在棉花中过表达AtRAV1/2和AtABI5能够增强棉花的抗旱能力,并最终提高产量[39]。TmAREB1与已报道的莴苣LsABI5同源性较高,可能存在TmRAV1-TmAREB1调控模式[20]。本研究初步证明TmRAV1促进TmAREB1表达,且proTmAREB1启动子上含有CAACA-motif(RAV1转录因子结合元件),后续将通过酵母单杂交和电泳迁移率实验验证TmRAV1是否直接靶向结合CAACA-motif。
SnRK2蛋白激酶是脱落酸信号通路中的关键蛋白质家族之一[40]。在拟南芥中,AtSnRK2能够调控其种子的发育和休眠[41],其中,AtSnRK2.2、AtSnRK2.3和AtSnRK2.6还能够通过响应脱落酸信号调控气孔关闭,适应干旱环境[42]。苹果(MaluspumilaMill.)中的MdSnRK2.4和MdSnRK2.9参与渗透胁迫响应,被激活并进而磷酸化MdHB1和MdACO1,促进乙烯合成,从而调控果实成熟[43]。拟南芥中的AtSnRK2能够磷酸化AtABI5[41]、AtAREB3[44]和AtRAV1[29]等转录因子,参与脱落酸信号通路下游的信号转导。本研究通过酵母双杂交和双分子荧光互补实验初步验证了TmRAV1与脱落酸信号途径核心蛋白家族成员TmSnRK2.6互作,后续将通过Pull-down和CoIP实验验证TmRAV1和TmSnRK2.6是否直接互作。
基于上述研究,后期将通过获得TmRAV1转基因蒲公英进一步验证TmRAV1在脱落酸信号途径中的具体作用机制,为蒲公英优质资源创新提供基础。

