鱼鳔与驴皮的化学成分及对环磷酰胺所致贫血小鼠的改善作用
孙皓岩,胡淑曼,魏宝红,,马晓青,,杨文哲,刘 佳,杨 雪,,,邱培菊,
(1.中国海洋大学海洋药物教育部重点实验室,医药学院,山东青岛 266003;2.青岛海洋生物医药研究院,山东青岛 266071)
贫血是临床中常见的疾病之一,患者通常表现为头晕、乏力、困倦、面色苍白,由于贫血发病周期长,发展缓慢,常常不为人们察觉,这种疾病影响着世界上四分之一以上的人口并且发病人群广[1],对人们的生活质量造成一定的影响。在中医学中贫血属于“血虚”“血枯”的范畴,多与气血不足,脏腑失养相关[2],自古针对补血药材多有记载,其中不乏各种动物胶类如驴皮胶、牛皮胶、龟甲胶等[3-4],深受人们喜爱。
我国是海洋大国,海洋生物资源丰富,随着近年对海洋资源的开发愈加重视,许多海产品受到消费者的关注,其中海洋胶类逐渐进入大家的视野。鱼鳔药用历史悠久,味甘、咸,性平,归肾、肝、脾、胃经,具有滋补肝肾,补精益阳,补气养血,活血止血,解毒敛疮等功效[5],其与燕窝、鱼翅齐名,为“海洋八珍之一”,素有“海洋人参”之美誉,是一味海洋滋补上品[6-7]。鱼鳔不仅含有丰富的蛋白质、少量的脂肪和糖类物质,还含有丰富的无机元素、维生素等[8-10]。目前,已上市的鱼鳔产品如鱼鳔补肾丸、固本延龄丸等中成药,多以补肾固精功效为主。当前鱼鳔主流产品为药用典籍中记载的黄鱼鳔,及非药用典籍的鳘鱼鳔和鳕鱼鳔,前期课题组比较了上述3 种鱼鳔提取制备的鱼鳔胶对环磷酰胺所致贫血小鼠的改善作用,发现三种基原的鱼鳔胶对环磷酰胺所致贫血小鼠的红细胞、血红蛋白、血小板、网织红细胞等血液学指标及胸腺、脾脏系数均有不同程度的改善作用,其中鳘鱼鳔胶改善效果最佳。
作为海洋胶类代表的鱼鳔,现多是对其营养价值的研究,尚未有关鱼鳔系统的化学成分及药效物质基础的研究。因此,本文对鳘鱼鳔的总蛋白、氨基酸组成及胶原蛋白等化学成分进行了研究,评价了其对贫血小鼠的血液学指标及脏器系数的改善作用,并与陆地代表胶类驴皮胶进行比较。通过本文研究,以期为后续阐明鱼鳔药效物质基础及开发具有海洋特色的鱼鳔补血类产品奠定基础。
1 材料与方法
1.1 材料与仪器
鳘鱼鳔 产地山东省青岛市;驴皮 产地山东省聊城市;胃蛋白酶(酶活力≥400 U/mg)、浓缩胶(5%)、分离胶(8%)北京索莱宝科技有限公司;人I 型胶原蛋白(COLI)ELISA 试剂盒 美国Peprotech 公司;氨基酸混合标准品 和光纯药工业株式会社;溴化钾(KBr)光谱纯,Sigma 公司;葡聚糖系列标准品(相对分子质量分别为180、2700、5250、9750、13050、36800、64650、135350 Da)中国食品药品检定研究院;环磷酰胺 江苏恒瑞医药股份有限公司;无水乙醇、硫酸、硫酸铜、硫酸钾、硼酸、甲基红、溴甲酚绿、盐酸、氯化钠、氢氧化钠、三氯乙酸、乙二胺四乙酸二钠(EDTA)、冰醋酸、考马斯亮蓝、甲醇、柠檬酸钠 分析纯,国药集团化学试剂有限公司;RBC、HGB、PLT、RET 血液学测试试剂包 济南希森美康医用电子有限公司;SPF 级昆明小鼠 济南朋悦实验动物繁育有限公司,40 只,体重18~22 g,雄性,生产许可证号:SCXK(鲁)2019-0003。
K9840 凯氏定氮仪 济南海能仪器股份有限公司;MS 105DU 型电子天平 上海梅特勒-托利多公司;SCIENTZ-18N 冻干机 宁波新芝生物科技股份有限公司;LA8080 型氨基酸自动分析仪 日本株式会社日立高新技术科技;FA-1004 电子天平 上海舜宇恒平科学仪器有限公司;BR4I 型离心机、Nicolet iS5 傅里叶红外变换光谱仪 美国Thermo Fisher Scientific;UV-6000PC 紫外分光光度计 上海元析仪器有限公司;DF-68 15T 型粉末压片机 武汉鼎福汇聚科技有限公司;Chirascan q CD 圆二色谱仪 英国Applied PhotoPhysics 公司;Aglient 1260 Ⅱ型高效液相色谱仪 美国安捷伦科技有限公司;VORTEX GENIUS 型涡旋混合器 德国IKA 公司;H1650-W型台式高速离心机 湖南湘仪实验室仪器开发有限公司。
1.2 实验方法
1.2.1 鱼鳔、驴皮总蛋白分析 参照GB 5009.5-2016《食品安全国家标准 食品中蛋白质的测定》第一法凯氏定氮法[11]测定鱼鳔、驴皮中总蛋白含量。
1.2.2 鱼鳔、驴皮氨基酸组成分析 参照GB 5009.124-2016《食品安全国家标准 食品中氨基酸的测定》方法[12]分别对鱼鳔、驴皮的氨基酸组成进行分析。
1.2.3 鱼鳔胶、驴皮胶分子量分析
1.2.3.1 鱼鳔胶、驴皮胶提取制备 分别称取适量鱼鳔、驴皮,剪成小块,加30 倍量水回流提取4 d,提取液4000 r/min 离心10 min,取上清液,减压浓缩后冷冻干燥,获得鱼鳔胶、驴皮胶干膏。
1.2.3.2 鱼鳔胶、驴皮胶分子量分布考察 采用凝胶色谱法[13]测定鱼鳔胶、驴皮胶分子量范围:分别称取系列葡聚糖标准品、鱼鳔胶、驴皮胶干膏适量,精密称定,加0.1 mol/L 的Na2SO4溶液溶解,配制成5 mg/mL 的溶液,用0.22 µm 水相微孔滤膜过滤,得对照品溶液及鱼鳔胶和驴皮胶供试品溶液。精密吸取上述对照品溶液及供试品溶液各20 µL 液相分析,采用TSKgel GMPWXL(4.6×250 mm,5 μm)色谱柱,以0.1 mol/L 的Na2SO4溶液为流动相,流速0.5 mL/min,柱温35 ℃,示差检测器(RID)检测。以保留时间为横坐标(X),分子量对数为纵坐标(Y)绘制标准曲线,得回归方程:Y=-0.51X+12.95,R2=0.9937,计算鱼鳔胶、驴皮胶峰位分子量及分子量分布。
1.2.4 鱼鳔、驴皮胶原蛋白分析
1.2.4.1 鱼鳔、驴皮胶原蛋白提取制备 参考文献[14]的方法分别称取鱼鳔、驴皮各20 g,剪碎加蒸馏水泡发,按质量比1:30 加入预冷的0.1 mol/L NaOH处理48 h,用来去除非胶原成分,再用冰水冲洗至中性。加入30 倍体积预冷的pH7.4 的0.5 mol/L EDTA 处理48 h,用来去除矿物质,用冰水冲洗至中性;25000 r/min 匀浆10 min 后,将其混悬于150 倍体积含0.1 g/100 mL 胃蛋白酶的0.5 mol/L 冰醋酸中,搅拌提取48 h。提取液10000 r/min 离心30 min,上清液迅速用6 mol/L NaOH 调节pH7.5,边搅拌边向其缓慢加入磨细的NaCl 粉末,至NaCl 终浓度为2.6 mol/L,待NaCl 全部溶解,静置过夜,10000 r/min离心30 min,沉淀加适量0.5 mol/L 的冰醋酸复溶,10000 r/min 离心30 min,取上清液透析(MD31:0.1~0.5 kDa)除盐,先用0.1 mol/L 的冰醋酸透析过夜,换去离子水透析72 h,期间换水数次,获得的透析液转至冻干盘,冷冻干燥,分别获得鱼鳔、驴皮胶原蛋白。
1.2.4.2 鱼鳔、驴皮胶原蛋白含量测定 采用人I 型胶原蛋白(COLI)ELISA 试剂盒测定鱼鳔、驴皮胶原蛋白含量。称取鱼鳔、驴皮胶原蛋白配制成质量浓度10 mg/mL 的胶原溶液,上样前稀释100 倍。收集细胞培养液的上清液进行COLI 的ELISA 检测,将阴性对照组及待检测样品(每个样品各3 组平行)加入96 孔板,每孔100 μL。绘制标准曲线并在450 nm波长下观察标准品及鱼鳔、驴皮胶原蛋白样品的吸光度,计算Ⅰ型胶原蛋白的浓度。
1.2.4.3 鱼鳔、驴皮胶原蛋白氨基酸组成分析 同1.2.2。
1.2.4.4 鱼鳔、驴皮胶原蛋白SDS-PAGE 电泳 参考Laemmli[15]的方法,分别称取鱼鳔、驴皮胶原蛋白适量,精密称定,加0.5 mol/L 乙酸溶解,配制成质量浓度为1 mg/mL 的胶原溶液,用6 mol/L NaOH 中和至pH7.0,10000 r/min 4 ℃离心30 min,取30 μL上清液,加10 μL 4%上样缓冲液(含β-巯基乙醇),混匀后,煮沸5 min,冷却后再次离心,取10 μL 上样进行SDS-PAGE 电泳。聚丙烯酰胺凝胶由5%浓缩胶(pH6.8),8%分离胶(pH8.8)组成。电泳结束后将胶条置于三氯乙酸溶液中固定15 min,染色1 h(染色液为0.1%考马斯亮蓝R-250-甲醇-冰醋酸,体积比9:9:2),随后脱色(脱色液为冰醋酸-甲醇-水,体积比1:1:8)至胶条上的条带清晰可见即可。
1.2.4.5 鱼鳔、驴皮胶原蛋白紫外全波长扫描分析分别称取鱼鳔、驴皮胶原蛋白适量,精密称定,加0.5 mol/L 乙酸溶解,配制成2 mg/mL 的胶原溶液,于4 ℃下10000 r/min 离心30 min,取上清液作为供试品溶液,以0.5 mol/L 乙酸溶液为空白对照,用紫外分光光度计在200~400 nm 范围内进行紫外扫描。
1.2.4.6 鱼鳔、驴皮胶原蛋白傅里叶变换红外光谱分析 分别称取鱼鳔、驴皮胶原蛋白适量,与光谱纯KBr 混合放在玛瑙研钵中研磨成细粉。取适量混合样品至压片机中压片,将样品置于样品室。用傅里叶变换红外光谱仪对样品在400~4000 cm-1区间内扫描,分辨率设置为2 cm-1。
1.2.4.7 鱼鳔、驴皮胶原蛋白圆二色谱分析 分别称取鱼鳔、驴皮胶原蛋白适量,精密称定,加0.5 mol/L乙酸溶解,配制成2 mg/mL 的胶原溶液,于4 ℃下10000 r/min 离心30 min,取上清液作为供试品溶液,以0.5 mol/L 乙酸溶液为空白对照,采用圆二色谱仪于10 ℃进行光谱扫描,比色光程为1 mm,带宽0.5 nm,扫描波长范围为190~260 nm。
1.2.5 鱼鳔胶、驴皮胶对环磷酰胺所致贫血小鼠的改善作用
1.2.5.1 造模及给药方案 依据小鼠体重随机进行分组,分为正常对照组(n=10)和环磷酰胺处理组(n=30)。对环磷酰胺处理组连续4 d 腹腔注射80 mg/kg 环磷酰胺,造贫血模型,正常组腹腔注射等量的生理盐水。造模完成后,环磷酰胺处理组依据小鼠体重随机分为3 组,分别为模型组,鱼鳔胶和驴皮胶给药组[根据人用生药剂量10 g/(60 kg·d),换算成小鼠给药剂量为鱼鳔胶1.52 g/(kg·d)、驴皮胶1.39 g/(kg·d)]。鱼鳔胶、驴皮胶给药组灌胃给药,每天1 次,共给药28 d。正常对照组和模型组给予相同体积的纯水。
1.2.5.2 指标检测 实验期间每周称量一次小鼠体重。给药结束后进行眼球后静脉丛取血,全自动模块式血液体液分析仪分析外周血红细胞(RBC)、血红蛋白(HGB)、血小板(PLT)、网织红细胞(RET)等血液学指标。颈椎脱臼处死小鼠(动物伦理审批号:YTU22WT-P06)解剖取出脾脏和胸腺,剥离周围脂肪组织、结缔组织,并用滤纸吸去其表面附着的血液,使用精密电子天平称取脾脏和胸腺的质量,按照下列公式计算脾脏和胸腺系数:脏器系数(%)=脏器质量/体重×100。
1.3 数据处理
实验结果用均值±标准差表示,采用SPSS 21.0 统计软件进行t检验及方差分析。P<0.05 代表差异具有统计学意义,P<0.01 代表差异极显著,采用GraphPad Prism 8.0 进行图形绘制。
2 结果与分析
2.1 鱼鳔、驴皮总蛋白分析结果
蛋白质是人体重要的组成部分,是生命的重要物质基础。胶类物质含有丰富的蛋白质,因此具有较高的营养价值,根据测定结果显示鱼鳔、驴皮总蛋白含量分别为98.00%±0.19%和97.60%±0.21%。
2.2 鱼鳔、驴皮氨基酸组成分析结果
鱼鳔、驴皮均含有17 种氨基酸,其总量分别为79.97 g/100 g 和77.07 g/100 g(见表1)。鱼鳔和驴皮氨基酸组成相似,含有的苏氨酸、缬氨酸、蛋氨酸、异亮氨酸、亮氨酸、苯丙氨酸、赖氨酸7 种必需氨基酸含量占总氨基酸含量的比例分别为17.53%和17.44%,与文献报道中鱼鳔[8]和驴皮[16]的总氨基酸含量和必需氨基酸占比基本一致。而且,二者均以甘氨酸含量最高,谷氨酸、丙氨酸、精氨酸、脯氨酸含量也相对较高。据报道,甘氨酸是血红素合成底物之一,有很好的造血功能[17-18];谷氨酸能够提高机体免疫功能[19-20];丙氨酸通过参与白细胞的代谢影响免疫功能[20];精氨酸具有免疫调节作用,也能够促进生育、生长发育及创伤愈合[21];脯氨酸对保护免疫系统细胞有一定的作用[20]。在鱼鳔和驴皮中,甘氨酸含量分别为20.60、19.70 g/100 g,谷氨酸含量分别为8.85、8.86 g/100 g,丙氨酸含量分别为10.10、7.66 g/100 g,精氨酸含量分别为7.44、6.73 g/100 g,脯氨酸含量分别为9.91、11.10 g/100 g,5 种氨基酸总含量达54.00 g/100 g 以上。除以上氨基酸外,其他少量氨基酸如天冬氨酸、丝氨酸等能通过不同的途径发挥着调节机体免疫力的作用[20],由此推测鱼鳔和驴皮可能具有补血和增强免疫的功能。
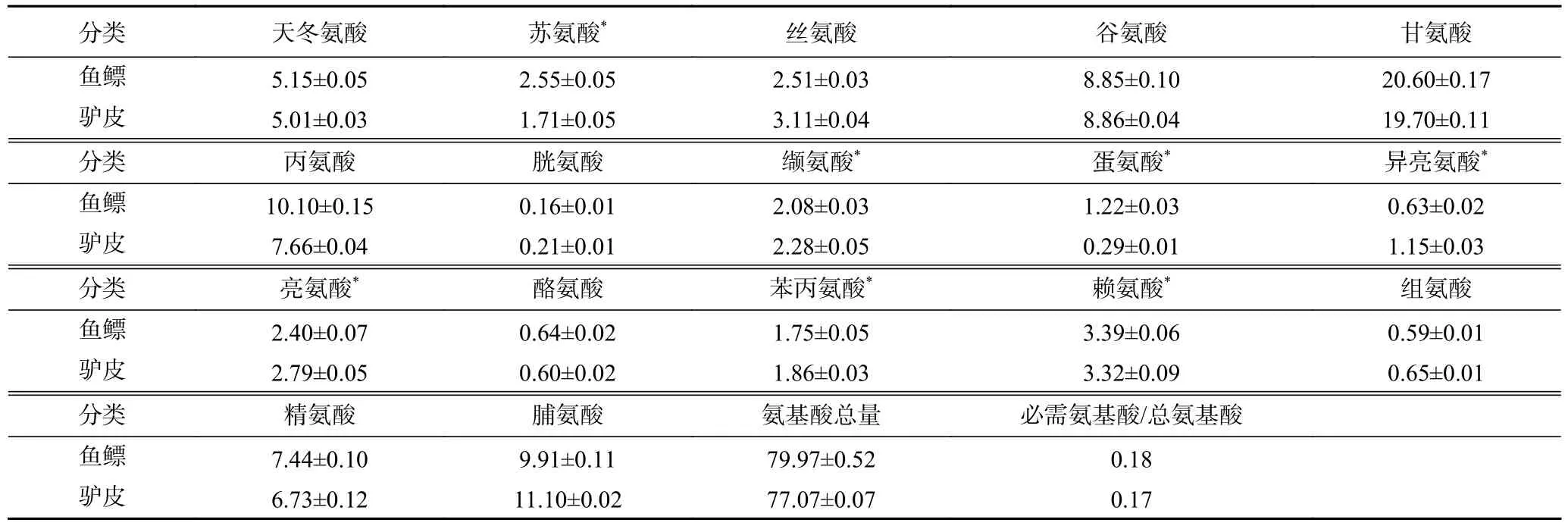
表1 鱼鳔、驴皮的氨基酸组成(g/100 g)Table 1 Amino acid composition of swim bladder and donkey skin (g/100 g)
2.3 鱼鳔胶、驴皮胶分子量分布考察结果
分子量分布考察结果如图1 和表2,显示鱼鳔胶分子量范围在50 Da~205 kDa 之间,峰位分子量约为12 kDa;驴皮胶分子量范围在50 Da~328 kDa 之间,峰位分子量约为14 kDa;鱼鳔胶峰位分子量及分子量范围均小于驴皮胶,推测鱼鳔胶可能比驴皮胶容易被机体吸收。

表2 鱼鳔胶、驴皮胶分子量分布结果Table 2 Molecular weight distribution results of swim bladder glue and donkey skin glue
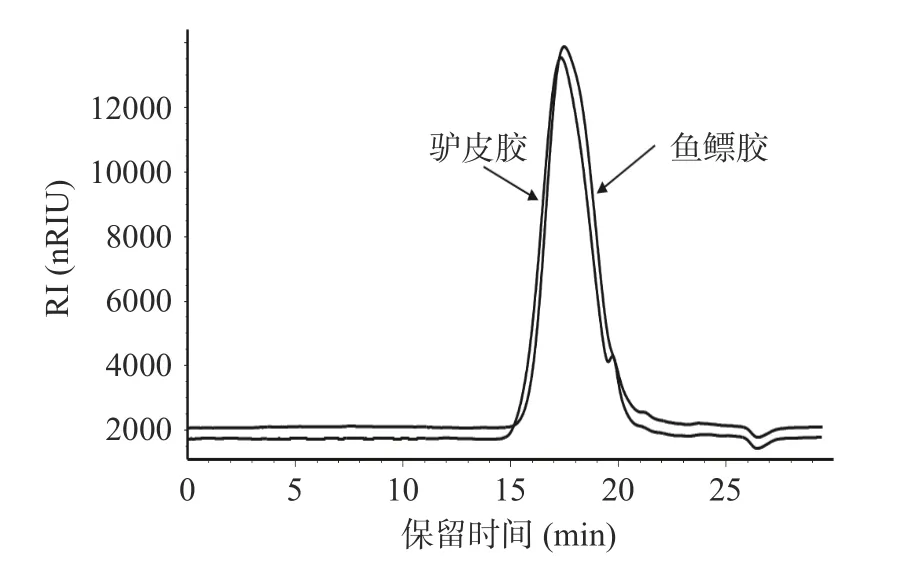
图1 鱼鳔胶、驴皮胶分子量分布图Fig.1 Molecular weight distribution of swim bladder glue and donkey skin glue
2.4 鱼鳔、驴皮胶原蛋白含量、组成及结构分析结果
2.4.1 鱼鳔、驴皮胶原蛋白含量 结果显示鱼鳔、驴皮胶原蛋白提取物得率分别为96.14%、28.80%,采用试剂盒法测定提取物中胶原蛋白含量分别为55.01%±0.12%、28.59%±0.09%,经计算鱼鳔、驴皮中胶原蛋白含量分别为52.88%±0.12%、8.12%±0.09%,胃蛋白酶辅助提取法更高效率地提取了鱼鳔胶原蛋白,鱼鳔中胶原蛋白含量约为驴皮中胶原蛋白的6.51 倍。
2.4.2 鱼鳔、驴皮胶原蛋白氨基酸组成分析 鱼鳔与驴皮胶原蛋白的氨基酸组成如表3 所示,组成差异较小,均以甘氨酸的含量最高,占总氨基酸含量的26%以上,分别为14.70、16.20 g/100 g。甘氨酸对于维持胶原蛋白的超螺旋结构具有重要作用,可存在于超螺旋结构的中心且不会发生链变形,使得α-螺旋紧密堆积在一起,形成具有疏水性的超螺旋结构[22-23]。此外,天冬氨酸、谷氨酸、丙氨酸、精氨酸、脯氨酸含量也相对较高,而胱氨酸、蛋氨酸、酪氨酸含量相对较低,以上氨基酸组成结果符合Ⅰ型胶原蛋白特征。
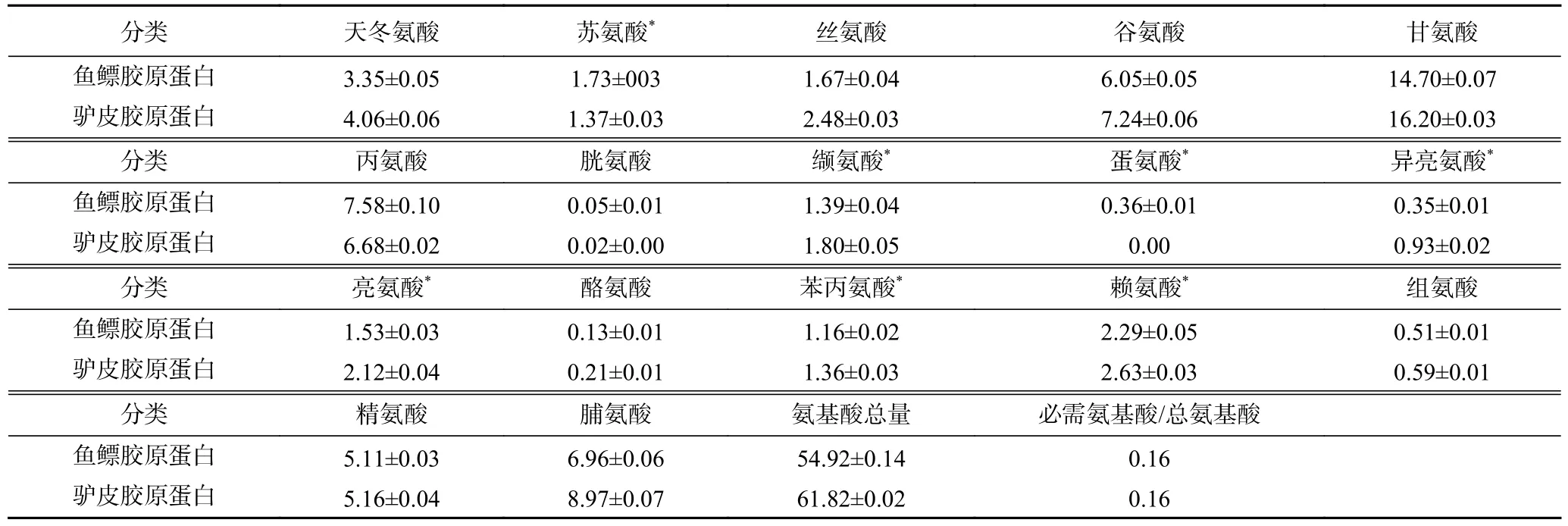
表3 鱼鳔、驴皮胶原蛋白的氨基酸组成(g/100 g)Table 3 Amino acid composition of swim bladder collagen and donkey skin collagen (g/100 g)
2.4.3 鱼鳔、驴皮胶原蛋白SDS-PAGE 电泳 鱼鳔、驴皮胶原蛋白SDS-PAGE 电泳结果如图2,鱼鳔、驴皮胶原蛋白中主要含有1 条135 kDa 左右的α-链,以及由α-链的分子内和分子间交联形成的二聚体β链和三聚体γ链,谱图特征与报道的Ⅰ胶原蛋白[24-26]特征基本一致,可推断提取胶原蛋白为Ⅰ型胶原蛋白。

图2 鱼鳔、驴皮胶原蛋白的SDS-PAGE 电泳图Fig.2 SDS-PAGE electrophoresis pattern of swim bladder collagen and donkey skin collagen
2.4.4 鱼鳔、驴皮胶原蛋白紫外全波长扫描结果分析 蛋白质的紫外吸收光谱是蛋白质中紫外生色基团加和导致,大多数蛋白质在280 nm 处有最大吸收峰[24],这是由于芳香族氨基酸色氨酸残基吲哚环和酪氨酸残基的酚基引起的[26],而Ⅰ型胶原蛋白的特征吸收峰一般在230 nm 附近,这主要与胶原多肽链中含有-C=O、-COOH、CO-NH2等生色团有关,由C=O的n→π 跃迁所产生。根据紫外吸收图谱(图3)可知鱼鳔、驴皮胶原蛋白紫外最大吸收波长分别在233、232 nm,与杨子帆等[26]测定的鱼鳔胶原蛋白和杨霞等[27]提取的驴皮胶原蛋白的紫外最大吸收波长基本一致,符合Ⅰ型胶原蛋白的特征吸收特点,在280 nm附近存在微弱的吸收,推测可能因少量的芳香族氨基酸引起的,以上结果说明鱼鳔、驴皮胶原蛋白为Ⅰ型胶原蛋白。

图3 鱼鳔、驴皮胶原蛋白的紫外吸收光谱图Fig.3 UV absorption spectrum of swim bladder collagen and donkey skin collagen
2.4.5 鱼鳔、驴皮胶原蛋白傅里叶变换红外光谱结果分析 根据傅里叶变换红外光谱分析结果(图4),发现鱼鳔、驴皮胶原蛋白在酰胺A、B 以及Ⅰ、Ⅱ、Ⅲ带均可观察到明显的特征峰:分别在3323.49、3335.09 cm-1有吸收,是由分子中N-H 伸缩振动与氢键缔合引起,是酰胺A 带吸收峰,证明了分子中氢键的存在;分别在2936.14、2929.76 cm-1处有吸收峰,是由于-CH2-的不对称伸缩振动引起的,是酰胺B 带吸收峰;酰胺Ⅰ带、Ⅱ带和Ⅲ带可以直接反映蛋白多肽链的构象,根据文献报道,1600~1700 cm-1之间是由于C=O 伸缩振动引起的酰胺带的特征吸收峰,是蛋白质二级结构变化的特征区域[28],而鱼鳔、驴皮胶原蛋白均在1653.45 cm-1有特征吸收峰,是酰胺Ⅰ带的吸收峰,表明胶原蛋白的二级结构较好;鱼鳔、驴皮胶原蛋白分别在1557.64、1558.38 cm-1处有吸收峰,是由于C-N 伸缩振动或N-H 弯曲振动所反应的吸收带,是酰胺Ⅱ带的吸收峰;分别在1238.09、1239.73 cm-1处有吸收峰,是酰胺Ⅲ带的吸收峰,也是胶原蛋白的红外光谱特征吸收峰,这是由于胶原蛋白中甘氨酸和亚氨基酸形成的(Gly-Pro-Hyp)结构引起的[29-30]。
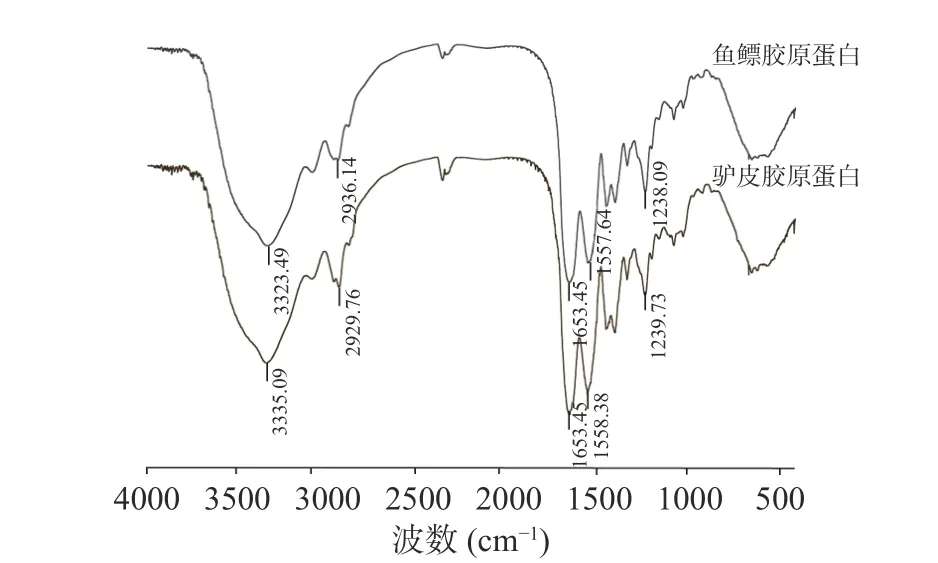
图4 鱼鳔、驴皮胶原蛋白的红外吸收光谱图Fig.4 FTIR spectrum of swim bladder collagen and donkey skin collagen
2.4.6 鱼鳔、驴皮胶原蛋白圆二色谱结果分析 圆二色谱分析结果如图5 所示,鱼鳔、驴皮胶原蛋白分别在208、198 nm 附近有明显的负吸收峰,在221 nm附近有正吸收峰,具有典型胶原蛋白三螺旋结构的圆二色谱特征峰型;鱼鳔胶原蛋白负峰位置在208 nm附近,而驴皮及其他来源的胶原蛋白负峰一般在198 nm 附近[31-32],可能是由于鱼鳔胶原蛋白的三螺旋结构较其他胶原蛋白更紧密[33]。由表4 可知,鱼鳔、驴皮胶原蛋白三螺旋结构差别较大,鱼鳔胶原蛋白以α-螺旋为主,驴皮胶原蛋白以β-折叠中的反平行为主。
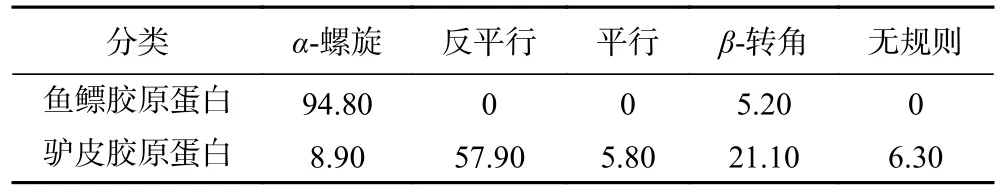
表4 鱼鳔、驴皮胶原蛋白二级结构分布(%)Table 4 Secondary structure distribution results of swim bladder collagen and donkey skin collagen (%)
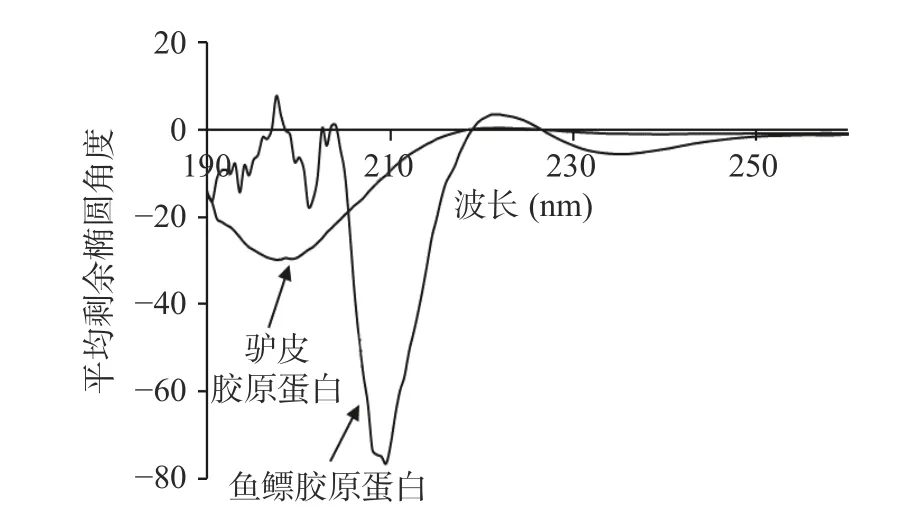
图5 鱼鳔、驴皮胶原蛋白的圆二色谱图Fig.5 Far-UV CD spectra of swim bladder collagen and donkey skin collagen
2.5 鱼鳔胶、驴皮胶对环磷酰胺所致贫血小鼠的改善作用研究结果
2.5.1 对小鼠体重的影响 实验观察期间各组小鼠精神状态良好,进食饮水排便正常。与正常对照组比较,各组小鼠腹腔注射环磷酰胺后,体重明显降低(P<0.01),随后逐渐恢复并稳步增加,各给药组小鼠体重变化无统计学差异(图6)。
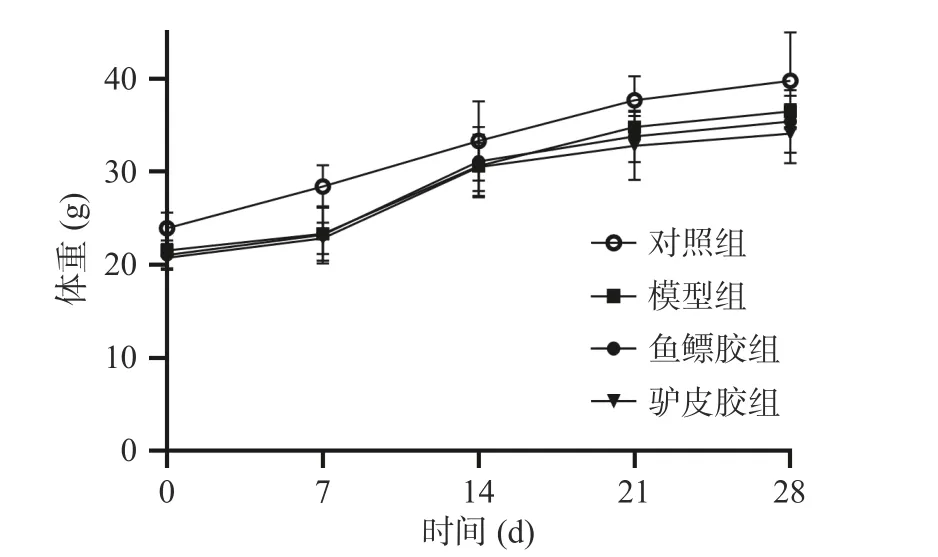
图6 鱼鳔胶、驴皮胶对小鼠体重的影响Fig.6 Effects of swim bladder glue and donkey skin glue on body weight of mice
2.5.2 对小鼠器官系数及血液学指标的影响 表5结果显示,与正常对照组相比,模型组小鼠脾脏系数显著升高(P<0.01),胸腺系数显著降低(P<0.01),提示小鼠在注射环磷酰胺后产生免疫抑制,胸腺萎缩,免疫功能下降,同时脾脏代偿性造血呈现肥大,脾脏体积增大;模型组小鼠RBC、HGB、PLT 显著降低(P<0.01,P<0.05),代表骨髓抑制后,造血功能被破坏,血液携氧能力下降;RET 显著升高(P<0.01),可能因骨髓抑制刺激而提前进入外周血,造成增加异常[34],综合脏器系数和血液学指标的变化说明小鼠贫血造模成功[3]。与模型组相比,鱼鳔胶给药组脾脏系数显著降低、胸腺系数显著升高(P<0.05),且胸腺系数接近正常组水平,RBC、HGB、PLT、RET 显著改善(P<0.05),且HGB、PLT 指标接近正常对照组水平,无统计学差异;与模型组相比,驴皮胶给药组胸腺系数显著升高(P<0.05),趋近于正常对照组水平,RBC、HGB 显著升高(P<0.05),但略低于正常对照组水平。相比驴皮胶组,鱼鳔胶给药组小鼠血液学指标改善显著,且胸腺增大和脾脏萎缩症状均有所缓解,整体评价鱼鳔胶对贫血的改善作用优于驴皮胶。

表5 鱼鳔胶、驴皮胶对小鼠脾脏系数、胸腺系数、血液学指标的影响Table 5 Effects of swim bladder glue and donkey skin glue on the indexes of spleen,thymus and hematology in mice
3 结论
本文对鱼鳔、驴皮进行了系统的化学成分研究,发现二者总蛋白含量丰富均达97%以上,氨基酸组成差异较小,均以与补血、免疫相关的甘氨酸及谷氨酸等为主;鱼鳔胶分子量相对较小,推测鱼鳔胶更易被机体吸收;鱼鳔中胶原蛋白含量丰富,约为驴皮中胶原蛋白的6.51 倍,二者均为Ⅰ型胶原蛋白,但三螺旋结构差异较大,鱼鳔胶原蛋白以α-螺旋为主,驴皮胶原蛋白以反平行为主。
本实验采用腹腔注射环磷酰胺建立小鼠贫血模型,给药28 d 后,与模型组相比,鱼鳔胶、驴皮胶组小鼠胸腺系数均显著升高(P<0.05),说明二者能够明显逆转环磷酰胺造成的胸腺萎缩情况,提高机体免疫及造血功能;鱼鳔胶组小鼠脾脏系数显著降低(P<0.05),说明鱼鳔胶对骨髓造血的功能起到了一定程度的改善,脾脏的代偿性造血减少,脾脏体积逐步恢复,而驴皮胶组小鼠脾脏系数改善不显著;鱼鳔胶给药组血液学指标RBC、HGB、PLT、RET 均得到显著改善(P<0.05),驴皮胶给药组RBC、HGB 显著改善(P<0.05)。以上研究结果证明鱼鳔胶、驴皮胶均可促进环磷酰胺所致贫血小鼠造血机能的恢复,且鱼鳔胶效果优于驴皮胶;结合化学成分比较,二者的分子量大小、氨基酸、胶原蛋白含量及胶原蛋白结构存在较大的不同,推测可能是二者补血活性差异的主要原因,其补血、免疫功效是多成分协同作用的结果,具体的药效物质基础及作用机制还有待深入研究。

