人参叶通过抑制细胞活性氧的积累延缓皮肤衰老
张慧娥,杜连云,初孟瑶,宋欣宏,叶 萍,王恩鹏,
(1.长春中医药大学,吉林长春 130117;2.中国中医科学院西苑医院,北京 100091)
皮肤衰老是一个复杂过程,取决于各种内在和外在因素。衰老最基础的内在因素包括性别、种族和遗传变异[1]。外在因素包括紫外线辐射和空气污染,一些慢性疾病以及生活方式选择等[2]。太阳辐射是导致皮肤老化和皮肤疾病的最关键的外在因素,超过80%的面部皮肤老化是由于轻度慢性紫外线暴露所致,其主要特征表现为特征包括粗糙皱纹、面色蜡黄并伴有斑驳色素沉着以及皮肤失去弹性[3]。引起皮肤老化的机制主要包括活性氧(ROS)、mtDNA 遗传物质突变、染色体的端粒缩短以及内分泌激素变化的作用[4]。其中皮肤衰老的关键因素之一是活性氧(reactive oxygen species,ROS)积累诱发的氧化应激造成细胞衰老[5]。此外,UVB 辐射可引起皮肤中ROS 的增加,导致皮肤老化[6]。目前,抗衰老已成为现代生命科学研究领域的一个重要课题,研究表明,人参可多方面调节老化的分子机制,达到延缓老化的作用。
人参作为人参属(五加科)植物根的多年生植物,几千年来被广泛用作特色中药[7]。人参皂苷作为核心的药理成分,具有多种药理活性,例如镇痛,抗氧化,抗肿瘤和抗老化等性质[8]。人参叶作为人参加工副产物,往往在收获过程中被废弃,将人参叶作为化妆品原材料是因为人参叶中活性成分与人参根部成分相似,部分成分甚至高于人参根,其萃取物具有较强的抗衰老、抗辐射、抗皱活性,该部分的有效应用,将极大地增加企业经济收入,扩大人参的应用范围,降低企业生产成本。大量文献发现人参叶中含有大量的人参皂苷,具有抗衰老作用[9],但作用机制尚不清楚。本研究基于网络药理学分析药物的分子机理,通过分子对接预测目标靶点结构和结合位点,结合细胞实验对氧化损伤指标测定和主要分子机制验证,挖掘人参叶治疗皮肤衰老的主要成分、作用靶点和相关通路,旨在为人参叶的合理利用和后续的相关护肤产品的研究与开发奠定基础,提供科学依据。研究步骤见图1。

图1 研究步骤流程图Fig.1 Flow chart of steps in the study
1 材料与方法
1.1 材料与仪器
人皮肤永生角质形成细胞(HaCaT 细胞)中南大学湘雅医学院中心实验室提供;人参叶 吉林省抚松县万良镇购买;HaCaT 专用培养基(含10% FBS)、胰蛋白酶-EDTA 消化液(T1300-100 mL)北京索莱宝科技有限公司;磷酸缓冲液(phosphate buffered saline,PBS)、RPMI1640 培养基、二甲基亚砜(DMSO)、青霉素-链霉素混合液 美国Gibco 公司;增强型细胞活力检测试剂盒(cell counting Kit-8,CCK-8)、ROS 荧光法试剂盒、总蛋白定量测试盒(BCA 法)、细胞ROS 检测试剂盒 上海碧云天生物技术有限公司;RIPA 细胞裂解液、超氧化物歧化酶(SOD)试剂盒、丙二醛(MDA)试剂盒、环氧合酶-2(COX-2)试剂盒、基质金属蛋白酶-9(MMP-9)试剂盒 南京建成生物工程研究所;一抗(ERK/JNK/PERK/P-JNK)、二抗(种属兔)武汉三鹰生物技术有限公司。
YJ-875 无菌超净工作台 江苏净化设备厂;CO2培养箱 新加坡ESCO 公司;UVB 光疗仪(峰值312 nm)荷兰PHILIPS 公司;5804R 高速离心机 德国Eppendorf 公司;BT25S 天平 赛多利斯科学仪器(北京)有限公司;SLK-O3000-S 摇床 东方化玻(北京)科技有限公司;TRACE 1310 GCTriple Quadrupole MS 型气相色谱串联质谱仪(GCMS)美国Thermo Fisher 公司;A11B S025 粉碎机德国IKA 仪器设备有限公司;Infnite M200 PRO酶标仪 瑞士Tecan 公司。
1.2 实验方法
1.2.1 人参叶样品的制备 人参叶45 ℃烘干粉碎过100 目筛,取粉末100 g,依次以95%乙醇、70%乙醇及水超声提取,料液比1:20,超声40 min,超声功率350 W,滤液离心过滤后合并,减压浓缩滤液至适量,冷冻干燥得粗提物[10]。经GC-MS 方法对其化学成分进行分析,与NIST 11 标准图库比对,根据相关研究设置待测样品备用[11]。
1.2.2 数据库数据筛选
1.2.2.1 人参叶活性成分与靶点筛选 按照类药性(drug-likeness,DL)≥0.18 且口服利用度(oral bioavailability,OB)≥30%的筛选条件从TCMSP 数据库中鉴定人参叶活性物质[12]。将有效物质的作用靶点输入UniProtKB 数据库中相应的基因名称,并筛选人类基因(Homo sapiens)(图2)。
图2 实验中的数据库和软件信息Fig.2 Database and software information in the experiment
1.2.2.2 人参叶治疗皮肤衰老潜在靶点的获取 利用GeneCards 和OMIM 数据库[13],检索“skin aging”关键词,消除重复靶点,药物的活性成分与疾病靶点相匹配。使用在线绘图软件绘制维恩图以根据人参叶的活性成分确定潜在的抗衰靶点。
1.2.2.3 PPI 网络分析与关键靶点获取 将得到的常见抗衰靶点以基因的形式导入STRING 数据库,分析蛋白质之间的相互作用,得到人参叶治疗皮肤衰老核心靶点的蛋白质-蛋白质相互作用(PPI)网络图。物种选择为“Homo sapiens”,选择最小相互作用值>0.4 的PPI。隐藏自由点,下载PPI 图形,并另存为“tsv”格式[14]。
1.2.2.4 构建药物-成分-靶点-疾病-通路网络 应用Cytoscape 软件(3.7.0 版)构建药物和疾病靶点的网络图,显示人参叶与各种衰老靶点的关系,探讨人参叶的抗衰老作用机制。
1.2.2.5 GO 功能富集和KEGG 通路分析 将有效物质与衰老相关共同靶点输入DAVID 数据库,进行GO 和KEGG 富集分析,将数据按P值由小至大,依次排序[15]。ImageGP 在线绘制柱状图和气泡图。
1.2.3 分子对接 从蛋白质数据库获得目标蛋白质的晶体结构。对筛选后的关键活性成分和核心靶标进行分子对接验证。通过PyMOL 软件优化蛋白受体,对接前去除连接的配体、杂原子和水分子。所得分子配体和蛋白受体通过AutoDock(版本1.5.6)软件进行对接和可视化,并记录每个组分的单独对接能量值[16]。
1.2.4 实验分组与造模 将人皮肤永生角质形成细胞分为空白组(Control)、UVB 光损伤模型组(Model)、人参叶组和阳性对照Vitamin A 组。采用UVB 光疗仪造模。HaCaT 细胞以1.0×104个/孔接种于96 孔板,于37 ℃、5% CO2培养24 h,将原有的HaCaT 细胞培养液弃掉,加入200 μL PBS 缓冲液。UVB 照射组采用UVB 光疗仪照射,UVB 光疗仪平行放置于细胞上方,与细胞距离10 cm,照射前预热30 min,照射剂量分别为0、96、240、480、720、960、1440、1920 mJ/cm2,每个剂量设置6 个复孔。照射结束后将PBS 更换为无血清1640 培养基继续培养24 h 后每孔加入10 μL CCK-8,于37 ℃,5% CO2孵育1 h,450 nm 处测定HaCaT 细胞存活率,将细胞存活率为正常细胞存活率50%的UVB 剂量作为后续实验照射剂量[17]。
1.2.5 HaCaT 细胞培养
1.2.5.1 细胞衰老模型建立 将HaCaT 细胞置于含有10%胎牛血清和青链霉素各100 U/mL 的RPMI 1640 培养液中,10 cm2无菌培养皿培养,37 ℃、5%CO2条件下在细胞培养箱中进行细胞培养,UVB 光疗仪进行HaCaT 细胞光损伤模型建立,照射时间分别选定0、20、50、100、120、150、200、300、400 s。照射后各孔吸除PBS 缓冲液,加入200 μL 新鲜培养液,置于培养箱内24 h 后,每孔添加20 μL CCK-8溶液,培养箱中孵育4 h,37 ℃振荡10 min,在570 nm处测定吸光值(A),计算不同UVB 辐射剂量下的细胞生存率。选择细胞生存率为50%左右的药物浓度和UVB 辐射剂量进行后续实验[18]。
1.2.5.2 CCK-8 法检测细胞活力 实验分别分为空白组和给药组(此处的细胞均为正常细胞培养后实验,未给予UVB 光疗仪治疗)(人参叶0~500 mg/L),给药组分别用不同浓度的人参叶孵育细胞,24 h 后,除去原培养基,加入10 μL 含CCK-8 的培养基,继续培养1 h,用酶标仪测定450 nm 吸收光度,重复三次[19]。
1.2.5.3 抗氧化能力指标检测 参考文献[20]并加以修改,将HaCaT 细胞每孔约1×106个接种于6 孔板上,设空白组、UVB 照射组及不同浓度药物组(12.5、25、50 mg/L)、维生素A 为阳性对照,每组3 个平行。培养24 h 后各组分别弃掉旧培养液,加入2 mL PBS 缓冲液,UVB 照射后(照射剂量0.72 J/cm2),各孔吸除PBS 缓冲液,分别加入2 mL不同浓度含药培养液(空白组加入新鲜培养液),置于5% CO2、37 ℃条件下培养24 h 后,吸除上清液,用PBS 冲洗2 次,重新用300 μL PBS 缓冲液悬浮,于液氮和室温反复冻融3 次,待细胞破碎完全,用刮刀将细胞刮下,移至EP 管中,10000 r/min 离心15 min,收集细胞上清液分装,立即检测或-80 ℃冰箱保存。将收集好的细胞上清液分别按照SOD、MDA、COX-2、MMP-9ELISA 试剂盒的操作步骤严格进行测定。
1.2.5.4 活性氧含量测定 HaCaT 细胞培养、不同浓度人参叶孵育及UVB 模型组处理同1.2.5.1,用2',7'-二氯荧光素二乙酸酯(2',7'-dichlorofuorescin diacetate,DCFH-DA)荧光探针检测细胞内的ROS水平。参考试剂盒用缓冲液按1:1000 稀释DCFHDA,弃去无血清RPMI1640 培养基,用PBS 洗涤3 次,加入1 mL DCFH-DA,采用荧光酶标仪于488/525 nm 处测定荧光强度或者在荧光显微镜下观察细胞荧光强度差异。
1.2.5.5 免疫印迹验证 收集细胞样品,按照细胞数目加入适量RIPA 裂解液,放置于冰上裂解15 min,4 ℃条件下,10000 r/min 离心15 min,收集细胞上清液,以BCA 法检测上清液中蛋白浓度。样品中与适量SDS-PAGE 蛋白上样缓冲液混合,沸水浴加热5 min。冷却至室温后用移液器加入到10% SDSPAGE 凝胶的上样孔内,80 V 电压下电泳15 min,后调至130 V,继续电泳约90 min,转印至PVDF 膜上。转膜完毕后,封闭液室温下封闭1 h。加入(抗兔)一抗(1:2000),摇床震荡约20 min,4 ℃孵育过夜,次日,回收一抗,TBST 冲洗3 次,每次10 min。加入适量(抗兔)二抗(1:5000),常温下摇床震荡1 h,TBST 冲洗3 次,每次10 min。ECL 法显色,GIS 凝胶图像分析系统照相,Image J 图像分析软件分析[21]。
1.3 数据处理
采用SPSS 21.0 软件和GraphPad Prism 7 进行统计分析,其中多组间差异比较采用单因素方差分析(one-way ANOVA)和t检验,数据以平均值±标准差(X±SD)表示,以P<0.05 为差异有统计学意义。
2 结果与分析
2.1 人参叶活性成分的筛选
按照OB≥30%和DL≥0.18 的标准,从TCMSP数据库中筛选出人参叶中9 个有效成分,见表1。

表1 活性成分Table 1 Active components
2.2 成分靶点与疾病靶点的预测
从TCMSP、Drugbank 数据库检索到162 个中药有效成分靶点,并通过OMIM、GeneCards 数据库获取848 个与衰老相关的基因。通过韦恩图在线绘图对药物与疾病靶点进行交叉分析,获得了人参叶中94 个治疗衰老的潜在有效靶点,见图3。

图3 药物-疾病交集靶点Venn 图Fig.3 Venn diagram of drug-disease common targets
2.3 构建PPI 网络与获取核心蛋白
通过STRING 数据库获得了人参叶治疗皮肤衰老潜在作用靶点的相互作用关系,将其导入Cytoscape 3.7.0 进行可视化分析,见图4。该网络包含94 个功能蛋白,具有1732 种相互作用关系,以节点度值为评价标准,数值越高,说明在网络中扮演着越重要的角色。其中degree 排名前5 的核心靶点分别为AKT1、JUN、TP53、TNF、EGFR。

图4 基于人参叶抗衰老作用靶点的蛋白质-蛋白质相互作用(PPI)网络Fig.4 Protein-protein interaction(PPI)network based on targets of ginseng folium on anti-aging
2.4 药物-成分-靶点-疾病-通路网络构建
将筛选的4 个有效组分及94 个共有靶点输入Cytoscape 3.7.0 软件,构建药物-成分-靶点的相互作用网络图,图中共有136 个节点,589 条边,紫色是中药人参叶,绿色是其活性物质,橙色为通路,浅蓝色为药物与疾病的共有靶点,连线是药物与活性物质、作用目标、疾病之间的相互影响关系。节点的大小代表degree 的大小,节点越大代表该节点在网络中处于核心的位置(图5)。根据度值选取谷甾醇、槲皮素、人参皂苷Rh2、山萘黄素作为人参叶关键抗衰老化合物进行后续分析。

图5 “药物-成分-靶点-疾病”的相互作用网络Fig.5 “Drug-active component-target-disease” interaction network
2.5 GO 功能富集和KEGG 通路富集分析
使用DAVID 进行GO 和KEGG 分析,GO 富集分析结果见图6,生物过程主要涉及到基因表达的正调控、RNA 聚合酶II 启动子转录的正调控、信号转导等方面;细胞组分主要涉及到细胞外空间、质膜、细胞溶质等位置;分子功能主要涉及到蛋白结合、酶结合、蛋白质同源二聚化活性、蛋白激酶结合等过程。以P<0.05 作为筛选条件,KEGG 通路分析筛选出前10 条通路(图7),由图7 可知,94 个共有靶点主要富集在MAPK 信号通路、PI3K-AKT 信号通路、糖尿病并发症中的AGE-RAGE 信号通路、P53 信号通路、叉头转录因子(FoxO)信号通路、细胞衰老信号通路、肿瘤坏死因子(TNF)信号通路、癌症等多种疾病通路上。KEGG 通路结果表明人参叶可以调控多方面通路,从不同角度来干预机体衰老过程,其主要通路包括MAPK 信号通路、PI3K-AKT信号通路、糖尿病并发症中的AGE-RAGE 信号通路等相关通路。

图6 GO 功能富集分析Fig.6 GO functions enrichment analysis

图7 KEGG 通路富集分析气泡图和圈图Fig.7 Bubble plot and cycle diagram of the KEGG pathway enrichment analysis
2.6 分子对接分析
综观文献发现,以结合能(-5.0 kcal/mol)作为指标来判断结合情况,其中能量越低,配体和受体的构象越稳定。通过分子对接发现,有效成分与核心靶点结合能力的绝对值小于10 kcal/mol。结果表明,人参叶和衰老疾病靶点结合良好,人参叶的活性成分可作用于核心靶点,从而发挥抗氧化、抗炎、调节免疫等多种药理作用,以达到抗衰老的效果(表2 和图8)。

图8 核心靶点与化合物分子对接结果Fig.8 Molecular docking results of core targets and compounds
2.7 CCK-8 检测细胞活性
如图9A,在0~500 mg/mL 浓度的细胞活性测定中,其中0~100 mg/L 范围内,HaCaT 细胞无明显的细胞毒性(细胞存活率均>90%),在该浓度范围内药物对细胞是安全的。图9B 中细胞存活率随 UVB辐射剂量的增加呈递减趋势,因此后续实验选取细胞活力抑制50%时的照射剂量0.72 J/cm2。图9C 在安全范围内选取人参叶(12.5、25、50 mg/L)3 个浓度进行实验,结果显示UVB 照射处理细胞后引起细胞存活率的明显降低(P<0.01),人参叶(12.5 mg/L 除外)及阳性药维生素A 能够提高HaCaT 细胞存活率(P<0.01),不同浓度人参叶可从不同程度上减少UVB照射对细胞的损伤。
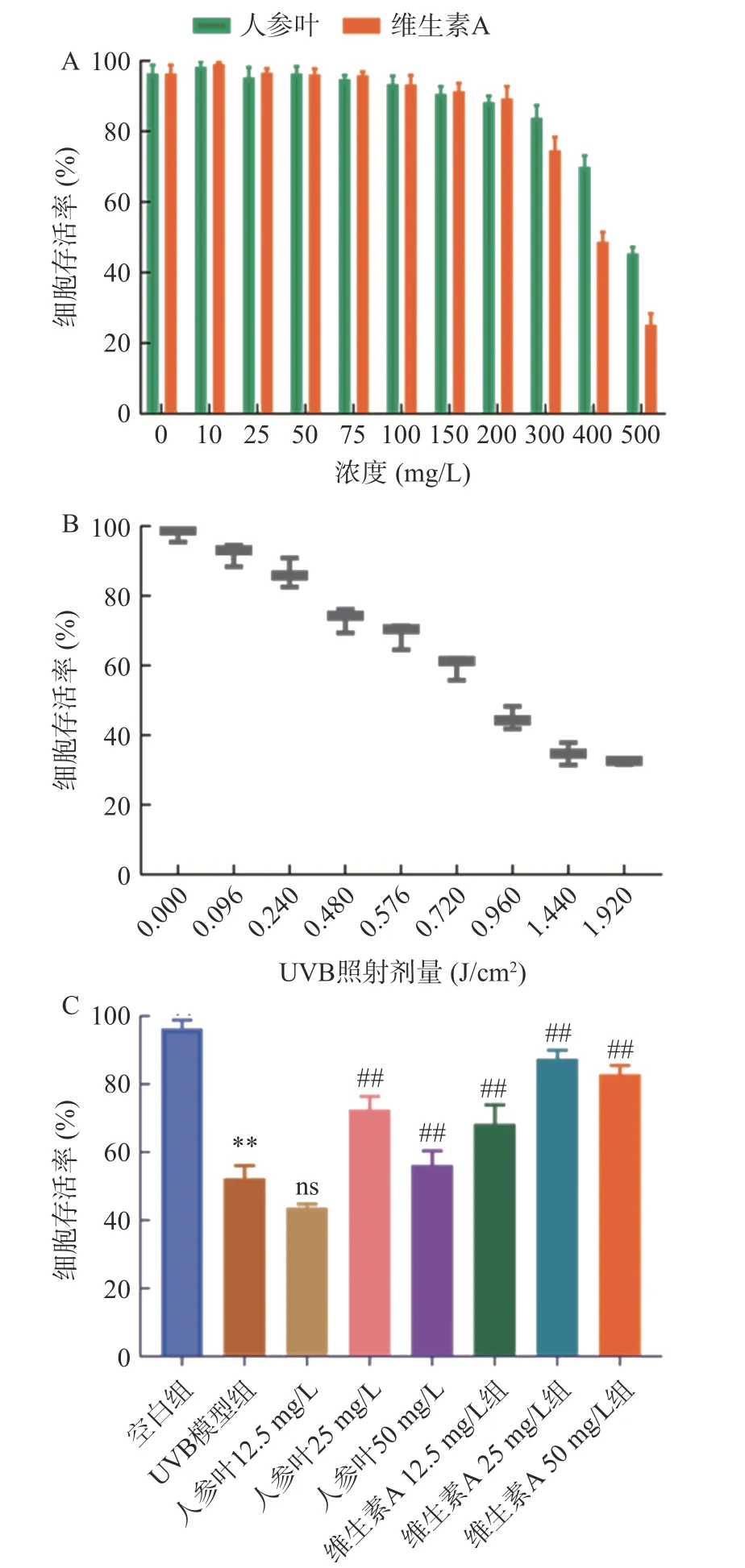
图9 不同浓度人参叶对HaCaT 细胞存活率的影响Fig.9 Effects of different concentrations of ginseng folium on cell viability of HaCaT cells
2.8 人参叶对细胞抗氧化指标的影响
超氧化物歧化酶(SOD)、过氧化氢酶(COX-2)等酶类抗氧化剂和几种过氧化物酶可降低植物的氧化损伤[22]。本研究用UVB 光疗仪造成HaCaT 细胞衰老模型后给予人参叶治疗后,与空白组比较,UVB模型组的SOD 含量显著降低(P<0.05),MDA 水平显著上升(P<0.01);而与UVB 模型组比较,给药组及阳性对照组的SOD 含量明显增高,MDA 含量明显下降,结果表明给药组可提高细胞中抗氧化酶活力,抑制脂质过氧化物产生达到保护HaCaT 细胞(图10A~B)。与空白组细胞对比,UVB 模型组的COX-2、MMP-9 水平显著升高(P<0.05);而与UVB模型组比较,给药组及阳性药Vitamin A 处理后细胞中COX-2、MMP-9 总体水平显著降低(P<0.05),表明给药组能通过降低细胞内环氧合酶-2 及基质金属蛋白酶-9 的活性来保护HaCaT 细胞(图10C~D)。图11 证明了UVB 可以增加细胞内活性氧的水平,增加了细胞的氧化应激,而不同浓度的人参叶则可以不同程度的降低细胞内总活性氧的含量,对细胞起到保护作用。


图10 不同浓度人参叶对UVB 照射HaCaT 细胞内SOD(A)、MDA(B)、COX-2(C)和MMP-9(D)的影响Fig.10 Effects of different concentrations of ginseng folium on SOD (A),MDA (B),COX-2 (C) and MMP-9 (D) in HaCaT cells irradiated by UVB

图11 人参叶抑制UVB 诱导的HaCaT 细胞氧化损伤Fig.11 Ginseng folium inhibits UVB-induced oxidative damage in HaCaT cells
2.9 通路预测靶点的免疫印迹验证
AKT1、JUN、TP53、TNF、EGFR 等基因与MAPK信号通路有着密切的联系,它们都是MAPK 信号通路中的关键调节分子或作用靶点[23]。ERK 和JNK均为MAPK 信号通路中的重要分支,与MAPK 信号通路有紧密联系[24]。AKT1 与ERK 信号通路能够相互作用,AKT1 可以直接磷酸化激活ERK,从而参与调节细胞增殖、代谢、存活等生物学过程。JUN是JNK 的靶基因,JNK 可以通过磷酸化激活JUN,并调控其转录活性,从而影响细胞凋亡、分化等过程[25]。TP53 和ERK/JNK 信号通路之间的关系则比较复杂,一方面,TP53 可以抑制细胞增殖,通过抑制ERK/JNK 等MAPK 信号通路的激活,防止细胞恶性增殖;另一方面,TP53 还可以参与调节ERK/JNK等分支的激活,从而调节基因表达,进而影响细胞生长、分化和凋亡等生物学过程[26]。TNF 是JNK 分支的上游调节因子,可以通过激活JNK 分支参与调节免疫应答、发炎反应等生物学过程。同时,TNF 也可以引发ERK 分支的激活,从而参与调节细胞增殖和存活等生物学过程[27]。EGFR 则是ERK 信号通路的靶基因,EGFR 的激活能够引发ERK 分支的激活,参与调节细胞增殖、分化等生物学过程[28]。与空白组比较,模型组p-ERK、ERK、p-JNK、JNK 相对表达水平升高(P<0.05),而给药组均可降低模型组p-ERK/ERK、p-JNK/JNK 的蛋白表达水平(P<0.01),这说明人参叶可抑制MAPK 信号通路的激活,从而起到抗衰老作用(图12)。
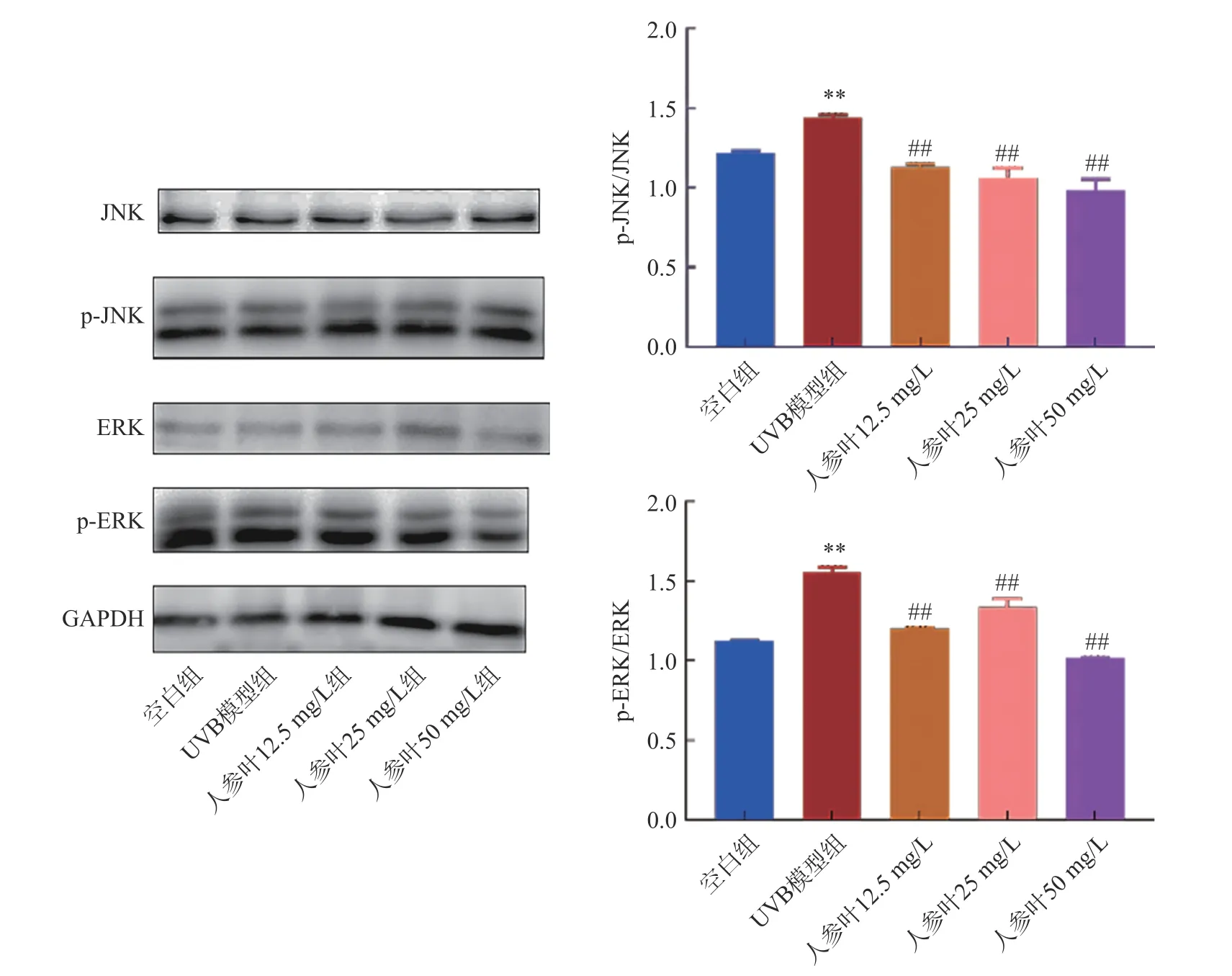
图12 p-ERK/ERK 和p-JNK/JNK 蛋白表达Fig.12 Protein expression of p-ERK/ERK and p-JNK/JNK
3 讨论与结论
本研究结合网络药理学、分子对接和实验验证,系统分析了人参叶抗衰老的潜在机制,构建了“药物-成分-靶点-疾病”关系网络,预测了主要有效物质、潜在靶点和信号通路。另外,山柰酚能够调节Ca2+代谢平衡,提高线粒体膜电位等方式最终抑制凋亡[29]。槲皮素处理可以显著增强线粒体生物发生和氧化磷酸化,并抑制与线粒体有关的细胞凋亡[30]。谷甾醇和人参皂苷具有免疫调节、抗辐射、抗衰老、清除自由基等作用,能有效地保护皮肤免受日光的伤害,具有良好的延缓皮肤衰老作用[31-32]。人参皂苷Rh2 可以通过保护细胞、抑制衰老基因表达、改善线粒体功能、控制炎症反应等方式延缓人体的衰老进程[33]。活性氧与衰老之间的关系备受关注,许多研究表明,细胞内活性氧水平的增加与衰老有关。活性氧的过量生成会导致细胞结构和功能损伤,从而促进衰老进程[34]。本研究中,人参叶的作用可以减少细胞内活性氧产生,从而延缓细胞衰老。
综上所述,人参叶可以间接有效地调控谷甾醇、槲皮素、山奈酚、人参皂甙Rh2 等抗衰老活性成分作用AKT1、JUN、TNF、TP53、EGFR 等相关通路上的靶点,调控机体的抗氧化活性。细胞体外验证发现人参叶可以改善细胞抗氧化水平,抑制细胞内活性氧(ROS)的产生,有效抑制UVB 引发的紫外线损伤,发挥抗衰老的药理作用,这为以人参叶为原料的抗衰老类护肤品方面的应用提供了一定的理论依据。

