Captiva EMR-Lipid 技术结合UPLC-MS/MS快速测定牛羊产品中甲苯咪唑及其代谢物的残留量
叶佳明 ,钟世欢,叶磊海,吴余欣,王 京
(1.浙江公正检验中心有限公司,浙江杭州 310009;2.浙江省食品安全重点实验室,浙江杭州 310009)
甲苯咪唑(Mebendazole,MBZ)是一种广谱的抗虫药物,对于线虫具有较强的驱杀作用。自1971 年问世以来,曾广泛用于驱除人和动物肠道中的寄生虫,水产养殖中蠕虫的治疗。甲苯咪唑对于牛羊绦虫病具有较好疗效,在动物饲养过程中曾广泛使用[1],其在动物体内的代谢物主要有羟基甲苯咪唑(Hydroxy-mebendazole,MBZ-OH)和氨基甲苯咪唑(Aminomebendazole,MBZ-NH2)。由于甲苯咪唑类药物致畸作用和胚胎毒性[2-3]。其残留问题也日益引起人们的关注。日本肯定列表中牛羊产品中甲苯咪唑的最大残留量为10 μg/kg,欧盟也规定了甲苯咪唑及其代谢物在牛羊肌肉中的最高残留限量为60 μg/kg,我国《GB 31650-2019 动物性食品中兽药残留限量》中规定甲苯咪唑及其代谢物在马羊肌肉和内脏的最高残留限量为60~400 μg/kg。
目前对于甲苯咪唑类药物检测方法主要集中在高效液相色谱法(HPLC 法)[4-5]和超液相色谱串联质谱法(HPLC-MS/MS 法)[6]。高效液相色谱法灵敏度相对较低且抗干扰能力差,大多需要多步净化处理、方法繁琐,假阳性高,不利于复杂基质的分析。相比之下液相色谱质谱法具有高效分离和准确定性、定量的优点,已经成为甲苯咪唑类药物残留检测的主要分析方法。目前针对水产品[7]、畜禽产品[8]、乳制品[9]中甲苯咪唑残留物的测定已有文献报道,前处理都需要氮吹浓缩,固相萃取净化、正己烷去脂等多步骤富集净化手段,耗时费力。通过式净化方式操作简便[10],提取溶液经小柱净化后,大部分杂质干扰物截留在小柱上,滤液可直接进样分析,作为一种新型的净化处理技术具有较好的应用前景[11-12]。本文基于增强型脂质去除净化技术,以通过式固相萃取方式,结合液相色谱串联质谱,建立了一种牛羊产品中甲苯咪唑及其代谢物的测定方法。该方法操作简便、定量准确,可实现牛羊产品中甲苯咪唑及其代谢物的快速检测分析。
1 材料与方法
1.1 材料与仪器
甲苯咪唑、羟基甲苯咪唑、氨基甲苯咪唑、甲苯咪唑-D3、羟基甲苯咪唑-D3纯度>98%,北京坛墨质检科技有限公司;氨水、二甲基亚砜、氯化钠、无水硫酸镁 国药集团化学试剂有限公司;乙腈、甲醇色谱纯,美国Fisher 公司;去离子水(18.2 MΩ·cm)由 Mil-lipore 纯水机制得;牛肉(10 批次)、羊肉(10 批次)、牛肚(5 批次)和羊杂(5 批次)购于杭州临安青山湖农贸市场。
LC-20AD 液相色谱仪 日本岛津公司;AB4500液质联用仪 美国AB SCIEX 公司;安捷伦RRHDSB-C18色谱柱(2.1 mm×100 mm,1.8 μm)、Captiva EMR-Lipid 固相萃取小柱(300 mg,3 mL)安捷伦公司;Oasis HLB 固相萃取小柱(60 mg,3 mL)、Oasis MCX 固相萃取小柱(60 mg,3 mL)Waters公司;QuEChERS 粉(900 mg MgSO4、150 mg PSA)
苏州纳普公司;Multi Reax 振荡器 德国Heidolph 公司。
1.2 实验方法
1.2.1 样品预处理 称取5 g 牛羊产品于50 mL 离心管中,加入100 μL 混合内标溶液,加入20 mL 0.2%氨化乙腈溶液,1.0 g 氯化钠、0.5 g 无水硫酸镁、涡旋1 min 后,2000 r/min 振荡提取10 min,4000 r/min 冷冻离心3 min,取3 mL 上清液经Captiva EMR-Lipid 固相萃取柱净化后,过0.22 μm 有机滤膜后,待测。
1.2.2 标准溶液配制 标准储备液的配制:分别精密称取甲苯咪唑、羟基甲苯咪唑、氨基甲苯咪唑、甲苯咪唑-D3、羟基甲苯咪唑-D3各10 mg,先用5 mL二甲基亚砜溶解,加甲醇稀释定容至100 mL 刻度,摇匀。
混合标准溶液的配制:分别吸取1.00 mL 甲苯咪唑、羟基甲苯咪唑、氨基甲苯咪唑标准溶液(100 μg/mL)于同一100 mL 容量瓶中,混匀后用乙腈定容,得到1.00 μg/mL 混合标准溶液。
混合内标溶液的配制:分别吸取1.00 mL 甲苯咪唑-D3、羟基甲苯咪唑-D3内标溶液(100 μg/mL)于同一100 mL 容量瓶中,混匀后用乙腈定容,得到1.00 μg/mL 混合内标溶液。
基质工作液的配制:按样品前处理方法对空白样品进行处理后,用空白样品基质溶液稀释混合标准储备液,制成混合标准工作液浓度依次为:0.2、1.0、5.0、10.0、20.0、50.0 ng/mL,内标浓度为5.0 ng/mL。
1.2.3 仪器条件 色谱条件:色谱柱:安捷伦RRHDSB-C18色谱柱(2.1 mm×100 mm,1.8 μm);流速:0.25 mL/min;进样量:2 μL;柱温:35 ℃。溶液A-0.1%甲酸水溶液,B-乙腈,梯度洗脱程序:0 min,10% B,0~2.00 min,10%~20% B,2.00~3.00 min,20%~80%B,3.00~4.00 min,80% B,4.00~4.10 min,80%~10%B,4.10~7.00 min,10% B。
质谱条件:离子源:电喷雾离子源(ESI 源)。
反吹气流速(CUR Gas):20 L/min;气体1 流速(Gas 1):50 L/min;气体2 流速(Gas 2):50 L/min;离子化温度(TEM):550 ℃;射入电压(EP):10 V;碰撞池射出电压(CXP):18 V。
监测模式:正离子监测模式;监测离子对及相关电压参数设定见表1。

表1 三重四极杆离子对及相关电压参数Table 1 Triple quadrupole ion pairs and related voltage parameters
1.3 数据处理
使用 AB SCIEX Analyst software 软件采集数据,MultiQuant 软件对数据定量处理,方法学考察中回收率平行测定6 次,样品平行测定3 次,采用Microsoft Office Excel 2003 和Origin 8.5 进行统计学分析和图形绘制,结果以平均数表示。
2 结果与分析
2.1 质谱条件的优化
甲苯咪唑(MBZ)、羟基甲苯咪唑(MBZ-OH)和氨基甲苯咪唑(MBZ-NH2)的共同的咪唑环上带有NH 基团,在离子化过程中,此类化合物易与H 质子结合,带正电荷,因此在质谱分析时一般采用正离子扫描模式[4]。在正离子扫描模式下分别对1 mg/L的3 种化合物进行质谱扫描分析,通过优化离子源参数,确认MBZ 的母离子峰为296.0,MBZ-OH 母离子峰为298.0,MBZ-NH2母离子峰为238.0,MBZD3和MBZ-OH-D3相应的母离子峰分别为299.0和301.1,并对其子离子进行全扫描,MBZ、MBZNH2和MBZ-D3失去-COC6H5得到m/z 105.1 子离子碎片,MBZ、MBZ-NH2和MBZ-D3失去-C6H5得到m/z 77.2 子离子碎片,MBZ-OH 和MBZ-OH-D3失去-OCH3后剩余部分得到m/z 266.0 子离子碎片,MBZ-OH 和MBZ-OH-D3失去-C6H5COH 和-OCH3后剩余部分得到 m/z 160.0 子离子碎片,选择相应子离子以MRM 模式进行监测,优化每种化合物的母离子和子离子所需最佳裂解电压和碰撞能(CE),得到优化的质谱参数见表1。
2.2 色谱条件的优化
正离子扫描模式下,甲酸的添加会显著增强待测化合物的响应强度。本文比较了水、0.05%甲酸、0.1%甲酸、0.2%甲酸的各物质的响应值,结果如图1 所示,随着甲酸含量的提高,各物质的响应值也随之上升,当甲酸浓度在0.1%时,各物质的响应趋于稳定,因此选用0.1%甲酸作为添加量,乙腈和甲醇是液质检测的通用流动相,乙腈洗脱能力更强,分析时间更短,相同浓度的甲苯咪唑在乙腈中响应值是甲醇的1.5 倍,羟基甲苯咪唑、氨基甲苯咪唑在乙腈和甲醇中响应相近,无显著性差别,因此本文选用0.1%甲酸水和乙腈作为流动相。
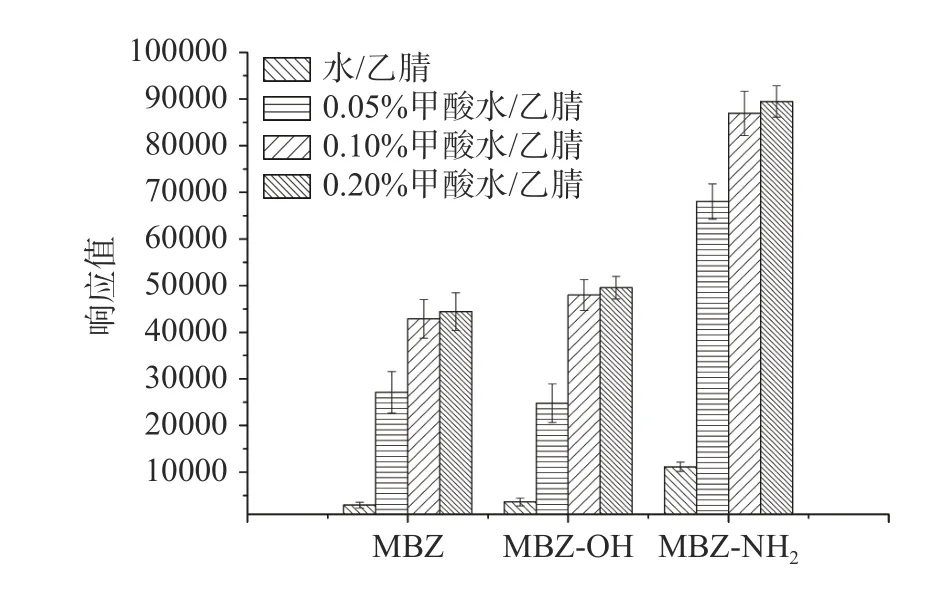
图1 不同流动相响应比较Fig.1 Comparison of response between different mobile phases
甲苯咪唑、羟基甲苯咪唑、氨基甲苯咪唑、甲苯咪唑-D3、羟基甲苯咪唑-D3的MRM 图如图2 所示。

图2 MBZ 类化合物MRM 图Fig.2 MRM chromatogram of MBZ drugs
2.3 提取溶剂的选择
甲苯咪唑、羟基甲苯咪唑和氨基甲苯咪唑均属于弱碱性化合物,水溶解性差,其溶解度受pH 影响较为明显,在碱性条件下易溶于乙腈、乙酸乙酯、氯仿等有机溶剂[7,9]。查阅相关文献[13-14],甲苯咪唑类药物残留的测定常使用以下几种提取溶剂:乙腈、氨化乙腈、乙酸乙酯、乙酸乙酯与NaCO3混合溶液等。本文比较了上述四种溶剂提取效果,结果如图3所示,单纯的乙腈与乙酸乙酯提取效果并不理想,三种化合物回收率均小于80%,加入0.2%氨水和1%NaCO3溶液后,回收率大幅提高,0.2%氨化乙腈和乙酸乙酯碳酸钠混合溶液提取效果均能满足测定要求,考虑到牛羊肉中有大量蛋白和脂肪类物质,所选用提取液最好能沉淀蛋白,降低基质效应。与乙酸乙酯相比,乙腈沉淀蛋白的作用更为有效[10]。因此本方法选用0.2%氨化乙腈作为提取溶液。

图3 4 种溶剂提取效果图Fig.3 Extraction effects diagram of four solvents
2.4 净化方式的选择
甲苯咪唑类化合物的净化方式主要有液液萃取法[8,15]、分散固相萃取法(QuEChERS 法)[6,16]和固相萃取法(SPE)[3,17]。液液萃取法净化简单方便但试剂消耗量大,除杂效果较差,单靠液液萃取净化基质效应较强,降低了方法灵敏度。QuEChERS 法和SPE 法在兽药残留分析中应用较为广泛,具有较好净化效果,本文比较了QuEChERS 法、HLB 固相萃取法、MCX 固相萃取法、Captiva EMR-Lipid 固相萃取法四种净化方式。选取50 ng/mL 牛肉基质提取液进行加标回收测定,结果如图4 所示,QuEChERS法一般以PSA、C18、GCB、MgSO4等为原料进行配比[18-19],本文尝试了900 mg MgSO4、150 mg PSA 的经典配比[20],三种化合物的回收率在72.0%~83.0%之间。亲水亲脂平衡的HLB 固相萃取柱适用性广,三种化合物的回收率在79.1%~88.0%之间。由于甲苯咪唑及其代谢物均属弱碱性化合物,采用混合阳离子MCX 萃取小柱富集,可去除基质中酸性和中性化合物的影响,净化效果较好,三种化合物回收率在89.1%~93.4%之间。Captiva EMR-Lipid 小柱是基于体积排阻和疏水相互作用机制来去除脂质,对于脂质等杂质去除较好,三种化合物的回收率88.1%~96.5%,净化效果与MCX 相近,虽然成本上略高于MCX 小柱,但由于其采用吸附杂质的通过式净化,操作更为简单高效,无需后续浓缩复溶等步骤,节省溶剂,降低能耗,在兽药残留检测中已得到较好的应用[21-22]。因此本文采用Captiva EMR-Lipid 固相萃取小柱作为净化手段。
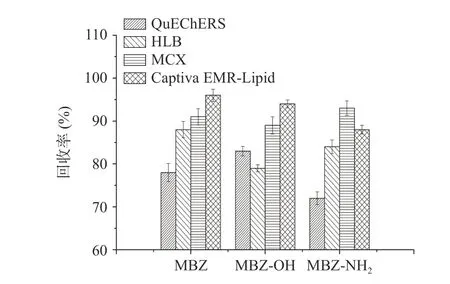
图4 4 种净化手段净化效果比较Fig.4 Comparison of purification effects of four purification methods
2.5 基质效应
牛羊产品中存在大量蛋白质、脂肪等干扰物质,对定量分析中有较大影响,因此有必要研究分析牛羊产品的基质效应。试验选取牛肉、羊肉、牛肚和羊杂碎四种不同基质的空白样品,分别绘制0.2~50 ng/mL 的空白基质标准溶液曲线和溶剂标准溶液曲线来评价基质效应。基质效应ME(%)=基质标准曲线斜率/溶剂标准曲线斜率×100。ME 小于80%表现为基质抑制效应;80%~120%基质效应不显著;大于120%表现为基质增强效应[23-24]。三种化合物的基质效应结果如表2 所示,牛肉羊肉等肌肉组织经净化处理后样品溶液中杂质相对较少,三种化合物基质效应在89.1%~106.6%之间,基质效应不显著。牛肚羊杂碎等内脏部分,基质更为复杂,在牛肚样品中MBZ-OH 表现为基质增强,MBZ-NH2表现为基质抑制;在羊杂碎样品中MBZ-OH 和MBZ-NH2均表现为基质抑制,不同化合物在不同基质中基质效应表现也不完全一致。因此在牛肚羊杂碎等基质复杂的内脏样品结果分析中有必要通过空白基质标准曲线进行定量抵消基质效应的影响。本文采用空白基质标准曲线进行定量分析。
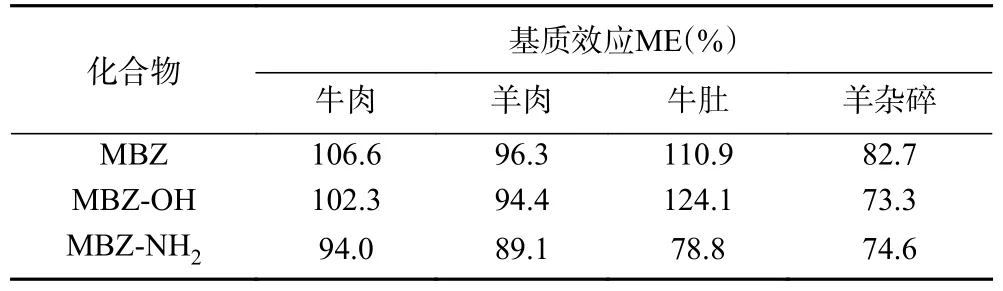
表2 3 种甲苯咪唑药物的基质效应Table 2 Matrix effects of three MBZ drugs
2.6 方法线性范围、检出限、定量限、精密度考察
牛肉羊肉等肌肉组织样品可选用溶剂标准曲线或基质匹配标准曲线,牛肚羊杂碎等内脏样品需要选择基质匹配标准曲线,选取相同基质阴性样品按上述方法进行处理,配制6 水平的基质匹配工作溶液系列,按方法的色谱和质谱条件,进行LC-MS/MS 分析,参考GB 31656.15-2022[25]方法,MBZ 以MBZ-D3为内标,MBZ-OH 和MBZ-NH2以MBZ-OH-D3为内标,以目标物与相应内标的浓度比为横坐标,以目标物与相应内标的定量子离子峰峰面积比为纵坐标,绘制标准曲线。结果如表3 所示,MBZ、MBZ-OH和MBZ-NH2回归方程的相关系数均大于0.999,表明3 种化合物在0.2~50 ng/mL 浓度范围内均呈良好的线性关系。在实际样品中以能达到信噪比(S/N)>3 时样品的测定浓度为方法检出限(LOD),信噪比(S/N)>10 样品的测定浓度为方法定量限(LOQ),结合甲苯咪唑相关国家标准要求和药物的最大残留限量(MRL),确定本方法的检出限为0.3 μg/kg,定量限为1.0 μg/kg。
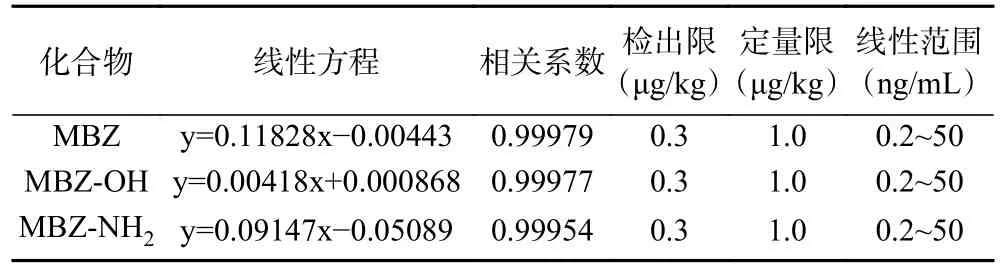
表3 3 种甲苯咪唑类药物回归方程、相关系数、检出限、定量限和线性范围Table 3 Linear equations,correlation coefficients,limits of detection and limits of quantification of three MBZ drugs
2.7 回收率
分别选取牛肉、羊肉、牛肚和羊杂样品,按1.0、3.0 和10 μg/kg 浓度水平添加标准溶液,每个样品按上述方法进行处理平行测定6 次,结果见表4。在牛肉基质中甲苯咪唑及其代谢物的回收率为80.7%~108%,RSD 为1.6%~4.8%,在羊肉基质中甲苯咪唑及其代谢物的回收率为86.6%~108%,RSD 为2.3%~5.8%,在牛肚基质中甲苯咪唑及其代谢物的回收率为80.5%~105%,RSD 为1.1%~4.3%,在羊杂基质中甲苯咪唑及其代谢物的回收率为82.8%~104%,RSD为2.4%~5.5%。由此可知,本方法的回收率稳定、精密度较高,符合《GB/T 27404-2008 实验室质量控制规范 食品理化检测》要求,满足日常检验需求。
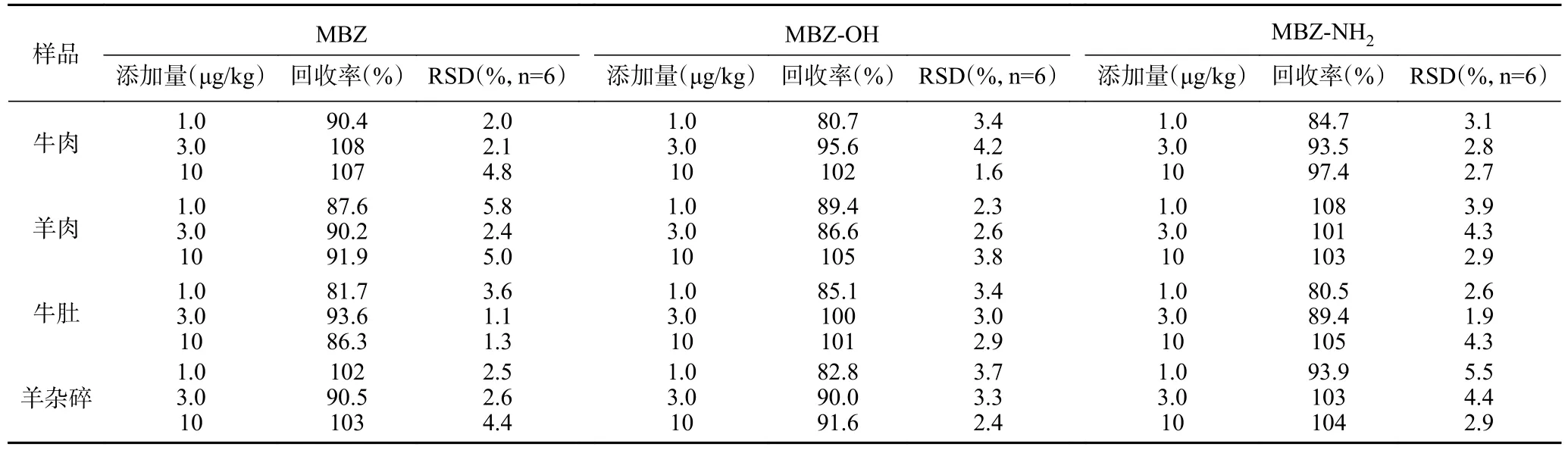
表4 样品中加标回收和精密度试验Table 4 Recoveries and relative standard deviations (RSDs) of MBZ drugs
2.8 实际样品测定
随机采集市场上30 件牛羊产品,按上述方法进行检测,其中有1 件羊肉样品检出MBZ 的代谢物MBZ-OH 和MBZ-NH2,其含量分别为3.8、4.5 μg/kg,有1 件羊杂样品检出MBZ 及其代谢物MBZ-OH和MBZ-NH2,其含量分别为5.0、15.1、20.8 μg/kg。我国《GB 31650-2019 动物性食品中兽药残留限量》中规定甲苯咪唑及其代谢物在马羊肌肉中最大残留限量为60 μg/kg,内脏的最高残留限量为400 μg/kg,检出的羊肉和羊杂样品均未超出限量要求,未发现滥用该类药物的风险。
3 结论
本文牛羊等动物源性食品为对象,基于增强型脂质去除净化技术,以通过式固相萃取方式,结合液相色谱串联质谱,建立了一种能同时测定牛羊产品中的甲苯咪唑及其代谢物的分析方法。选取牛肉、羊肉、牛肚和羊杂样品进行三水平的加标回收试验,加标回收率在80.5%~108.0%之间,RSD 为1.1%~5.8%。该方法操作简便、结果快速准确,克服了目前方法前处理繁琐、检测周期长等不足,适用于牛羊产品中甲苯咪唑及其代谢物残留量的快速检测。

