虾加工副产物抗菌型水解液制备条件优化及抑菌作用
谷 萝,宋 茹
(浙江海洋大学食品与药学学院,浙江舟山 316022)
中华管鞭虾(Solenocera crassicornis)简称“红虾”,是一种经济海虾,属节肢动物门、游泳亚目、管鞭虾科、管鞭虾属[1],主要分布于我国南海、东海和黄海等海域,也有少量分布于越南、菲律宾等海域[2]。虾在生产和加工过程中,产生约50%~60%虾头、虾壳、虾尾等副产物[3]。这些副产物含有丰富的蛋白质、虾青素及不饱和脂肪酸等营养因子[4-5],但是目前主要作为低值饲料的原料或直接丢弃,不仅附加值低,还对环境造成了严重污染。
抗菌肽(Antimicrobial peptides,AMPs)是一种小分子肽,通常由12~50 个氨基酸残基组成,广泛存在于自然界中,可以从细菌、真菌、植物、昆虫、水产品和其他动物中提取[6-7]。AMPs 的抑菌机制主要分为膜损伤和非膜损伤两种,其中,膜损伤是指AMPs与细胞膜上阴离子型磷脂头部基团结合、聚集,导致膜脂质的流动性增加,当AMPs 达到一定浓度时细胞膜就会裂解、细胞内容物释放,使细胞膜的完整性遭到破坏[8];非膜损伤是指AMPs 进入细胞内,通过与DNA 或RNA 结合,直接抑制核苷酸的合成、蛋白质折叠或酶活性,抑制细胞壁的合成或使其水解,从而发挥抑菌作用[9-10]。近些年,抗生素用量正以前所未有的速度增加,寻找抗生素替代品迫在眉睫。抗菌肽具有无污染、无残留、广谱抗菌和不易产生耐药性的优势[11],因此有望取代抗生素成为新型抗菌剂。酶解法制备抗菌肽有反应时间短、酶专一性强、水解条件温和、反应条件容易控制等优点,因此在制备抗菌肽方面具有广泛的应用前景,如:WANG 等[12]利用碱性和中性蛋白酶分步水解凤尾鱼粉制备了寡肽水解液,从中鉴定得到2 种新型寡肽对大肠杆菌和金黄色葡萄球菌生长有较好抑制作用。经酸性蛋白酶水解制备的山苍子蛋白抗菌液在20 mg/mL 时对大肠杆菌的抑菌率高达96.85%[13]。目前以低值农产品、水产品及其加工副产物为原料,通过外加商业蛋白酶水解法制备抗菌水解液或AMPs 的研究受到广泛关注,但利用虾加工副产物制备抗菌型水解液的研究还鲜见报道。
南美白对虾(Penaeus vannamei)又名凡纳滨对虾,营养价值高、肉质鲜美,且出肉率高,深受到广大消费者的喜爱[14]。新鲜的南美白对虾的肌肉水分和蛋白质含量分别高达74%和20%,在加工和运输过程中如果保鲜不当,极易引起微生物繁殖和肌肉自溶,造成腐败变质,产生异味和肉质恶化等现象,严重影响产品品质[15-16]。因此,采取有效的保鲜措施防止或延缓对虾的腐败变质尤为重要。本研究以中华管鞭虾加工副产物为原料,通过温和的蛋白酶水解法制备对南美白对虾优势腐败菌(Specific spoilage organisms ofPenaeus vannamei,PV-SSOs)有抑菌作用的水解液。在选择适宜商业蛋白酶基础上,采用Box-Behnken 响应面试验设计优化酶解条件,制备虾加工副产物抗菌型水解液(Antibacterial hydrolysate from shrimp processing by-products,SPPH),分析SPPH中肽组分的分子量分布,研究SPPH 对PV-SSOs 的抑菌作用模式,旨在为虾加工副产物的新型应用提供理论依据。
1 材料与方法
1.1 材料与仪器
南美白对虾、中华管鞭虾 从舟山老碶菜场购买,加碎冰30 min 内运至实验室。中华管鞭虾由人工剥虾,收集虾壳和虾头副产物,混合,经高速组织捣碎机捣碎至糜状(简称虾糜),–20 ℃冻藏,备用;中性蛋白酶(50000 U/g)、风味蛋白酶(15000 U/g)、碱性蛋白酶(20000 U/g)和胰蛋白酶(250 U/mg)北京索莱宝科技有限公司;胃蛋白酶(1200 U/g)国药集团化学试剂有限公司;营养琼脂、蛋白胨和营养肉汤培养基 青岛高科园海博生物技术有限公司;牛血清白蛋白、谷胱甘肽 上海阿拉丁生化科技股份有限公司。
TM-767 搅拌机 中山市海盘电器有限公司;TU-1810PC 紫外可见分光光度计 北京普析通用仪器有限责任公司;DHP-9052 电热恒温培养箱 上海一恒科学仪器有限公司;Heraeus Multifuge X1R 高速冷冻离心机 湖南湘仪仪器有限公司;PHB-4 便携式pH 计 上海仪电科学仪器股份有限公司;DSX-280KB24 手提式压力蒸汽灭菌器 上海申安医疗器械厂;VD-650 桌上式洁净工作台 上海力辰邦西仪器科技有限公司;SHA-B 双功能水浴恒温振荡器 金坛市岸头良友实验仪器厂;SU-8020 场发射电子显微镜 日本日立公司;安捷伦1260 Infinity 高效液相色谱 德国安捷伦科技有限公司。
1.2 实验方法
1.2.1 虾加工副产物水解液的制备 参考宋茹[17]方法稍作修改,具体如下:–20 ℃冻藏的虾糜在4 ℃下解冻,按照质量和体积比1:2(m:v)加入蒸馏水,充分搅拌,用6 mol/L 盐酸和6 mol/L 氢氧化钠溶液调节pH 至蛋白酶最适pH(见表1),根据虾糜质量按照1200 U/g 比例添加各蛋白酶,根据表1 所示酶解温度,在水浴恒温振荡中酶解3 h,水解过程中用盐酸和氢氧化钠溶液调节混合液pH 在各蛋白酶最适pH 左右,水解结束后沸水浴加热10 min 灭酶,冷却至室温,调节混合物pH 至7.0,然后8000×g 离心20 min(4 ℃),收集上清液,分装,–20 ℃保存备用。

表1 各蛋白酶的酶解pH 和酶解温度Table 1 Hydrolysis pH and temperature of each protease
1.2.2 南美白对虾腐败菌的收集 新鲜南美白对虾,放在无菌培养皿中,室温下放置至严重腐败(约4 d),用少量无菌水清洗南美白对虾,收集菌悬液,得到南美白对虾优势腐败菌(PV-SSOs),分装到无菌管中,灭菌液体石蜡密封,–20 ℃冻存,备用。
1.2.3 抑菌性 参考琼脂扩散法[17],具体如下:PVSSOs 用营养肉汤活化至对数期(时间18~24 h,OD600nm达到0.40),取100 μL 至灭菌培养皿中,加入45~50 ℃左右营养琼脂培养基18 mL,小心混合均匀,待琼脂凝固后,用直径为10 mm 灭菌打孔器打孔,每孔加入150 μL 经0.22 μm 滤膜过滤除菌的酶解液,37 ℃恒温培养24 h,测定抑菌圈直径。
1.2.4 单因素实验 基于水解用酶对PV-SSOs 的抑菌效果,选择胃蛋白酶为最佳酶,研究胃蛋白酶添加量(100、300、500、700、900 U/g)、酶解时间(0.5、1.0、1.5、2.0、2.5、3.0 h)、酶解温度(20、25、30、35、40、45 ℃)和料液比(1:2、1:4、1:6、1:8、1:10,w/v)对PV-SSOs 抑菌性影响。
1.2.5 Box-Beheken 响应面优化试验设计 在固定料液比为1:2 和酶解pH2.0 条件下,选择胃蛋白酶添加量、酶解时间和酶解温度进行三因素三水平Box-Behnken 响应面优化试验(因素及水平见表2),以水解液对PV-SSOs 抑菌圈直径为响应值,采用Design Expert 8.0.5 软件进行统计分析。

表2 响应面设计试验因素与水平Table 2 Experimental factors and levels of response surface method
1.2.6 肽浓度测定 采用邻苯二甲醛(o-Phthalaldehyde,OPA)方法[18]略加改进,具体如下:20 μL 样品与1 mL OPA 液混合,室温放置4 min,测定340 nm下吸光值,去离子水代替样品与OPA 混合作为调零管。以谷胱甘肽为肽标准品(浓度范围0.3~0.8 mg/mL),测定340 nm 吸光值,以浓度为横坐标(x),吸光值为纵坐标(y),经线性拟合得到标准曲线y=0.336x-0.001(R2=0.9932),根据标准曲线计算样品中肽浓度。
1.2.7 蛋白质浓度测定 参照文献[18]进行,适当稀释样品1 mL 与5 mL 考马斯亮蓝G250 混合,室温下放置15 min,测定595 nm 下吸光值。以牛血清白蛋白为标准品(浓度分别为50~300 μg/mL),相同条件测定595 nm 下吸光度,以浓度为横坐标(x),吸光值为纵坐标(y),经线性拟合得到标准曲线为:y=0.0028x-0.014(R2=0.9943),根据标准曲线计算样品蛋白质浓度。
1.2.8 SPPH 中肽组分的分子量分布 参照文献[19]高效液相色谱法,色谱柱PL aquagel-OH(75×300 mm,8 μm)柱温20 ℃,进样量10 μL,流动相为30%甲醇溶液(含0.1%甲酸),流速0.5 mL/min,检测波长220 nm。分子量标准品混合物(牛血清白蛋白68000 Da、维生素B121355.37 Da、氧化型谷胱甘肽612.03 Da 和还原型谷胱甘肽307.32 Da)在相同条件下洗脱,以洗脱时间(min)为横坐标(x),标准品相对分子量对数(lg Mw)为纵坐标(y),拟合得到线性回归方程:y=-0.2713x+7.6762(R2=0.9998)。SPPH中肽组分根据不同洗脱时间计算分子量,将SPPH 中肽组按分子量划分为四个级分:>6000 Da、6000~3000 Da、3000~1000 Da、<1000 Da,根据峰面积计算各级分的相对百分含量,结果以%计。
1.2.9 细胞膜渗透性检测 SPPH 经0.22 μm 过滤除菌,与对数期PV-SSOs 菌悬液(OD600nm为0.45左右)按照体积比1:1(V:V)混合,然后37 ℃恒温培养箱中培养12 h,每隔2 h 取出1 mL 混合液,3500×g 离心10 min,上清液用0.22 μm 滤膜过滤除菌,经无菌生理盐水稀释适当倍数,测定260 nm 吸光值,无菌生理盐水为调零管。SPPH 自身在260 nm有吸收,所以实验用相同稀释倍数SPPH 作为样品空白。无菌生理盐水代替样品与对数期PV-SSOs 作用不同时间260 nm 下吸光值为PV-SSOs 对照组。
1.2.10 菌体微观结构变化 参照文献[19]进行,收集1.2.9 中SPPH 与PV-SSOs 作用12 h 菌沉淀,用无菌生理盐水小心洗涤至少2 次,然后用2.5%戊二醛固定过夜(4 ℃)。固定好的菌体经临界点干燥、喷金,在场发射扫描电镜(加速电压3.0 kV)下观察菌体微观结构,同条件下未经SPPH 作用的PV-SSOs 为对照组。
1.3 数据处理
实验结果用平均值±标准差表示,采用Designexpert 8.0.5 软件进行响应面试验设计与分析,使用SPSS 26.0 软件进行单因素方差分析和邓肯法(Duncan’s)统计分析,P<0.05 表示差异显著,采用Origin 2018 软件绘图。
2 结果与分析
2.1 水解用酶的筛选
图1 结果显示,虾副产物的胃蛋白酶和碱性蛋白酶水解液对PV-SSOs 有抑菌作用,形成的抑菌圈直径分别达到23.5±0.35 mm 和10.00±0.53 mm。相比之下,中性蛋白酶、风味蛋白酶和胰蛋白酶水解液对PV-SSOs 无抑菌活性,表现为无抑菌圈形成。与本研究结果相似,一些水产蛋白及水产品加工副产物的胃蛋白酶水解液也表现出较好的抑菌作用,如:黄鲫胃蛋白酶水解液与风味蛋白酶、胰蛋白酶、碱性蛋白酶和木瓜蛋白酶的水解液相比,对大肠杆菌表现出更高的抑制性[20],螺旋藻经胃蛋白酶水解后能显著抑制大肠杆菌和金黄色葡萄球菌的生长[21]。胃蛋白酶具有较高的水解特异性,专门切割蛋白质中由疏水性氨基酸参与形成的肽键,释放出N 端或C 端带有疏水氨基酸的肽段,而这些肽段极有可能与富含脂质的菌体细胞膜相互作用,通过膜损伤方式或进入膜内作用特定靶点来发挥抑菌作用[19,22-23]。图1 中胃蛋白酶水解液对PV-SSOs 抑菌作用强于其他蛋白酶水解液,因此选择胃蛋白酶为水解用酶,进一步研究酶解条件对虾加工副产物水解液的抑菌作用影响。

图1 琼脂扩散法比较五种不同水解液对PV-SSOs 的抑菌效果Fig.1 Comparison of antibacterial activities of five different hydrolysates against PV-SSOs by the agar-well diffusion method
2.2 不同水解条件对PV-SSOs 抑菌性的影响
进一步分析了胃蛋白酶添加量、酶解温度、酶解时间和料液比对PV-SSOs 抑菌圈直径的影响,如图2所示。

图2 酶解条件对PV-SSOs 的抑菌直径影响Fig.2 Effects of enzymatic hydrolysis conditions on the diameter of inhibition zone of PV-SSOs
固定酶解时间3 h、酶解温度35 ℃和料液比1:2 条件下,胃蛋白酶不同添加量对水解液抑菌活性影响见图2a。当胃蛋白酶添加量从100 U/g 增加至700 U/g 时,水解液的抑菌圈直径从12.67±0.94 mm增大至23.17±0.62 mm,这可能是因为随着胃蛋白酶添加量的增加,酶与底物反应速率增加,使虾加工副产物的水解更彻底,释放更多抑菌活性肽类[19]。但继续增大胃蛋白酶用量至900 U/g 时,水解液的抑菌圈直径未进一步显著提高(P>0.05),推测与胃蛋白酶添加量达到一定程度后,释放出来的抗菌肽组分可能已趋于稳定有关。图2a 结果表明固定酶解时间3 h时,反应体系中添加700 U/g 胃蛋白酶能充分满足抗菌型水解液制备要求。实验选择胃蛋白酶添加量300~700 U/g 进行后续响应面优化试验,检测能否通过优化其他水解条件来减少胃蛋白酶添加量,从而降低水解用酶成本。
固定胃蛋白酶添加量700 U/g、酶解温度35 ℃和料液比1:2 条件下,研究了不同酶解时间对水解液的抑菌性影响如图2b 所示。当酶解时间从0.5 h延长到1.5 h 时,水解液的抑菌圈直径从13.25±1.25 mm 增加到21.5±1.00 mm(P<0.05)。当酶解时间大于2 h 时,水解液对PV-SSOs 的抑菌性出现下降趋势,虽然抑菌圈直径大小未发生统计学上差异(P>0.05),但是也能反映出酶解时间过长不利于水解液抑菌活性的保持,可能与水解液中已生成的抗菌肽被过度水解成抑菌活性低的肽段或游离氨基酸有关[19,24]。根据图2b 结果,酶解1.5 h 到3.0 h 时,所得水解液对PV-SSOs 的抑菌圈直径差异不显著,实验选择酶解1.5~3.0 h 用于响应面优化试验,确定该时间范围内适宜的酶解时间。
在胃蛋白酶添加量700 U/g、酶解时间2 h 和料液比1:2 条件下,酶解温度对水解液的抑菌性影响如图2c 所示。随着酶解温度的升高,水解液的抑菌圈直径先增加后减小,其中在酶解温度35 ℃时抑菌圈直径达到23.27±0.65 mm,酶解温度在30~40 ℃时水解液对PV-SSOs 的抑菌圈直径差异并不显著(P>0.05)。酶解温度过低,在规定酶解时间内酶的活性不能充分发挥;而酶解温度过高,则会破坏酶分子原有的三维结构,导致酶分子发生不同程度变性失活,进而导致其水解作用降低[25]。所以,过低和过高的酶解温度均不利于隐藏在蛋白质内部的抗菌肽组分水解和释放。因此,响应面优化试验中酶解温度选择范围为30~40 ℃。
在胃蛋白酶添加量700 U/g、酶解时间2 h 和酶解温度35 ℃条件下,研究了不同料液比对水解液的抑菌活性影响。由图2d 可知,在料液比1:2~1:10时,水解液的抑菌圈直径急剧下降,说明料液比过大,酶解底物浓度过低,不利与酶分子充分接触,即:降低了酶解反应速度,生成的抗菌肽组分浓度过低,结果表现为抑菌性下降[25]。因此,选择料液比1:2 用于酶解条件优化。
2.3 Box-Beheken 试验结果分析
响应面优化是近年来食品科学和研究广泛采用的一种统计方法,通过模拟和优化一个系统对一个或多个因素的反应,实现反应条件优化目的[26-27]。在单因素实验基础上,本研究以水解液对PV-SSOs 的抑菌圈直径为响应值,采用响应面Box-Beheken 试验(三因素三水平,见表2)优化胃蛋白酶水解虾加工副产物制备抗菌型水解液条件,试验方案设计及实验结果见表3。

表3 Box-Beheken 响应面试验设计及实验结果Table 3 Box-Beheken experimental design and results of response surface methodology
根据表3 实验结果,经Design-Expert 8.0.5 软件拟合,水解液对PV-SSOs 的抑菌圈直径与各因素间的回归方程为:Y=22.98+1.39X1+0.56X2-0.23X3-0.66X1X2-0.29X1X3-0.40X2X3-0.67X12-0.95X22-0.36X32。
表3 方差分析结果见表4,通过方差分析确定模型的显著性,其中回归模型极显著(P<0.01),失拟项不显著(P>0.05)表明该模型拟合度良好,二次回归模型的方差分析系数R2=0.9429 说明该模型解释了94.29%的变异,实验数据具有良好的可靠性。在该模型中,一次项X1、X2和二次项X12、X22对水解液的抑菌性影响均达到显著水平(P<0.05),而X3和X32对实验结果的影响不显著(P>0.05),交互项X1X2对水解液的抑菌性影响显著(P<0.05),而X1X3、X2X3对水解液的抑菌性影响不显著(P>0.05)。通过比较3 个因素F值大小可以得到,影响水解液对PVSSOs 抑菌性顺序依次为:胃蛋白酶添加量(X1)>酶解时间(X2)>酶解温度(X3)。
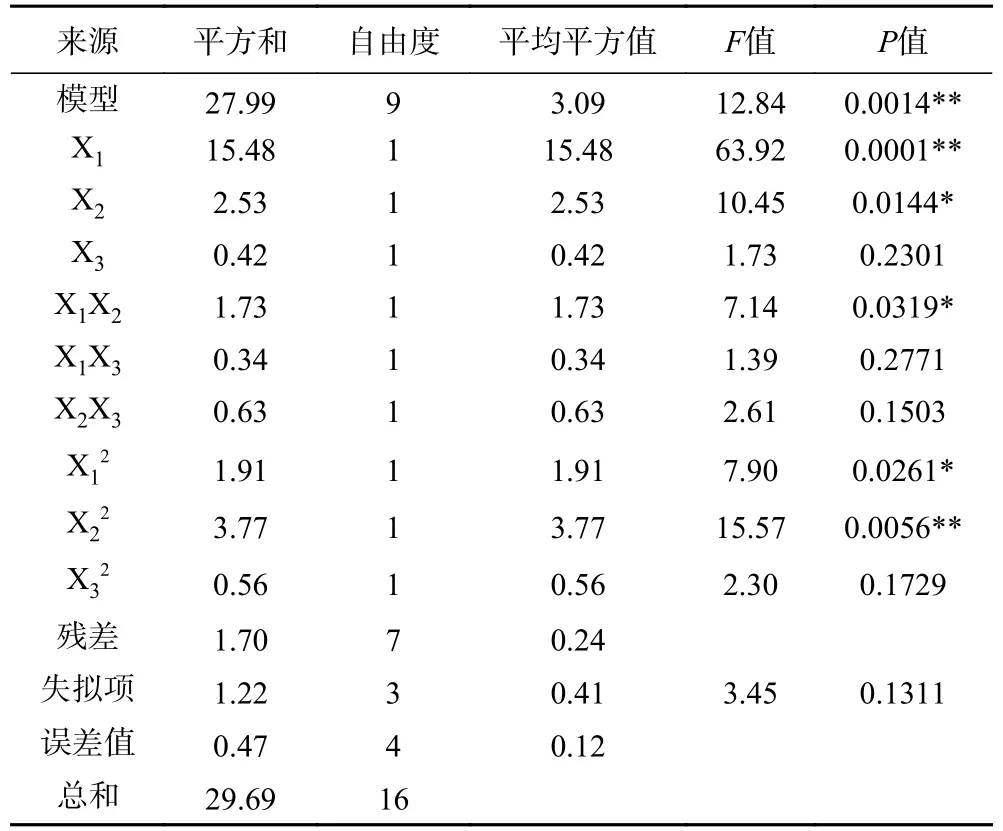
表4 回归模型方差分析Table 4 Analysis of variance (ANOVA) of regression equation
进一步对因素间交互作用进行分析,如图3 所示。图3a 中胃蛋白酶添加量(X1)和酶解时间(X2)对响应值具有交互作用(P<0.05),在较低酶解时间下,水解液的抑菌圈直径随着胃蛋白酶添加量的增加而增加。然而在酶解时间较高水平3 h 时,水解液对PV-SSOs 的抑菌圈直径随着胃蛋白酶添加量的增加而呈现先上升后下降的趋势。类似地,在较高胃蛋白酶添加量700 U/g 时,水解液的抑菌圈直径先随着酶解时间的延长而增大,而后进一步延长酶解时间反而降低水解液的抑菌活性。

图3 酶解条件交互作用对水解液的抑制圈直径影响Fig.3 Interaction influence of hydrolysis conditions on the inhibition zone diameter of hydrolysates
图3b 显示了胃蛋白酶添加量(X1)和酶解温度(X3)对抑菌圈直径的影响。酶解温度在较低水平时,水解液的抑菌圈直径随着加酶量的增加而增加,并在700 U/g 时到达最大值。当酶解温度在较高水平时,如:酶解温度40 °C,水解液对PV-SSOs 的抑菌直径先是随着胃蛋白酶添加量的增加而上升,而后继续加大胃蛋白酶添加量反而降低了水解液的抑菌活性,推测与水解液中抗菌肽段被胃蛋白酶过度水解,生成抑菌活性低肽段或被直接水解为游离氨基酸有关[24]。图3b 中当胃蛋白酶添加量在较高水平700 U/g,在酶解温度30~34 °C 时,水解液的抑菌圈直径保持在较高水平,而后随着酶解温度的提高,水解液的抑菌圈直径呈现下降的趋势。适当提高酶解温度有利于提高酶活性,促进酶解反应进行,但是在蛋白酶添加量充裕条件下,过多蛋白酶会进一步水解反应体系中已经生成的肽类,导致一些活性肽组分氨基酸序列组成发生变化,结果影响水解液整体活性的发挥[19]。
由图3c 可知,无论酶解温度处于较低还是较高水平,随着酶解时间的增加,水解液的抑菌圈直径均呈现先上升后下降的趋势,说明酶解时间过长不利于保持水解液的抗菌活性。在较短的酶解时间1.5 h时,胃蛋白酶在30~40 °C 水解虾加工副产物所得水解液对PV-SSOs 的抑菌直径表现较为平稳,与胃蛋白酶在该温度范围短时间内活性保持稳定有关。
2.4 最佳酶解条件的验证
通过响应面优化分析可得到虾加工副产物最佳酶解条件为:胃蛋白酶添加量695 U/g、酶解时间2.33 h、酶解温度33 ℃,鉴于实验的可操作性,调整酶解条件为胃蛋白酶添加量为700 U/g、酶解时间为2.3 h、酶解温度为33 ℃。通过6 组重复实验测定得到SPPH 对PV-SSOs 的抑菌圈直径为24.10±0.43 mm(图4),该结果与模型预测值23.84 mm 无显著性差异(P>0.05),表明实验确定的模型可以用来预测实际值。经测定SPPH 的肽浓度为25.29 mg/mL,蛋白浓度为62.91 μg/mL。

图4 SPPH 对PV-SSOs 的抑菌作用Fig.4 Antibacterial activity of SPPH on PV-SSOs
2.5 SPPH 中肽组分的分子量分布
SPPH 中肽组分的分子量分布如图5 所示,从SPPH 中分离出7 个色谱峰,根据分子量划分为Mw:>6000 Da(峰1)、6000~3000 Da(峰2)、3000~1000 Da(峰3 和峰4)和<1000 Da(峰5、峰6 和峰7)四个级分,相对百分含量分别为19.28%、11.09%、23.47%和46.15%。其中,Mw>6000 Da 的峰1 中可能含有少量胃蛋白酶,因为在SPPH 制备过程中,不可避免有少量胃蛋白酶残留在水解液中。由图5 可以看出SPPH 中肽组分主要由Mw<3000 Da 组分组成,其相对百分含量接近70%。类似地,SINTHUSAMRAN 等[28]报道太平洋白虾头胸水解物中Mw<1355 Da 的肽比例较大;赵子科[29]报道脊尾白虾的虾肉酶解液中生成的小分子物质比较多,并且分子量分布相对比较分散,其中相对分子质量为3600 Da左右肽组分占反应物总量的27.27%;南极磷虾酶解产物中100~5500 Da 组分占总水解产物的79.69%[30]。图5 结果表明,SPPH 中可能存在大量有抗菌作用的小分子肽类。
2.6 SPPH 对细胞膜渗漏性的影响
细胞膜作为细菌的外部屏障,起着保护自身结构完整性和保证菌体正常生理活动的作用。细胞膜一旦被抗菌物质损伤,胞内一些小分子物质(K+、PO43-等)和大分子物质(核酸、蛋白质、糖类等)就会渗透出来,影响菌体正常的合成代谢[31],测定260 nm 处吸光值的变化能够反映出菌体细胞膜渗透情况和细胞膜的完整性[32]。从图6 可知,在反应时间2~8 h时,对照组(CK)和SPPH 组在260 nm 处的吸光值均显著增加,其中CK 组吸光值增加可能与PV-SSOs胞内部分蛋白酶分泌到胞外,结果导致260 nm 处吸光值增高有关,也有可能是PV-SSOs 中部分菌不耐受CK 组的生理盐水,结果发生一定程度膜损伤而导致遗传物质泄露到胞外。相比之下,PV-SSOs 经过SPPH 处理后在260 nm 处的吸光值急剧上升,且显著高于同时间下的CK 组(P<0.05 或P<0.01),说明SPPH 处理对PV-SSOs 细胞膜的完整性造成了严重破坏,导致了胞内大量遗传物质外泄。当作用大于8 h 时,SPPH 组在260 nm 处的吸光值变化趋于平稳,推测与受损菌体胞内核酸和蛋白质基本泄漏完全有关。与本研究结果相似,TANG 等[33]报道大肠杆菌经卵清蛋白水解物中抗菌肽作用后细胞膜的完整性遭到破坏,导致K+和核酸泄漏,其中作用6 h 时的吸光值趋于平稳。

图6 SPPH 对PV-SSOs 细胞膜渗透性影响Fig.6 Effect of SPPH on the cell membrane permeability of PV-SSOs
2.7 SPPH 对菌膜微观结构的影响
图6 结果提示SPPH 对PV-SSOs 造成了膜渗透,为了进一步了解SPPH 的抗菌机制,采用SEM观察了PV-SSOs 经SPPH 作用12 h 后菌体微观结构变化(图7)。图7a 中CK 组含有较规则的球菌和杆菌,说明PV-SSOs 不止一类菌,即:本研究中引起南美白对虾腐败的优势腐败菌是混合菌体系。CK组的菌体形态保持完整、未变形、表面无褶皱、没有明显的细胞碎片堆积,也未见细胞破损和细胞内容物大量溢出。相比之下,PV-SSOs 的形态结构在SPPH作用12 h 后发生了明显的改变,其中一些菌体表面出现不规则褶皱、变得粗糙,出现凹陷和破裂,有的有明显孔洞形成,细胞内容物溢出和堆积。上述现象表明PV-SSOs 在SPPH 作用下菌体正常的形态和完整性遭到了破坏,与图6 中SPPH 组膜渗透性显著增加结果一致。姜杨[34]报道鲶鱼体表粘液抗菌肽会诱发腐败希瓦氏菌的菌体发生扭曲变形、干瘪,菌体表面出现凹陷,形成孔洞造成内容物外泄;WEI等[35]报道壳寡糖衍生物可以导致南美白对虾腐败希瓦氏菌的菌体大部分出现断裂,菌体表面受损,出现明显的收缩和严重变形。上述报道与本研究结果一致,综合图6 和图7 结果,能够判定SPPH 可以通过膜损伤方式抑制PV-SSOs。

图7 SPPH 与PV-SSOs 作用后扫描电镜结果Fig.7 Scanning electron microscopy results of SPPH after interaction with PV-SSOs
3 结论
胃蛋白酶水解中华管鞭虾加工副产物,制备出对PV-SSOs 有抑菌效果的抗菌型水解液SPPH,采用响应面试验优化的SPPH 中Mw<3000 Da 低分子量肽的相对含量接近70%。SPPH 处理显著增强了PV-SSOs 的细胞膜渗透性,在SEM 下可见PV-SSOs发生严重膜损伤,形成凹陷、孔洞,有的菌体已裂解,因此SPPH 对PV-SSOs 的抑菌作用与膜损伤机制有关。本研究为虾加工副产物制备AMPs 的研究奠定了理论基础,同时也为PV-SSOs 抑菌剂的开发提供了技术依据。但是,SPPH 中抗菌肽的分离鉴定、PV-SSOs 中特定菌的鉴定,以及SPPH 是否进入PV-SSOs 菌体内通过非膜损伤机制发挥抑菌作用有待于后续进一步研究。

