miR-181b miR-210 miR-126在妊娠期高血压疾病中的表达及与炎症反应的相关性
刘 洋, 赵巧棉, 李海燕, 张思宇, 杨 颖, 宫 月
(河北省承德市妇幼保健院生殖中心, 河北 承德 067000)
妊娠期高血压疾病(Hypertensive Disorders in Pregnancy,HDP)作为产科常见并发症之一,亦是孕产妇死亡重要原因[1]。HDP病因及发病机制目前尚未十分明确,临床表现主要为蛋白尿及高血压,症状严重者可出现多系统脏器损伤,严重威胁母婴健康。因此,探寻HDP发病机制对其诊疗意义重大。微小RNA(microRNA,miR)属于基因调控分子,可影响众多蛋白编码基因输出,参加大多数细胞因子免疫应答及转录调控[2]。有研究指出,miR表达和胎盘病理生理发育存在一定关联,成熟miR可参与滋养细胞增殖、凋亡等过程[3]。miR-181b、miR-210、miR-126均为临床常见的miR分子,部分学者发现其在HDP发病过程中起着重要作用[4]。国内外研究指出,炎症反应贯穿HDP发生发展过程,其中炎症因子与HDP病情变化密切相关[5-6]。目前虽有一些研究探索miR与HDP患者炎症因子的关系,但关于miR-181b、miR-210、miR-126在HDP中的表达及与7种炎症因子水平关系的研究报道较少。为此,本研究探究miR-181b、miR-210、miR-126在HDP中的表达及与炎症反应的相关性。现报道如下。
1 资料与方法
1.1一般资料:选取2018年1月至2019年12月承德市妇幼保健院收治的213例HDP单胎孕妇作为观察组,以病情严重程度为依据将其设为妊娠期高血压(GH组,62例)、轻度子痫前期(MP组,90例)及重度子痫前期(SP组,61例)3个亚组。纳选标准:①与HDP相关诊断标准相符[7];②妊娠期产检规律,资料齐全;③单胎妊娠;④知情同意。排除标准:①胎儿先天畸形的孕妇;②孕妇或胎儿有病毒感染;③妊娠前存在自身免疫性疾病、血液系统疾病、糖尿病或高血压;④存在重要脏器严重病变。另选取同期同医院收治的78名健康孕妇作为对照组。四组一般资料均衡可比(P>0.05),见表1。本研究经医院医学伦理委员会批准。
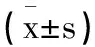
表1 四组一般资料比较
1.2方 法
1.2.1标本采集:所有受检者清晨抽5mL空腹静脉血,在常温下放置30min后,经10min离心(3500r/min转速,13.5cm离心半径)后取上清液,置于-80℃冰箱待检。
1.2.2miR-181b、miR-210、miR-126相对表达量检测:实施实时荧光定量PCR法检测,所用仪器为美国ABI公司生产的7500型荧光定量PCR仪,所用试剂盒及缓冲液、反转录酶、dNTPs购自美国Ambio公司。取1份待测上清液,在其中加入Trizol RNA 1mL进行总RNA提取,利用紫外分光光度计初步判断总RNA纯度,若在1.8~2.0间则提示纯度较好。利用反转录试剂盒对总RNA进行反转录为cDNA,其中 miR-181b上游引物5'-AACATTCATTGCTGTCGGTGGG-3',下游引物5'-GCGAAGCACAGAATTAATACGACTCAC-3';miR-210上游引物5'-CAATAACTGTGCGTGTGACAGC-3',下游引物5'-TATGGTTGTTCTCGTCTCCTTCTC-3';miR-126上游引物5'-TCGTACCGTGAGTAATAATGCG-3',下游引物5'-CGCATI’ATI1ACTCACGGI1AC-3';内参基因U6上游引物5'-ATTGGAACGATACAGAGAAGATT-3',下游引物5'-GGAACGCTTCACGAATTTG-3'。反转录反应体系:5μL模板RNA,3μL miRNA特异性茎环引物及内参基因U6,0.15μL 100mmoL/LdNTPs,1μL 50U/μL反转录酶,1.5μL 10×反转录缓冲液,0.19μL 20U/μL RNase抑制剂,4.16μL无菌不含酶蒸馏水。将提取的cDNA保存于4℃冰箱中。qRT-PCR检测:模板为cDNA,建立qRT-PCR反应体系20μL(10μL 2×TaqMan通用混合物溶液,1μL 20×引物及探针Mix,1.33μL cDNA模板,7.67μL无核酸酶蒸馏水)。反应条件为16℃ 30min;42℃ 30min;85℃ 5min。扩增条件为95℃ 10min 1个循环,95℃ 15s、60℃ 60s 45个循环。实验重复3次后取平均值,miR-181b、miR-210、miR-126相对表达量运用2-△△Ct法进行计算,△Ct=Ct(目的基因)-Ct(U6)。
1.2.3炎症因子检测:取1份待测上清液,血清白介素-1β(Interleukin-1β,IL-1β)、白介素-6(Interleukin-6,IL-6)、白介素-10(Interleukin-10,IL-10)、白介素-17(Interleukin-17,IL-17) 、肿瘤坏死因子-α(Tumor Necrosis Factor-α,TNF-α)、单核细胞趋化蛋白-1(Monocyte Chemoattractant Protein-1,MCP-1)及血管细胞黏附分子-1(vascular-cellular adhesion molecule-1,VCAM-1)水平实施酶联免疫法测定,操作严格按试剂盒说明书要求开展。IL-1β、IL-6、IL-10、IL-17、TNF-α检测试剂盒购自上海科新生物技术股份有限公司,MCP-1、VCAM-1检测试剂盒购自英国Abcam公司。
1.3统计分析:将数据录入软件SPSS25.0分析。符合正态分布的计量资料用描述,行独立样本t检验;多组间比较行单因素方差分析,进一步两两比较采用LSD-t检验;相关性分析采用Pearson相关分析;检验水准α=0.05。
2 结 果
2.1两组miR-181b、miR-210、miR-126 相对表达量及炎症因子水平比较:观察组miR-181b、miR-210 相对表达量及IL-1β、IL-6、IL-17、TNF-α、MCP-1、VCAM-1均比对照组高(P<0.05);观察组miR-126相对表达量及IL-10均比对照组低(P<0.05)。见表2。
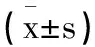
表2 两组miR-181b miR-210 miR-126 相对表达量及炎症因子水平对比
2.2不同HDP亚组miR-181b、miR-210、miR-126 相对表达量及炎症因子水平比较:GH组miR-181b、miR-210 相对表达量及IL-1β、IL-6、IL-17、TNF-α、MCP-1、VCAM-1均比MP组及SP组低,且MP组比SP组低(P<0.05);GH组miR-126相对表达量及IL-10均比MP组及SP组高,且MP组比SP组高(P<0.05)。见表3。
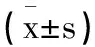
表3 不同HDP亚组miR-181b miR-210 miR-126 相对表达量及炎症因子水平对比
2.3HDP患者miR-181b、miR-210、miR-126 相对表达量与炎症因子的相关性分析:Pearson相关性分析显示,HDP患者miR-181b、miR-210相对表达量与IL-1β、IL-6、IL-17、TNF-α、MCP-1、VCAM-1均呈正相关,与IL-10呈负相关(P<0.05); HDP患者miR-126 相对表达量与IL-1β、IL-6、IL-17、TNF-α、MCP-1、VCAM-1均呈负相关,与IL-10呈正相关(P<0.05)。见表4、图1。
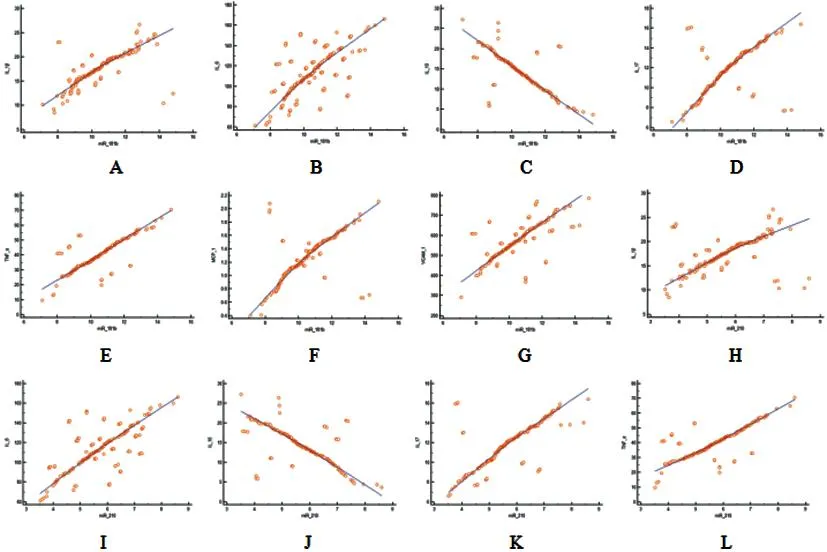

图1 HDP患者miR-181b、miR-210、miR-126 相对表达量与炎症因子的相关性分析散点图
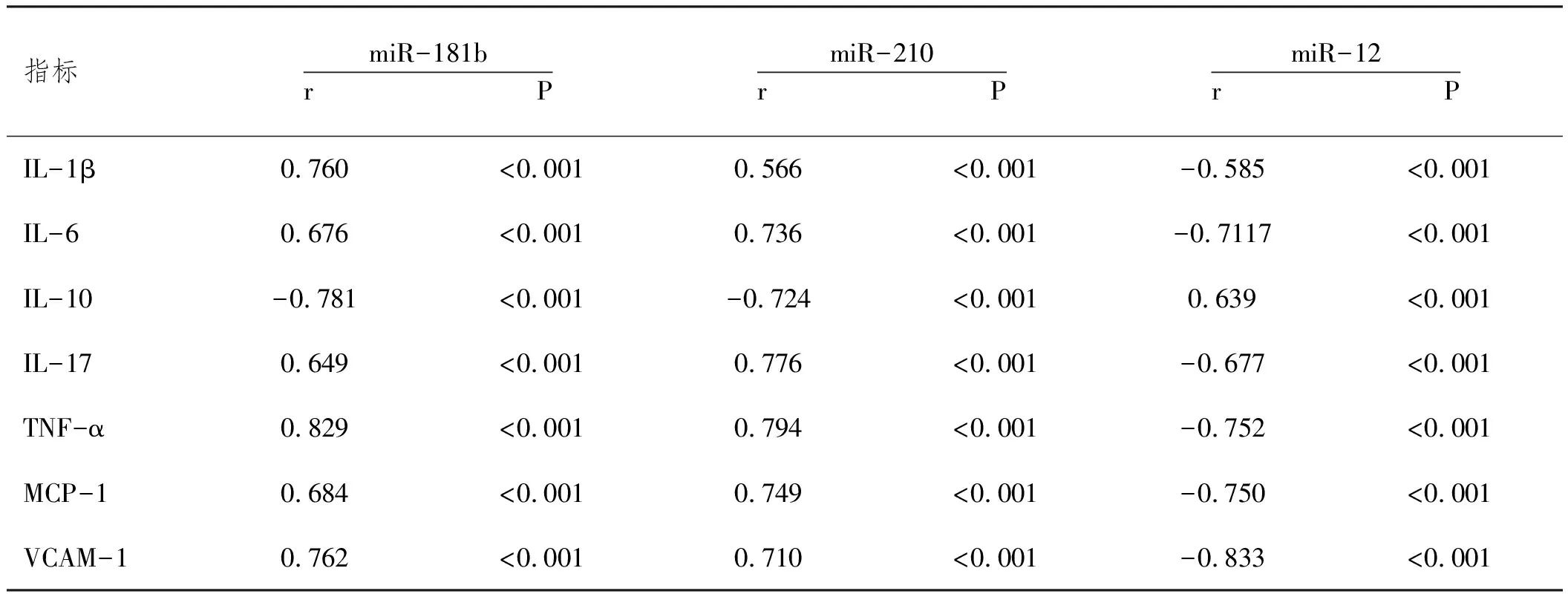
表4 HDP患者miR-181b、miR-210、miR-126 相对表达量与炎症因子的相关性分析
3 讨 论
HDP主要发生于妊娠期女性,大部分患者病情多轻微,早期症状不显著,少数患者可发生昏迷、抽搐等,危及母婴生命安全[8]。HDP发病机制非常复杂,多数学者认为和血管内皮受损、免疫失衡等因素有关[9-10]。因此,探寻HDP发病机制,寻找有效监测指标对其预防、诊断及治疗意义重大。
miR属于内源性非编码RNA,于真核生物中存在广泛,可通过调节细胞基因表达对生物体生理活动进行干预。Hromadnikova等[11]指出,HDP发病可能和miR异常表达有关,miR对胎盘发育具有维持正常作用,可能成为HDP重要评估指标。miR-181b属于miR,当机体出现血管内皮损伤或炎症反应时其表达异常,可参与心血管疾病等发病过程。杨娜等[12]指出,miR-181b在HDP中呈高表达,可介导HDP发病过程。miR-210作为一种存在于人体11号染色体上的缺氧激活因子,当机体缺血缺氧时其呈高表达,可促使血管新生。Frazier等[13]报道,miR-210参与子痫前期发病过程,可通过介导机体炎症反应促进病情进展。miR-126属于与内皮细胞相关miR,对内皮祖细胞增殖分化具有促进作用,可使内皮细胞保持稳定,确保血管完整性。何晓焱等[14]指出,miR-126在HDP中表达下调,通过介导血管生成影响HDP发生发展。本研究中,观察组miR-181b、miR-210 相对表达量比对照组高,miR-126相对表达量比对照组低,表明miR-181b、miR-210、miR-126参与HDP发病过程。
炎症反应作为血管生成及损伤的重要调控因素,其与HDP发生发展存在一定关联。IL-1β、IL-6、IL-17属于促炎因子,其中IL-1β不仅对IL-6具有诱导作用,还能对血管内皮细胞及胎盘进行直接或间接作用,致使细胞损害;IL-6对Th1/Th2免疫平衡具有重要维持作用;IL-17由T细胞释放而成,可利用对内皮细胞等诱导作用促使IL-6等细胞因子产生,进而参与炎症反应。IL-10属于抑炎因子,对IL-6等促炎因子具有抑制作用,可调节机体免疫功能。TNF-α属于免疫调节因子,可参与机体炎症反应,诱导促炎因子释放。MCP-1属于趋化因子CC家族,不仅可结合血中单核细胞,并促使其转变为巨噬细胞,还可使血管内皮受损,降低一氧化氮功能,导致血管痉挛等。VCAM-1属于免疫球蛋白超家族,在细胞因子活化内皮细胞表面表达。当人体正常妊娠时,VCAM-1参与血管内皮与滋养细胞间黏附过程,有利于胎盘发育。本研究中,观察组IL-1β、IL-6、IL-17、TNF-α、MCP-1、VCAM-1比对照组高,IL-10比对照组低,表明炎症反应参与HDP发病过程。
本研究中,GH组miR-181b、miR-210 相对表达量及IL-1β、IL-6、IL-17、TNF-α、MCP-1、VCAM-1均比MP组及SP组低,且MP组比SP组低;GH组miR-126相对表达量及IL-10均比MP组及SP组高,且MP组比SP组高,说明HDP患者病情愈重,miR-181b、miR-210表达及促炎因子水平愈高,miR-126表达及抑炎因子水平愈低。本研究进一步行相关性分析,发现HDP患者miR-181b、miR-210相对表达量与IL-1β、IL-6、IL-17、TNF-α、MCP-1、VCAM-1均呈正相关,与IL-10呈负相关; HDP患者miR-126 相对表达量与IL-1β、IL-6、IL-17、TNF-α、MCP-1、VCAM-1均呈负相关,与IL-10呈正相关,表明miR-181b、miR-210、miR-126可能通过与机体炎症反应相互作用而参与HDP发病过程。分析原因,HDP发病导致机体促炎因子大量释放,炎症反应被激活,血管内皮细胞受损,增加血管通透性,导致脏器缺血缺氧,加剧病情。miR-181b通过内皮细胞信号通路诱导促炎因子释放,使机体炎症反应加重,导致血管内皮受损,从而参与HDP发生过程。miR-210通过相应靶位将相应信号通路激活,引发机体氧化应激,致使机体免疫失衡,大量促炎因子释放,而抑炎因子释放受抑制,从而加剧机体炎症反应,参与HDP发生过程。miR-126通过靶基因PI3KR2、SPRED抑制PI3K、MAPK信号通路,阻止血管生成,致使母胎界面血供不足,胎盘结构出现异常,一些细胞碎片被释放而引起机体炎症反应,最终导致HDP发病。
综上所述,miR-181b、miR-210在HDP中呈高表达,miR-126在HDP中呈低表达,且三者与HDP炎症反应密切相关。

