非肿块型DCIS影像学特点与临床病理特征及分子分型的相关性分析
刘 芳, 周梦红, 王海娟, 袁 博, 欧晓霞, 李 莉
(湖南中医药大学第一附属医院, 湖南 长沙 410007)
乳腺癌是女性最常见的恶性肿瘤疾病,发病率及死亡率均较高,可导致女性第二性征器官损毁及上肢功能障碍[1]。早期乳腺癌从组织病理学上分为乳腺导管内原位癌(ductal carcinoma in situ, DCIS)及小叶原位癌(classic lobular carcinoma in situ, LCIS),但前者的发病率更高[2]。DCIS从影响学上可分为肿块型及非肿块型,肿块型DCIS患者临床相关诊断技术较成熟、检出率较高及病死率低,而非肿块型DCIS无明确肿块边界,多为弥漫性病变,早期症状不显著且误诊率较高[3]。近些年,超声是非肿块型DCIS患者临床重要的影响学检查手段,与钼靶、核磁共振等相比具有实时、简单、安全及价廉等优点,已经被临床广泛应用[4]。当前,根据《St.Gallen早期乳腺癌国际专家共识》标准乳腺癌主要分为Luminal A型、Luminal B型两种分子分型[5]。但关于非肿块型DCIS影像学特点与分子分型的关系暂无研究。本文通过收集我院2020年6月至2021年6月100例非肿块型DCIS患者作为研究对象,观察影像学与临床病理、分子分型的关系,为相关研究提供参考依据。
1 资料与方法
1.1一般资料:选取2020年6月至2021年6月在我院接受手术治疗的100例非肿块型DCIS患者作为研究对象。纳入标准:①所有患者均经术后病理确诊;②术前均未进行内分泌及化疗治疗;③接受过超声影像学检查;④临床病理资料齐全;⑤单侧病灶。排除标准:①超声影像学表示DCIS患者为肿块型;②术前进行新辅助治疗;③合并浸润性导管癌;④两名超声医生对图像判读意见不一致者;⑤参与其他临床项目研究者。100例非肿块型DCIS患者均为女性,年龄23~78岁,平均年龄(48.50±8.00)岁,病灶直径5mm~30mm,平均直径(21.20±3.80)mm,其中左侧病变为43例,右侧病变为57例。100例患者均了解本文研究内容,签署知情同意书。
1.2超声及分型:检查前询问患者疾病史,患者保持仰卧位,双侧上肢上举外展,完全暴露双侧乳房及腋窝,观察乳房形态、大小及乳头是否溢液,必要时可进行检查。采用百胜彩超mylab60超声诊断仪,探头频率为5~12Mhz,迈瑞Mindray彩色多普勒超声,探头频率5~14Mhz。对双侧乳房的各个象限、乳头及乳晕及腋尾进行多切面扫查,同时以腺体前方的脂肪组织作为参照对比扫查双侧乳腺的同个区域,观察有片状低回声区、局限腺体扭曲、导管异常及钙化等现象。由两位7年以上的乳腺超声检查经验的医师,在不知病理结果的前提下进行分析,若分析结果不一致,则协商一致后记录数据资料。根据给肿瘤乳腺病变分类标准,将非肿块DCIS超声分为四种类型。Ⅰ型:导管型,单支或多支导管异常扩张,且内部存在低回声或混合回声;Ⅱ型:腺体型,腺体内存在不规则片状回声及小岛状低回声聚集;Ⅲ型:钙化型:存在钙化灶,形态不规则,当钙化灶松散或聚集分布在导管或腺体内,均归为该类型。Ⅳ型:结构紊乱型,腺体及导管不均匀分布,结构扭曲。
1.3临床资料收集:对100例患者年龄、病灶直径、病灶部位、月经状态、临床症状及细胞核分级等资料进行收集。
1.4免疫组化检测病理组织雌激素受体(estrogen receptor,ER)、孕激索受体(progesterone receptor, PR)、人类表皮生长因子受体2(human epidermalgrowth factor receptor-2,HER2)及Ki-67阳性表达:病理切片在65℃恒温箱中烤片2h,在二甲苯Ⅰ、二甲苯Ⅱ中分别浸泡20min,梯度酒精脱水,后将切片浸入PSB冲洗。切片滴加柠檬酸缓冲液,于微波炉中进行高温修复,PBS冲洗,切片中加入50~100μL的3%过氧化氢,37℃孵育20min;0.05%胎牛血清室温封闭30min后甩干。滴加1抗,4℃孵育过夜,次日取出,加入二抗,37℃孵育30min。DAB显色,苏木精复染,光镜下观察。阳性标准:ER、PR阳性可在细胞核表达为黄色颗粒,按照阳性细胞占比,<1%为(-),1%~25%为(+),26%~50%为(++),>50%为(+++)。<1%为阴性,≥1%为阳性;HER2阳性在细胞膜上表现为棕黄色渔网状颗粒,(-)或(+)为阴性,(+++)为阳性,(++)者进一步进行荧光原位杂交检测,如基因扩散记为阳性,不扩散记为阴性;Ki-67随机选取500个细胞进行观察,以阳性细胞的百分数作为增殖指数记录,当增殖指数≥20%为Ki-67阳性,反之则为阴性。
1.5参考St.Gallen标准,分为Luminal A型:ER和(或)PR阳性,HER2阴性,Ki-67低表达(<20%);Luminal B型:ER和(或)PR阳性,HER2阴性,Ki-67高表达(≥20%),或表现为ER和(或)PR阳性,HER2阳性,Ki-67低表达或高表达。

2 结 果
2.1影像学分型:图1A:患者,女,46岁,非肿块型DCIS(I型)导管出现增粗,行走迂曲且管腔内出现低回声(箭头);图1B:患者,女,31岁,非肿块型DCIS(Ⅱ型)乳腺内呈现片状的低回声区域,边界模糊(箭头);图1C:患者,女,40岁,非肿块型DCIS(Ⅲ型)乳腺内呈现片状的低回声区域,可见分布不匀的点状强回声(箭头);图1D:患者,女,61岁,非肿块型DCIS(Ⅳ型)乳腺内腺体及导管分布混乱,结构扭曲(箭头),见图1。

图1 非肿块型DCIS患者的影像学分型
2.2不同分型的非肿块型DCIS患者临床病理特征比较:Ⅰ型、Ⅱ型、Ⅲ型及Ⅳ型非肿块型DCIS患者临床病理资料年龄、肿瘤直径、月经状态、病灶部分、临床症状均无统计学差异(P>0.05),随着超声分型级别的升高细胞核分级也随之升高(P<0.05),见表1。
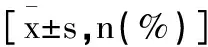
表1 Ⅰ型Ⅱ型Ⅲ型及Ⅳ型非肿块型DCIS的临床病理特征比较
2.3DCIS患者ER、PR、HER2及Ki-67阳性表达:Ⅰ型、Ⅱ型、Ⅲ型及Ⅳ型非肿块型DCIS患者ER、PR阳性表达及Ki-67水平比较均无统计学差异(P>0.05),HER2阳性表达差异有统计学意义(P<0.05);Ⅰ型、Ⅱ型患者HER2阳性表达差异无统计学意义(χ2=1.086, P=0.297),与Ⅰ型相比,Ⅲ型及Ⅳ型的HER2阳性表达升高(χ2=15.191, P<0.001;χ2=7.449, P=0.006);与Ⅱ型相比,Ⅲ型的HER2阳性表达升高(χ2=4.581, P=0.032),但与Ⅳ型差异无统计学意义(χ2=2.345, P=0.126),Ⅲ型与Ⅳ型的HER2阳性表达组间比较差异无统计学意义(χ2=0.008, P=0.927),见表2。
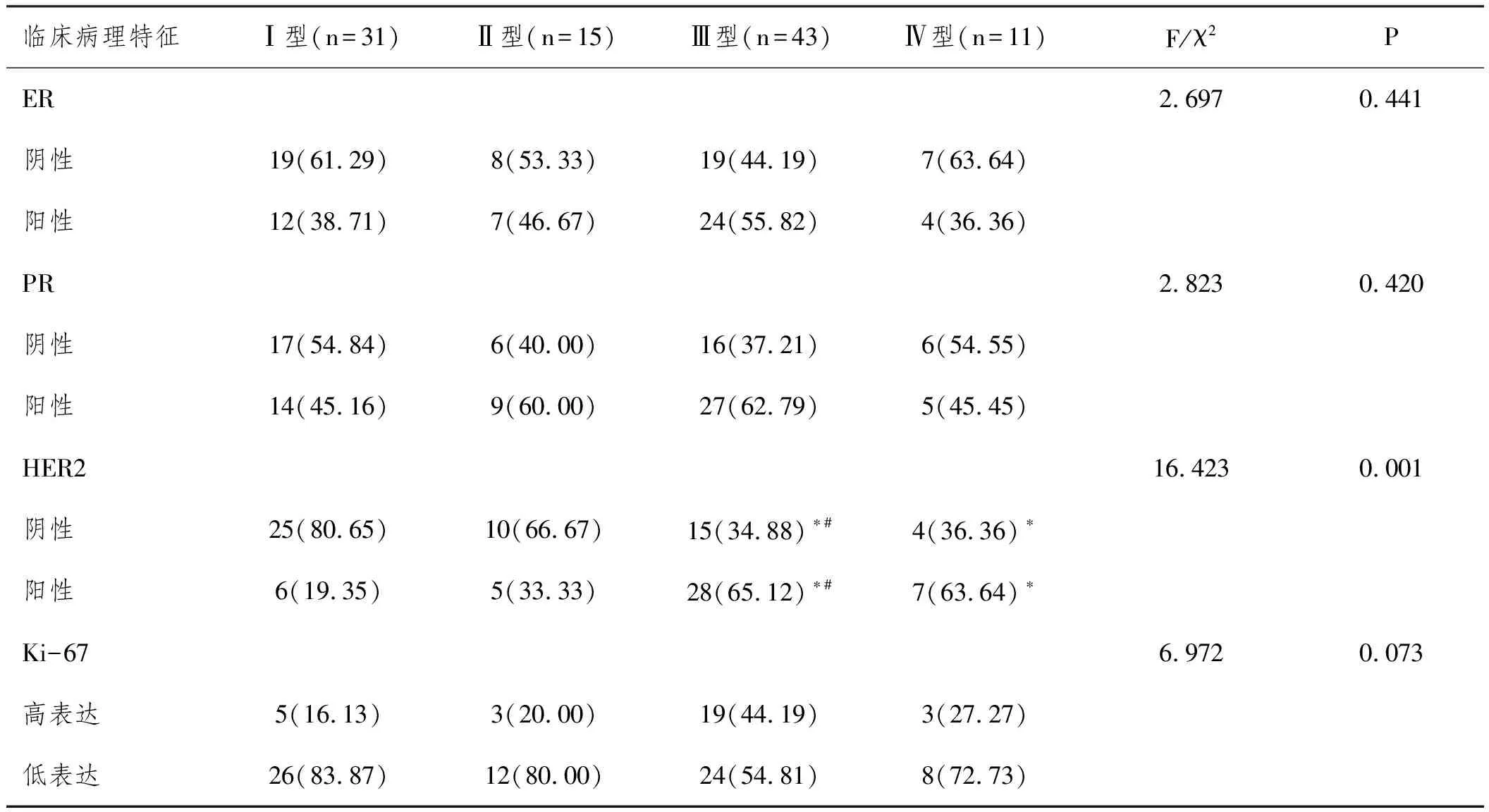
表2 非肿块型DCIS Ⅰ型Ⅱ型Ⅲ型及Ⅳ型分型与ER PR HER2及Ki-67关系分析n(%)
2.4DCIS患者分子分型比较:与Ⅰ型相比,Ⅱ型患者Luminal A型、Luminal B型分型分布,比较差异无统计学意义(χ2=1.322,P=0.250;χ2=1.759,P=0.185);与Ⅱ型相比,Ⅲ型患者Luminal A型、Luminal B型分型分布,差异无统计学意义(χ2=1.561,P=0.212;χ2=2.248,P=0.134);Ⅲ型与Ⅳ型相比,在Luminal A型、Luminal B型分型分布上比较差异无统计学意义(χ2=0.077,P=0.781;χ2=0.219,P=0.640)。但与Ⅰ型相比,Ⅲ型患者Luminal A型、Luminal B型分型分布升高(χ2=9.279,P=0.002;χ2=11.901,P=0.001),与Ⅰ型相比,Ⅳ型患者Luminal B型分型分布升高(χ2=9.279,P=0.002;χ2=8.979,P=0.003),Luminal A型差异无统计学意义(χ2=3.079,P=0.079),见表3。
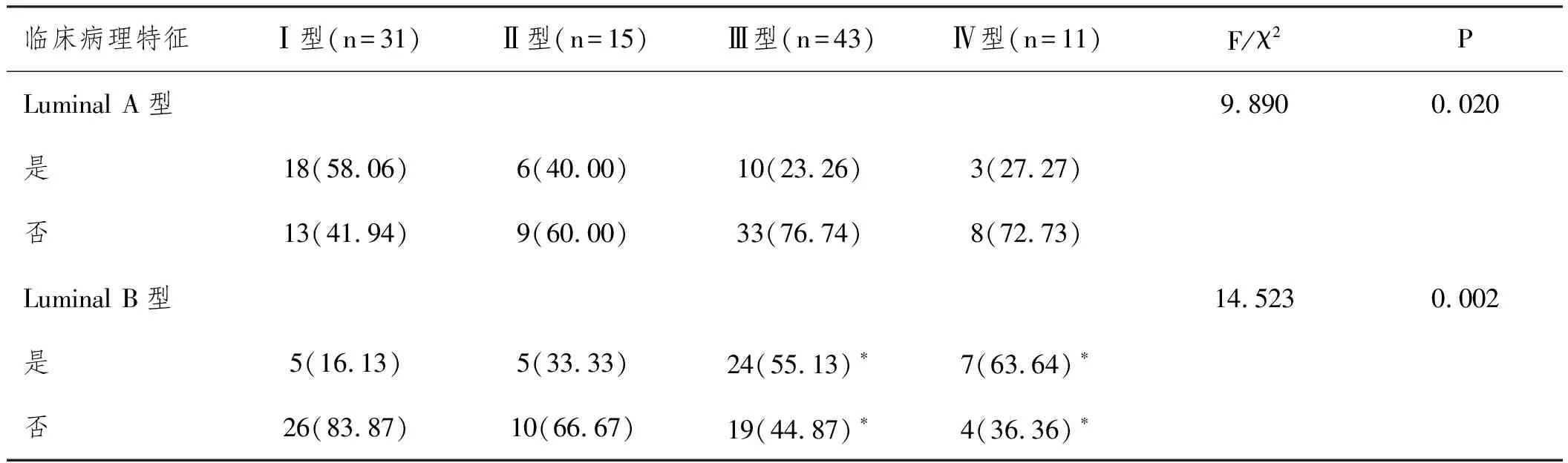
表3 不同超声分型的非肿块型DCIS与分子分型的关系n(%)
3 讨 论
肿块型DCIS组织边界明确,但非肿块型DCIS组织无明确边界,且与乳腺良性增生病变混淆,导致超声诊断率降低,因此,了解非肿瘤型DCIS疾病超声主要分型,且与临床病理特征的关系对于疾病诊断及疾病治疗具有重要意义。Luminal A型、Luminal B型是乳腺癌患者主要分子分型,Luminal B型的患者临床分级更高,且更易发生淋巴结转移且预后更差。本文通过研究发现,不同影像学分级的非肿瘤型DCIS患者的临床病理特征及分子分型也存在差异,希望为相关研究提供有利参考。
本文研究结果显示,非肿瘤性DCIS患者的超声影像分型主要分为导管型(Ⅰ型)、腺体型(Ⅱ型)、钙化型(Ⅲ型)及紊乱型(Ⅳ型),分别为31例、15例、43例及11例,其中以Ⅲ型的患者占比最多。钙化是细胞代谢旺盛,血供紊乱或局部出血,含有铁血黄素沉积,加之钙离子和碱性磷酸酶增加,进一步导致钙化[6]。研究发现,多数乳腺癌患者影像均表现为微小钙化,其中DCIS占乳腺癌中的80%[7]。我国学者对非肿瘤性DCIS患者进行钼靶检查,高级别DCIS病变以钙化型居多,低中级别DCIS病变以非钙化型为主[8]。病理特征显示:DCIS起源于终末导管,癌细胞局限于受累导管及小叶腺腔中,基底膜完整,主要表现为导管型。有学者研究表明,乳腺DCIS病理类型表现多样,超声表现差异较大,非肿瘤型DCIS患者主要以导管型及钙化型最为常见[9]。本文与之研究结论相似。腺体型DCIS患者因肿瘤体边界模糊不清很难被确诊,同时紊乱型DCIS患者导管分布混乱易导致超声诊断漏诊。
本文研究结果显示,非肿瘤型DCIS分型患者的与临床病理特征年龄、肿瘤直径、月经状态、病灶部分、临床症状均无关联性,但是紊乱型DCIS患者的细胞核分级更高,说明超声影像分型与患者细胞核分级存在关联性。细胞核分级可分为低、中及高级别,并表现为实性、筛状、微乳头状等结构模式。高级别的DCIS一般较容易被识别,细胞核可呈现多形性,且细胞核异常分裂,导管坏死及炎症浸润显著[10]。高级别DCIS可沿着导管蔓延,累及大导管,浸润细胞周围基底膜,导致部分肌上皮细胞缺失,出现单个或多个细胞向外突出,超声将这种现象归为腺体型。但当周围纤维结缔组织发生增生,可形成不规则界面,超声显示为紊乱型。本文研究发现,紊乱型DCIS患者细胞核分级更高,这可能与瘤体内结构紊乱且细胞恶化程度更高相关。本文研究结果显示:Ⅰ型、Ⅱ型、Ⅲ型及Ⅳ型非肿块型DCIS超声分级与HER2表达相关。导管型DCIS患者HER2表达主要为阴性,这意味着导管型患者的预后较好。钙化型及紊乱型患者的HER2阳性表达更高,可能与紊乱型患者细胞出现局部坏死,钙化型肿瘤钙盐沉积严重,提示患者患者肿瘤侵袭性更强相关。Luminal A型、Luminal B是乳腺癌患者主要分子分型,且Luminal A型患者的病情更轻,Luminal B型患者年龄偏大、病理分级更高且多为淋巴结转移,认为与Luminal A型相比,Luminal B型临床治疗效果及预后更差。本文研究结果显示:Ⅰ型、Ⅱ型、Ⅲ型及Ⅳ型非肿块型DCIS患者在Luminal A型、Luminal B型占比不同,导管型在Luminal A型占比更多,Luminal B型在钙化型及紊乱型患者占比更多。有研究发现,Luminal B型乳腺癌患者发生癌细胞远处转移的概率更高,这与HER2阳性表达相关[11]。本文认为Luminal B型非肿瘤型DCIS患者Luminal B占比较高的分型为钙化型及紊乱型,该类患者疾病进展更快,且预后更差。
综上所述:非肿块型DCIS患者超声主要为钙化型,认为结构紊乱型患者细胞核分级较高,且HER2阳性表达较多,Luminal A型占比降低,Luminal B型占比升高。

