长潜伏期听觉诱发电位在轻度认知障碍和阿尔茨海默病中的研究现状△
张景华 王硕
认知障碍问题随着年龄的增长而增加,诊断有轻度认知障碍(mild cognitive impairment,MCI)和阿尔茨海默病(Alzheimer’s disease,AD)的患者随寿命延长日渐增多。目前识别认知障碍的常规方法主要依靠神经心理测试和临床经验判断,这可能导致假阳性诊断。功能性核磁共振成像虽然有助于提高MCI和AD诊断的敏感性和特异性,但由于其检查费用高,临床应用具有一定的局限性。脑脊液检查、致病基因检测和正电子发射计算机断层显像的应用也有报道,但由于有创、价格昂贵等原因,临床应用更加受限。研究发现长潜伏期听觉诱发电位(the long-latency auditory evoked potential,LAEP)在认知障碍的早期识别上具有独特优势,有可能成为识别早期认知障碍的一种经济、可行的客观评估方法。
LAEP产生于听觉皮层的不同区域,受到声音刺激后,在头皮记录到的一系列与刺激有时间锁相的波形,潜伏期50~500 ms,主要为能形成开放电场的大脑皮层锥形细胞电活动的综合反应。LAEP由一系列正波和负波组成,分为内源性成分和外源性成分,外源性成分与听觉感知密切相关,反映大脑对声音信号的被动感觉处理过程,主要包含皮层听觉诱发电位(cortical auditory evoked potential,CAEP)中的P1、N1、P2三个主要成分。内源性成分与注意力、学习、记忆等相关,反应大脑在不同任务模式下的主动认知处理过程,主要包含事件相关电位(event related potiential,ERP)中的失匹配负波(mismatch negativity,MMN)/N2a、N2b、P3a、P3b成分。LAEP各成分的主要分析指标是振幅和潜伏期,潜伏期与神经传导时间和反应源的位置有关(图1)[1]。本文就LAEP中的内源性和外源性成分在MCI和AD患者中的研究现状进行综述。
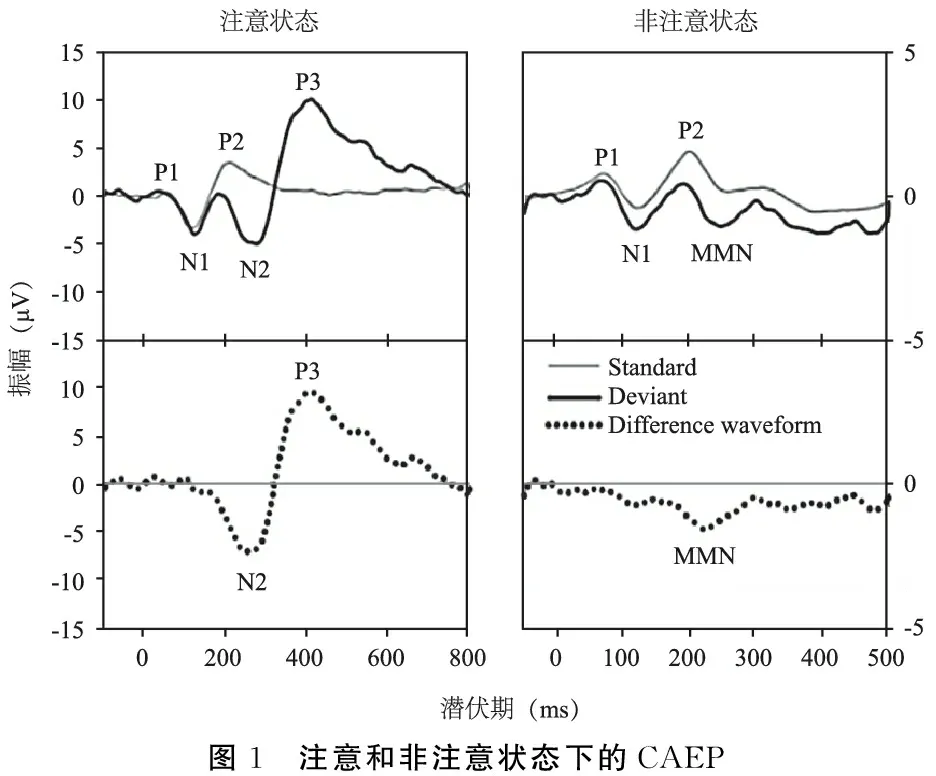
图1 注意和非注意状态下的CAEP
1 CAEP各成分在MCI和AD中的研究现状
CAEP也称P1-N1-P2复合体,产生于特定的初级听觉皮层颞横回。P1起源于初级听觉皮层,海马回、平颞皮层和侧颞皮层可能对P1的成分也有贡献[2];N1起源于额中央区和颞上回的听觉关联皮层等;P2的发生源在初级听皮层和它的联合区域第二皮层,以及中脑网状激活系统[3,4]。P1-N1-P2成分一直都受到听力学家的极大关注,早期用于评估听力阈值,反应被动的感觉处理过程。相较于ABR,它能更多的评估皮层水平对声音和言语声的处理能力,同时P1-N1-P2的观察指标也与受试者意识状态、年龄和听觉经验有关。
1.1P1成分 P1是LAEP的早期成分,典型的P1成分为在听力正常成人中颅顶记录到的,约50 ms处出现的一个波幅较小但较为稳定的正波,它参与听觉皮层的早期处理过程[5]。P1与感官门控机制密切相关,即从外部环境中过滤掉无关刺激的能力[6]。研究发现,MCI患者与健康老年人的P1潜伏期相似,但振幅更大(Thomas等,2010;Golob等,2007;Irimajiri等,2005),特别是遗忘型-多领域MCI(MD-MCI)患者和后期发展为AD的患者更明显,提示认知障碍患者从外部环境中过滤掉无关声音的能力减弱。Cancelli等(2006)比较了18例AD患者与15例健康老年人,发现AD患者P1振幅较健康老年人高,潜伏期差异无统计学意义,表明AD患者过滤多余信息的能力存在缺陷。李晓裔等[7]比较了37例遗忘型-单领域MCI(SD-MCI)患者、19例MD-MCI患者及50例健康老年人的P1波,发现SD-MCI组较对照组P1波幅增高,MD-MCI组较SD-MCI组P1波幅增高,随访2年后发现,转化为可能AD患者的P1振幅在入组时明显高于稳定型MCI患者,提示P1波幅可作为诊断不同亚型MCI的重要指标,也可作为预测不同亚型MCI转归的重要参考依据。Golob等(2007)通过对41例MCI患者为期5年的纵向研究,也发现P1波幅增大可能与MCI临床转归有关,转为AD的MCI患者其P1波幅增大程度明显大于病情稳定的MCI患者,而AD患者与健康老年人P1振幅无明显差异,P1振幅的变化似乎反映了MCI到AD之间过渡时期神经活动的变化,P1振幅在MCI到AD的过渡期间异常增加,然后在痴呆的早期阶段回到接近正常水平。P1的变化可能反映了其他受MCI病理影响的皮层和皮层下区域对听觉皮层反应的调控,也可能与AD早期大脑皮层短暂的过度兴奋状态有关,这种皮质兴奋性的暂时增加可能是一种代偿机制。
1.2N1成分 N1是波峰出现在70~130 ms间的负波,反应了听觉皮层被激活,与注意捕捉能力有关,易受刺激的物理属性影响,但不代表对内容的主观认知和辨别能力,为刺激到达皮层提供了生理证据。N1的研究结果在报道中并不一致,Irimajiri等(2005)对17例MCI患者和16例健康老年人的研究发现MCI患者N1振幅较对照组增高,但潜伏期无差异。Muscoso等(2006)发现AD患者的N1潜伏期较正常人延长。Schiff等(2008)对72例20~80岁的无听力损失的正常人在不同注意状态下进行听觉事件相关电位的比较研究,发现N1振幅在非注意状态下随年龄增长而降低,而非注意状态下N1潜伏期和注意状态下N1的振幅、潜伏期均与年龄无关。大多数研究发现N1的振幅和潜伏期在MCI和AD患者中无显著差异[8~10]。
1.3P2成分 P2是波峰出现在150~250 ms间的正波,N1、P2成分结合,也被称为N1-P2,代表感觉门控的晚期阶段,是注意力和抑制过程在早期分配处理中的关键因素[8]。有的研究报道MCI患者P2振幅下降[9],有的研究发现AD患者P2潜伏期延长,但更多的研究发现健康老年人与MCI[10]和AD患者之间P2的振幅和潜伏期没有差异。Buján等[11]用言语声/ba/及1 000 Hz纯音刺激,发现言语声刺激时P2潜伏期与MoCA评分有显著相关性,但纯音刺激时未发现。Bidelman等[12]的研究用到了合成的言语声刺激,发现MCI患者P2振幅增大。Oliveira等[13]用言语声/ba/、/da/和1 000 Hz及2 000 Hz纯音刺激,发现2 000 Hz纯音刺激时老年组P2潜伏期延长,言语声刺激时异常MoCA分数和P2增大振幅之间有中等相关性。
2 ERP各成分在MCI和AD中的研究现状
2.1非注意状态下的MMN/N2a和P3a成分 MMN源自听皮层的外颞平面和侧后颞回,由标准刺激和具有辨别差异的偏差刺激所诱发(oddball范式),有的文献中MMN也被认为是N2a。通常是标准刺激与偏差刺激的波形相减以后才更容易看出,潜伏期在100~250 ms之间[3]。MMN与选择性注意无关,是大脑对感觉信息自动加工的电生理指标,反应中枢对刺激变化的编码,其幅度和潜伏期取决于标准刺激和偏差刺激之间的相对差异,是研究前注意加工的常用指标,其产生机制目前倾向于“记忆痕迹假说”[14]。MMN可通过听觉刺激的任何可辨认的变化诱发,反映有别于标准刺激的感官记忆痕迹的偏差刺激。当标准刺激和偏差刺激很大时,非注意状态下在200~300 ms还会出现一个正波,在额正中电极最明显,被命名为P3a,与偏差刺激引起的注意重定向有关。P3a的发生源位于背内侧额区和脑岛(Polich等,2007),目前在精神分裂症患者中研究较多,发现其振幅下降,在MCI和AD中研究较少。
MMN在MCI和AD患者中的研究结果也存在一定差异。少数研究发现MCI和AD患者较健康老年人MMN的潜伏期延长[15],振幅降低[16],但大多数研究未发现差异[17~19]。因延长刺激间隔(interstimulus interval,ISI)时间会导致MMN幅度渐小,甚至不能引出,故对MMN的研究大多采用了短ISI。Laptinskaya等[20]比较了长、短ISI时间诱发的MMN,发现长ISI诱发的MMN对痴呆患者的发作性记忆下降更具应用价值,提示短ISI(≤2 s)诱发的MMN与前注意听觉辨别能力相关,长ISI(>2 s)与前注意听觉记忆相关。该研究也证实了听觉记忆痕迹衰减和情景记忆之间的显著正相关。其机制可能为:用MMN测试注意前听觉记忆痕迹时,尤其在长ISI之后及情景记忆都与N-甲基-D-天门冬氨酸(NMDA)受体的功能有关,NMDA受体在神经元可塑性、长时程增强以及学习和情景记忆中起重要作用,而健康老年人及AD患者NMDA受体亚基的表达及功能受损。大多研究者采用了短ISI未发现AD患者MMN振幅较健康老年人降低,可能因为轻度AD患者保留了听觉辨别能力,听觉记忆痕迹减弱未被发现。一项关于AD患者听觉后处理的研究中记录了P3a,发现P3a振幅在AD组与健康老年人间无差异,此项研究中未记录P3a的潜伏期[21]。Correa-Jaraba等[22]研究了不同类型MCI患者的P3a成分,在oddball范式两种刺激的基础上引入了第三种新奇刺激,在不同的电极上记录了早期和晚期P3a成分,发现P3a在区别MCI亚型上有较高的灵敏度和特异度。
2.2注意状态下的N2b和P3b成分 在经典的oddball范式下,当受试者注意偏差刺激时,还能诱发出一个负波N2b和一个大正波P3b。有的文献中N2b也称为N2、N200(Patel等,2005)。N2b出现在偏差刺激后180~350 ms,是一种前额-中枢负性信号,通常在245~290 ms之间达到峰值,发生源位于大脑额叶区域,特别是与人类情绪、认知及执行等脑功能活动密切相关的前扣带回区。记录电极通常用额中点(Fz)、中央点(Cz)、顶点(Pz)电极,两两电极之间的潜伏期无统计学差异[23]。随着年龄增长,N2b的潜伏期延长,振幅下降;随着任务难度提高,N2b振幅增大。一般认为N2b参与了选择性前注意评估和感觉辨别过程。P3b也称为P3、P300,是在N2b之后出现的明显正波,与标准刺激瞬时记忆的改变有关,发生源主要集中在海马、特异性感觉皮层、顶叶皮层的正中及额皮层,其潜伏期揭示大脑在识别刺激记忆时对刺激事件进行编码、分类、识别的速度,振幅反映大脑信息加工时资源动用的程度(Polich等,2007)。与N2b一样,随着年龄增长,P3b的潜伏期延长,振幅下降。
N2b在MCI和AD患者中的研究结果报道也不一致。大多数研究报道N2b的潜伏期在MCI组[24]和AD组[25,26]与健康老年人之间差异没有统计学意义。另有部分研究报道MCI患者N2b潜伏期延长,部分研究报道AD患者中N2b潜伏期延长。Bennys等通过随访1年,研究了41例进展型MCI和30例稳定型MCI患者,发现进展型MCI患者的N2b潜伏期较稳定型MCI患者延长,Fz电极记录的N2b潜伏期首次区分进展型MCI和稳定型MC1的灵敏度为70.7%,特异度为46.7%,1年后的灵敏度为80.5%,特异度为63.3%。Papaliagkas等(2008)也对54例MCI患者进行了1年多的随访,发现N2b潜伏期在预测MCI转换为AD时的灵敏度为100%,特异度为91%。这些研究表明,N2b的潜伏期在MCI进展到AD的过程中可能成为很好的预测因子。但基于目前纵向研究报道较少,该结论还有待进一步证实。大多数研究报道MCI和AD患者与健康老年人之间N2b的振幅无统计学差异[25,26]。有研究报道了MCI患者N2b的振幅较健康老年人增大(Papaliagkas等,2008,2011),另有研究报道了MCI患者N2b的振幅较健康老年人减小(Bennys等,2007,2011)。
P3b是目前在认知障碍中研究最多的成分,P3b潜伏期的研究结果国内外报道都较一致。绝大部分研究报道MCI和/或AD患者的P3b潜伏期较健康老年人延长[25,26],部分研究报道AD组P3b潜伏期较MCI组延长[18]。Gungor等(2005)发现更长的P3b潜伏期与AD患者更重的认知损害相关。Bennys等(2007)发现P3b潜伏期在区别AD组和健康老年人时,Fz电极记录的灵敏度为100%,特异度为90%;Pz电极记录的灵敏度为91%,特异度为100%;区别AD组和MCI组时,Fz电极记录的灵敏度为87%,特异度为100%;Pz电极记录的灵敏度为86%,特异度为100%。P3b潜伏期延长反映了神经退行性变的进展,还与神经心理测试中注意力及执行功能下降有关,可能反映了MCI和AD患者与工作记忆相关的注意过程缺陷和额叶加工功能障碍。但关于P3b振幅的报道,结果有较大差异。有研究报道MCI和/或AD患者的P3b振幅与健康老年人无统计学差异[25,26],也有研究报道MCI和/或AD患者的P3b振幅较健康老年人降低[27]。
3 总结与展望
综上所述,目前研究结果指向LAEP中的P1振幅和N2b、P3b潜伏期在MCI和AD患者的诊断以及MCI进展的预测中具有较高的灵敏度和特异度,但LAEP各成分的确切起源部位和神经生理机制尚不十分清楚。P1-N1-P2是LAEP的外源性成分,受聆听强度影响,而多数老年患者伴有听力损失;N2b、P3b的数据采集需要患者集中注意力完成任务,部分AD患者配合困难;而MMN及P3a为非注意状态下采集数据,无需患者完成任务,在认知障碍的老年患者中显得更加客观、可行。目前研究结果不一致,可能与受试者例数、受试者状态(年龄、注意力状况、心理状况)、应用范式、刺激声(刺激声类型、持续时间、间隔时间、强度、频率)等有关,例如选择纯音刺激或言语声刺激,不同的刺激间隔时间会出现不同的结果。
本文仅阐述了LAEP在MCI和AD中的研究现状,目前对LAEP的探索涉及脑功能相关的各个领域。耳科学中LAEP主要用于评估听觉通路功能状态,包括婴幼儿听觉发育程度评估、助听器佩戴效果评估、人工耳蜗植入效果评估、听觉中枢处理障碍疾病,如听神经病患者听阈及言语感知能力评估、老年性聋的评估等[28,29]。神经科、精神心理科、康复科等对LAEP的研究,除了MCI和AD,在精神分裂症、抑郁症、睡眠障碍、癫痫、自闭症、卒中后认知障碍、意识障碍、帕金森病、失语症等的诊断及治疗评估中都有应用。研究者对LAEP的范式及刺激声的探索及创新从未停止。LAEP涉及的相关学科较多,对LAEP的深入研究,还需要进一步在横向、纵向上更细化,对于不同疾病获得最大临床意义的范式、电极位点及具体刺激声的选择也需要明确及标准化。LAEP真正应用于临床解决实际问题还有一段路程,随着研究深入,相信LAEP未来能成为可靠的、无创的、经济的评估方法进行广泛应用,使更多的人从中受益。

