黄酮类化合物神经保护活性的定量构效关系研究
施建成,施海枫
(1.南宁师范大学 化学与材料学院,广西 南宁 530100;2.浙江省缙云中学,浙江 缙云 321400)
0 引 言
中枢神经细胞死亡与大脑局部缺血有关[1-3]。目前没有特效的药物可以阻止该病症的发生,缺血性中风是该病症的的典型例子,全世界每年约有500万人死于中风,估计到2020年这个数量可能会翻一倍[4]。近年来,研究结果表明非瑟酮衍生物可显著抑制脑缺血性神经元的损伤[5-7]。该类化合物具有神经保护活性的原因是其不仅具有直接的抗氧化活性,还能增加细胞内GSA(谷胱甘肽,细胞内主要的抗氧剂)的量,并且还能维持线粒体的功能。另外,该类化合物还对一些免疫细胞具有抗炎活性,并且能抑制5-脂肪氧合酶的作用,从而减少脂质过氧化物和促炎副产品的产生[3,8]。
黄酮类化合物虽具有神经保护活性,但其结构复杂、作用位点多、溶解性差,其生理活性的利用率不高,限制了它们的广泛应用[9]。至今国内外对黄酮类化合物神经保护活性的研究主要以实验研究为主[3,5-7],如Chandramouli[3]和Dong[7]研究了该类化合物对中枢神经疾病的抑制活性。但与之相关的理论研究却很少,特别是关于该类化合物神经保护活性的定量构效关系(QSAR)的研究还未见报道。因此建立黄酮类化合物神经保护活性的定量构效关系(QSAR)模型,为中枢神经疾病新抑制剂的设计提供理论依据的研究就显得很有意义。
选取文献[3]的25种黄酮类化合物,建立定量构效关系(QSAR)方程,从分子水平上推测该类化合物与靶标作用的可能方式,从而揭示神经保护活性的作用机理,为黄酮类化合物有利于神经保护活性的设计与合成提供理论的参考。研究的化合物的结构和原子编号如图1所示,神经保护活性的实验值与预测值,见表1。

表1 黄酮类化合物的实验和预测活性数据

图1 黄酮化合物的结构(a),黄酮类化合物的基本结构(b 和 c)
1 材料与计算方法
来自于文献[3]的25种黄酮类化合物的神经保护活性用EC50值来衡量。在QSAR研究中,将25种衍生物的EC50值单位标准化为mol/L,并以lg(1/EC50)表示衍生物的神经活性,各衍生物的lg(1/EC50)值见表1。
1.1 计算方法
本研究选取25种衍生物进行几何构型全优化并作频率分析,以确定其稳定构型。由此计算获得了各衍生物的电子结构参数[10]。选取参数中影响神经保护经活性强的参数为自变量,lg(1/EC50)为因变量进行相关分析,以获得各参数与lg(1/EC50)的相关系数,最终的构效关系分析用SPSS 19.0软件来完成。
1.2 参数的选取
分子的总能量(ε)、最高占据轨道(HOMO)能量(εH)、最低空轨道(LUMO)能量(εL)、LUMO和HOMO的能量差 (ΔεL-H)、分子的偶极矩(μ)、平均极化率(α)、分子体积(V)、分子的相对质量(MW)、分子中取代位碳原子上的净电荷分布(Q3-Q6’)、原子的最大负电荷 (Qmax-)、A环和B环上碳原子的净电荷之和(∑QA、∑QB);电负性(χ)、化学式(μ)、硬度(η)、软度(S)、亲电指数(ω);文献[3]得到的参数:拓扑面积参数(tPSA)、亲脂性参数(ClogP)等总计约36个参数.QSAR建模用到的结构参数见表2。

表2 黄酮类化合物在QSAR研究中的参数描述
2 定量构效关系(QSAR)方程的构建
为构建黄酮类化合物的定量构效关系(QSAR)方程,从表1中抽取1~20号化合物为训练集样本,21~25号为测试集样本,以表1中前1~20号化合物(化合物19、20为两个奇异点舍去)的实验生物活性数据lg(1/EC50)为因变量,以计算得到的各衍生物电子结构参数为自变量,用SPSS19.0统计软件进行相关分析,获得生物活性与各参数的活性相关系数(见表3),然后从中筛选出活性相关系数较高的参数进行逐步多元线性回归分析,建立了(1)和(2)两个定量构效关系方程及其交叉验证的结果。

表3 模型构建所用到的相关系数
Lg(1/EC50)=4.959+4.648Q8+1.494S+0.551ω
(1)
N=18,R=0.897,R2=0.804,Rcv2=0.629,SE=0.294,P=0,RSD=0.267,AIC=0.136,FIT=1.568;
Lg(1/EC50)= 5.304+4.735Q8+3.011S+0.654ω-0.005α
(2)
N=18,R=0.944,R2=0.892,Rcv2=0.782,SE=0.227,P=0,RSD=0.198,AIC=0.075,FIT=3.158,
其中N是分子训练集个数,R是相关系数,R2是相关系数的平方,Rcv2是交叉验证系数,SE是标准偏差,P是显著水平,RSD为残差的标准偏差,AIC是Akaike信息判据系数,FIT是Kubinyi函数。对比(1)和(2)两个QSAR方程:方程(2)的相关系数R比方程(1)的大,而标准偏差SE和残差的标准误差RSD却小于方程(1),说明方程(2)比方程(1)具有更高的相关性。另外,交叉验证系数Rcv2和FIT值越大,AIC值越小,所建的模型越稳定,预测能力越高[11]。本研究中,方程(2)的AIC值比方程(1)小,但Rcv2和FIT值却比方程(1)大,说明方程(2)的稳定性和预测能力优于方程(1)。一般认为,当Rcv2大于0.5时,表明模型具有可信的预测能力[12]。(2)式的Rcv2值为0.782(大于0.5),表明方程(2)具有可信的预测能力。
3 结果与讨论
3.1 化合物的几何构型
考察所选衍生物结构优化得到的相关电子结构参数,发现分子中B环与C环间形成的二面角DBC与化合物的神经保护活性具有一定的相关性(见表4和表5)。由表4可知,化合物1、2、3、4、20、21的DBC均在179~180°之间,接近于共面(即分子的A、B、C三个环基本处于同一平面),相应地,各化合物的lg(1/EC50)值都在7.3以上。表5中化合物15、16、17、18、25的DBC均在130~170°之间,各相应化合物的lg(1/EC50)值却都在6.3以下。该结果说明黄酮类化合物分子的A、B和C三环趋于共面有利于衍生物活性的提高。Lerman[13]曾指出,平面型药物分子能插入至DNA的碱基对之间,它们彼此间存在着π-π分子间的堆积作用,使得这种共面结构的化合物分子更容易与受体分子结合,因而化合物的活性相应得到提高,与本研究的结论相吻合。

表4 lg(1/EC50) >7.3化合物的二面角(DBC)

表5 lg(1/EC50) <6.3化合物的二面角(DBC)
3.2 电荷分布
分子中局域电荷或电子密度直接影响着化合物的物理化学性质[15]。表2给出了所选化合物A环C8上的Mulliken电荷分布Q8(由于其它碳原子的电荷分布与lg(1/EC50)值不具有太大的相关性,故本文只讨论A环C8上的电荷分布情况)。由表3的数据可知,Q8与lg(1/EC50)的活性相关系数是最大的(值为0.382),说明A环C8位最能影响黄酮类化合物的神经保护活性,是结构修饰的重点部位。
从表1和表2各衍生物的结构特征分析,当A环上的7,8位碳原子上连有7-(CH2)4-8取代基时,Q8值比没有连该取代基的大,活性也更强。这是因为环状的7-(CH2)4-8基团能参与整个分子的共轭,扩大了整个分子的共轭面,使A环上C8的负电荷分散降低(即化合物的Q8值增大),由于QSAR方程②中Q8与lg(1/EC50)是正相关的关系,因此衍生物的神经保护活性得到了增强。另外,由于连有7-(CH2)4-8取代基的衍生物分子能提供更多的作用点,使分子与DNA碱基对之间的π-π堆积作用更强,也导致衍生物的神经保护活性得到增强[17]。由以上的讨论可得出结论:为使黄酮类化合物的神经保护活性得以提高,A环C8位上应该引入环状取代基。
3.3 前线轨道分析
福井谦一的前线分子轨道理论认为:分子在反应过程中优先起作用的是前线分子轨道(最高占有轨道HOMO,最低空轨道LUMO),前线分子轨道对于分子的反应活性有着决定性的作用,而HOMO与LUMO之间的能量差△ε(△ε=εLUMO-εHOMO)则是电子从最高占有轨道跃迁到最低空轨道时所要克服的能量,该值越小,分子越不稳定,越易参与反应,活性也越高。
根据表2的数据可知,化合物5、7和8的△ε值较大(均大于3.85ev),化合物的神经保护活性理应较差,但表1的活性数据显示它们的lg(1/EC50)值都大于7.0,活性都较好。这是因为化合物5和8分子中A环的7、8位都连有7-(CH2)4-8基团,分子的共轭面增大,A环上C8位的负电荷分别都得以分散降低(即化合物5和8的Q8值都分别增大),根据Q8与lg(1/EC50)成正相关的结论,得到了5和8化合物的活性都较好的结论。至于化合物7具有好活性的原因,是因为该分子的B和C环二面角DBC为171.32°,分子结构接近共面,扩大了共轭面,从而提供了更多的作用点与生物受体发生作用,进而导致活性较好。
另外,由表2的数据可看出,25个化合物的εLUMO都为负值,表明电子进入这些分子的LUMO后,体系的能量将降低.这意味着非瑟酮衍生物与生物受体之间的作用不应是亲电反应,而是与受体活性中心发生了亲核反应[18]。这是因为从生物角度分析,组成酶、蛋白质等生物大分子的重要功能团中的巯基、羟基、氨基等化学性质活泼,其中的硫原子、氧原子和氮原子带有孤对电子,表现出亲核性[19]。当非瑟酮衍生物分子与含硫原子、氧原子和氮原子的蛋白质、酶或简单分子发生亲核反应时,黄酮类化合物分子的LUMO与亲核试剂分子的HOMO轨道相互作用形成过渡态[20- 21],亲核试剂分子上硫原子、氧原子和氮原子的孤对电子转移至黄酮类化合物分子的LUMO轨道上。
3.4 其他参与构建QSAR方程的参数分析
由QSAR方程②可知,文中所选化合物的平均极化率(α),软度(S)和亲电性(ω)的系数分别为-0.005,5.778和0.697,表明α与lg(1/EC50)呈负相关,而S和ω与lg(1/EC50)呈正相关,即α越小,S和ω越大,越有利于化合物神经保护活性的增强。这是因为分子的软度S越大,变形性越高,稳定性越差,分子参与反应的可能性就越大,活性也就越好。同理亲电性ω大的化合物稳定性低,活性也就高。对于平均极化率α,因其与分子的固有体积成正比[22],如果α越大,分子的体积就越大,分子进入生物体内的空间位阻也越大,导致其与生物受体结合的几率减小,化合物的活性自然就差。
另外,从图1可看出,b系列化合物的C3位上比a系列化合物多了一个羟基(-OH)。从结构的角度分析,C环羰基的π电子不仅可与A环(苯环)上的π电子一起形成离域π键,还可通过C环上C2和C3之间双键的π电子与B环(苯环)上的π电子一起形成离域π键。同时,C环上O1原子的孤对电子还可与邻近的π电子一起形成离域π键。由于非瑟酮衍生物分子中存在着较明显的离域效应,因此C环C3位的取代基对神经保护活性有直接的影响作用[18]。为说明C3位上-OH的影响,我们选取除C3位外,其余结构相同的a、b系列化合物两两放在一起进行对比研究(见表6)。从表6发现,b系列化合物的亲电性ω都比a系列的大,因ω与lg(1/EC50)成正相关,因此b系列化合物的活性都大于a系列的活性。这是因为C3位的羟基(-OH)具有较强的供电子能力,羟基中的电子比较容易通过离域效应和诱导效应提供给其邻位羰基的氧原子,导致氧原子周围的电子云密度明显增大,从而使羰基中的氧原子与受体活化中心的结合能力明显增强。同时该羟基还能改善分子的平面性,进而提高整个分子的共轭程度,因此使化合物的神经保护活性得到显著地提高[18]。基于以上分析,为增强黄酮类化合物的神经保护活性,C3位上应引入-OH,-OCH3,-CH2OH,-NH2,-NHCH3,-N(CH3)2,-SH等供电子基团。

表6 a和b系列化合物的活性比较
根据以上分析,黄酮类化合物抑制中枢神经疾病的作用机理可能是:分子中C环的羰基与组成酶、蛋白质等生物大分子重要功能团的巯基、羟基、氨基等化学性质活泼的硫、氧、氮原子发生亲核反应;分子中A环(或B环)上的取代基不仅与受体存在着包括氢键在内的分子间相互作用力,同时还通过A环(或B环)的离域效应和诱导效应对C环上羰基的氧原子与受体中化学性质活泼的硫、氧、氮原子所发生的亲核反应产生影响[18]。
4 分子设计
根据以上的结果,设计5个新分子(见表7),并用所建立的模型方程(2)进行了预测。结果是lg(1/EC50)均大于7.0,理论活性都较为理想,其中化合物1*的活性达到了8.07313,理论上具有优良的神经保护活性(需实验确认),为新型高活性分子的合成提供了理论依据。
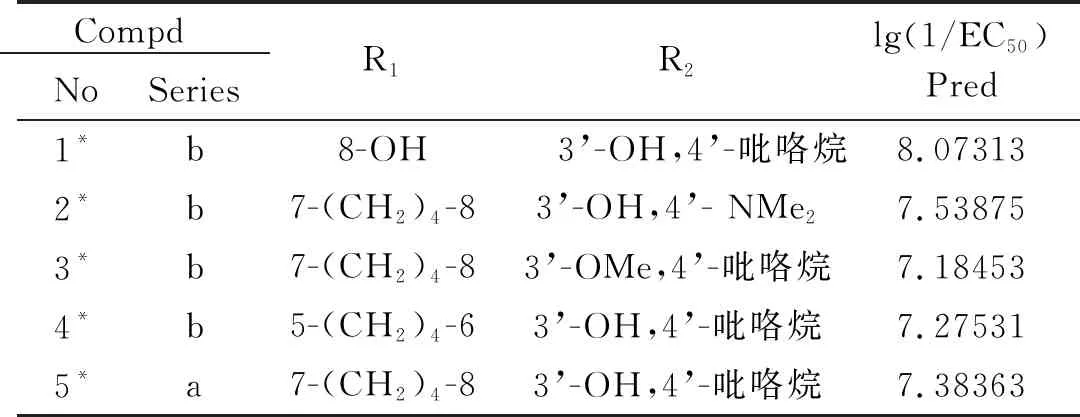
表7 设计出的分子结构
5 结论
对25种新合成的黄酮类化合物进行定量构效关系(QSAR)研究,筛选出影响神经保护活性的主要因数并建立了定量构效关系(QSAR)方程。结果表明:黄酮类化合物分子A环C8位的电荷分布(Q8),化合物分子的平均极化率(α)、亲电指数(ω)及软度(S)都直接影响所研究化合物的神经保护活性。基于QSAR的研究结果推测黄酮类化合物抑制中枢神经疾病的可能机理:分子中C环的羰基与组成酶、蛋白质等生物大分子重要功能团的巯基、羟基、氨基等化学性质活泼的硫、氧、氮原子发生亲核反应;分子中A环(或B环)上的取代基不仅与受体之间存在着包括氢键在内的分子间相互作用力,还通过A环(或B环)的离域效应和诱导效应对C环上羰基的氧原子与受体中化学性质活泼的硫、氧、氮原子所发生的亲核反应产生影响。进一步的研究发现,黄酮类化合物A环的C8位和C环的C3位分别引入环状基团和供电子基团后,黄酮类化合物的神经保护活性能得到明显地改善,并由此新设计出了5个活性较高的黄酮类化合物。所得结果能为进一步设计具有较高神经保护活性的新颖化合物提供理论指导。

