过渡金属催化环状碳酸酯参与的反应研究进展
熊宇晟,张远飞
(南宁师范大学 化学与材料学院,广西 南宁 530100)
0 引 言
有机环状碳酸酯是一类重要的合成中间体,它们具有制备方便、稳定、反应活性高以及易于后续多样性转化等特点,近年来逐渐成为了有机合成化学研究的重要领域之一[1]。目前研究得比较多的环状碳酸酯包括:烯基取代的环状碳酸酯、炔基取代的环状碳酸酯、2-亚甲基环状碳酸酯以及碳酸亚乙烯酯(图1)。它们都能在过渡金属催化下进行氧化加成、迁移插入、脱羧开环等基元反应过程,形成不同活性中间体,进而形成结构、取代模式都各异的产物,构成其过渡金属催化化学的丰富内容。研究的重点是这几类环状碳酸酯近年来的进展,包括其参与的C-H键活化与烯丙基取代反应。

图1 广泛使用的环状碳酸酯
1 金属催化烯基取代的环状碳酸酯的转化
2015年,Wang课题组[2]应用Rh(Ⅲ)/Pd(Ⅱ)双金属催化体系,实现了烯基取代的环状碳酸酯的C-H活化/烯丙基取代成环反应。反应巧妙利用Rh(Ⅲ)催化C-H烯丙基化反应形成烯丙醇结构片段,其通过Pd(Ⅱ)催化分子内N-烯丙基化反应关环(图2a)。反应在温和的反应条件下进行,提供了高区域选择性和立体选择性的含氮杂环合成的新方法。

图2 烯基取代的环状碳酸酯的C-H活化反应
之后,Ackermann课题组[3]将该反应拓展到单金属钴催化上(图2b)。反应使用廉价的钴作为催化剂替代两种贵金属,即昂贵的Pd2(dba)3和[Cp*Rh(CH3CN)3][SbF6]。在反应过程中多功能阳离子钴(III)配合物既能促进C-H烯丙基化反应又能促进N-H烯丙基化反应。同时,反应具有很好的化学选择性,能实现间位含取代基底物的选择性C-H活化。这些研究结果显示了钴催化体系对双金属催化体系的优势。同年,该课题组[4]还发现锰(I)催化剂也能有效催化环状碳酸酯的C-H烯丙基化反应,在H2O和空气中实现了吲哚C2位的活化(图2c)。该反应能在非极性或者极性质子性溶剂中进行, TFE或H2O作为溶剂对控制产物双键的立体选择性有利。几乎在同一时间,Glorius课题组[5]也报道了一例相似的反应(图2d)。
2017年,Cheng等首次将机械化学条件应用于高效钴(III)催化的C-H烯丙基化反应中[6](图2e)。与传统的溶剂反应体系相比,球磨反应能显著提高反应效率。同时,无溶剂球磨方法更环保是未来该领域研究的重要方向之一。
环状碳酸酯还能在过渡金属催化下进行烯丙基取代反应。Kleji课题组报道了光/钴催化醛与烯基取代环状碳酸酯的立体选择性烯丙基化反应。反应以二氢吡啶作为还原剂,在光驱动下形成活性钴催化物种,引发还原性烯丙基钴对醛的非对映选择性插入[7](图3a)。

图3 烯基取代的环状碳酸酯的烯丙基取代反应
通过调节钴催化剂与光敏剂类型,Kleji课题组[8]发现烯基取代环状碳酸酯也能通过脱氧方式对醛的碳氧双键进行非对映选择性插入(图3b)。
其后,Kleji课题组又[9]报道了首例钯催化环碳酸乙烯酯与亚硫酸盐的区域和对映选择性烯丙基磺酰化反应,合成了具有不同官能团的含砜季碳立体中心。反应可以耐受含给电子和吸电子的亚磺酸盐,具有优异的区域和对映选择性(图3c)。
在过渡金属存在下,环状碳酸酯还能发生Micheal加成/烯丙基环化反应,合成螺环与大环。Zhao课题组[10]报道了路易斯酸辅助,钯催化碳酸乙烯酯和含苯并呋喃酮的 [5,5]和[6,5]螺环化反应。通过调节路易斯酸实现了碳酸乙烯酯的极性转换(图4a)。
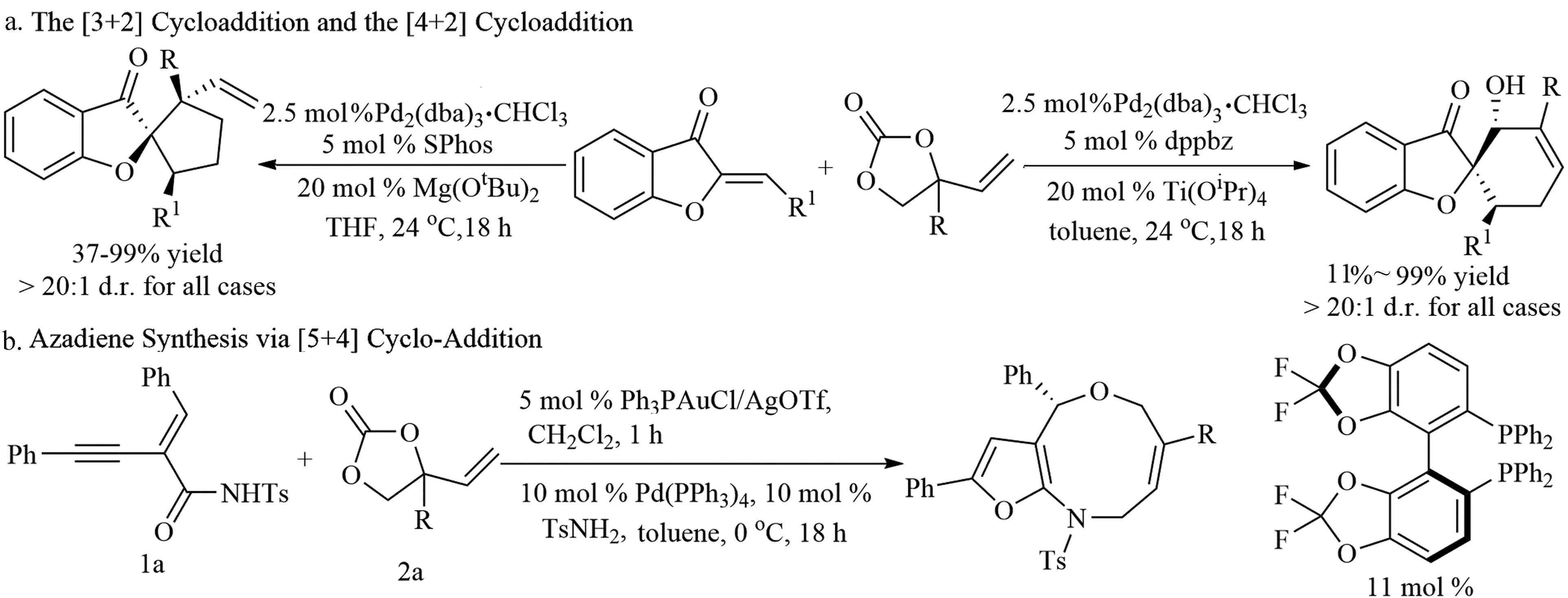
图4 烯基取代的环状碳酸酯的Micheal加成/烯丙基环化反应
其后,Zhao课题组[11]又报道了Au/Pd双金属催化高对映选择性的九元杂环的合成反应。机理研究发现,Au能促进1a形成不饱和呋喃酮结构,进而在Pd催化下发生对映选择性关环(图4b)。
2 金属催化炔基取代的环状碳酸酯的转化
炔基取代的环状碳酸酯也能通过氧化加成、脱羧进行取代反应。2019年,Kleji课题组报道了铜催化亚磺酸盐和丙炔环碳酸酯的不对称丙炔基取代反应[12]。该反应是过渡金属催化硫作为亲核试剂的对映选择性丙炔取代反应的第一个成功例子,在高对映控制下合成出目标叔砜产物(图5a)。
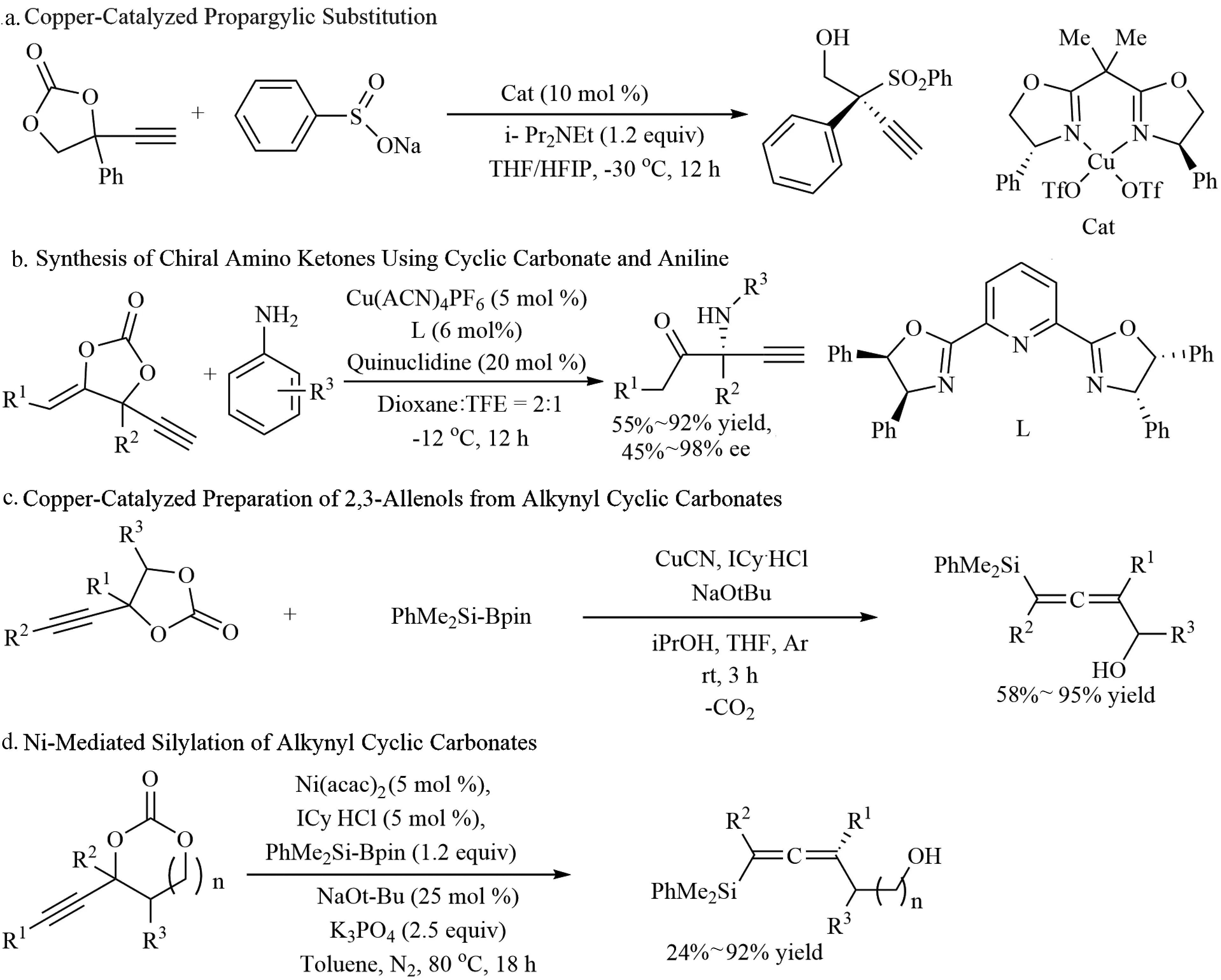
图5 金属催化炔基取代的环状碳酸酯的反应
Guo等[13]报道了铜催化胺做为亲核试剂的不对称丙炔基取代反应,实现了高效、对映选择性α-氨基酮的合成。反应通过合理设计环状碳酸酯的结构,在Cu催化下脱羧产生Cu键两性离子烯酸酯中间体。α碳和β碳的sp2性质使其形成具有平面取代基的前手性中心,从而减少了形成四元立体中心的空间效应。阴离子烯酸酯组分可以与胺分子形成强氢键,实现对映面的识别(图5b)。
Kleij[14]报道了一种制备四取代甲烷硅基化丙二烯的新方法(图5c)。该反应利用了α-羟基酮和末端炔的反应性,在Cu(I)催化下形成π配合物,使活性硅基试剂对炔基碳酸酯进行脱羧、亲核取代,从而得到目标产物。
两年后,Kleij[15]再次报道了Ni催化炔基环状碳酸酯的硅烷基化反应(图5d)。该反应重要的一步涉及到β-O消除,引发炔丙基取代过程。
3 金属催化碳酸亚乙烯酯的转化
碳酸亚乙烯酯在锂电池与高分子化学物合成应用广泛,其过渡金属催化化学近年来也有一定程度的发展。Hiyashi课题组[16]报道了二膦/铱配合物和硼酸(B2(OH)4)催化,芳基硼酸 (ArB(OH)2)与碳酸亚乙烯酯的芳基化反应,生成芳基乙醛(图6a)。反应条件的温和性,为芳基乙醛的合成提供了一条新的途径。
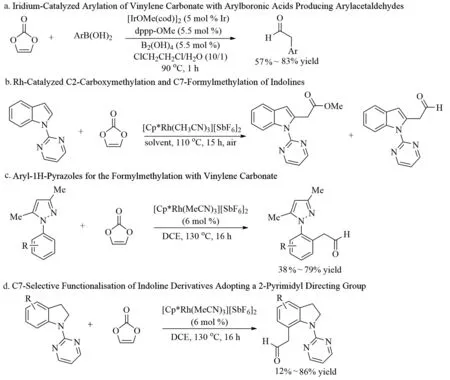
图6 碳酸亚乙烯酯C-H活化反应
2021年,Wang等[17]报道了铑催化的吲哚和吲哚衍生物与碳酸亚乙烯酯的C-H烷基化反应。根据底物和反应条件的不同,吲哚在甲醇中进行三组分反应生成C2羧甲基化产物,而吲哚与碳酸乙烯在甲苯中反应生成C7甲酰甲基化产物(图6b)。
Kato课题组[18]报道了Rh催化定向基辅助的C-H甲酰甲基化(图6c)。反应以碳酸亚乙烯酯作为乙炔醇等价物,不需要外部氧化剂和碱。该催化系统能进行顺序脱氢酯化过程,通过H2气体的释放使具有催化活性的Rh(III)物质再生。反应体系也适用于2-嘧啶导向基团的吲哚啉衍生物的C7选择性官能化反应(图6d)。
Yu等[19]报道了廉价钌催化的碳酸亚乙烯酯与苯甲酰胺,通过C-H/N-H键官能化制备吲哚衍生物的反应。在温和的反应条件下,成功地实现了各种取代的芳香族苯胺的转化,以良好的产率得到了相应的吲哚产物(图7a)。反应的特点:(1)可以直接得到非取代的亚乙烯基稠环化合物,而不需要任何预官能化;(2)催化转换不需要外部氧化剂和碱。通过C-H/N-H环反应也可以合成一系列其他类型的N-杂芳烃(图7b)。
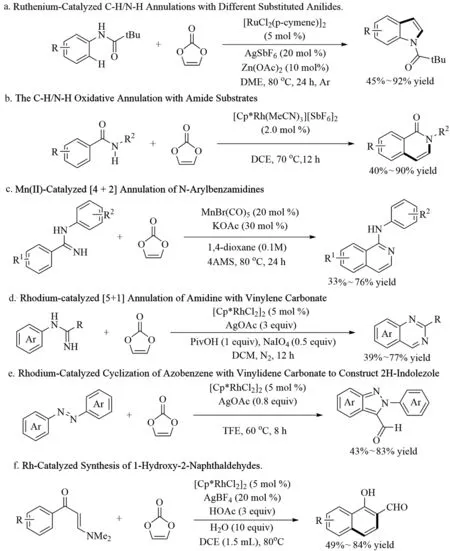
图7 碳酸亚乙烯酯环化反应(Ⅰ)
2021年,Li课题组[20]报道了一种通过锰催化碳酸亚乙烯酯作为乙炔替代物的脒的环化反应。该反应显示出良好的官能团耐受性和高原子效率,制备了各种取代的氨基异喹啉衍生物(图7c)。同年,Wang等[21]也开发了一种铑催化的脒和碳酸亚乙烯酯之间的环化反应,以中等至良好的产率制备4-甲基喹唑啉。在该过程中,碳酸亚乙烯酯用作酰化试剂,而不是乙炔替代物。因此,提供了一种简单而温和的途径,合成复杂多样的4-甲基喹唑啉(图7d)。
2022年,Zhang[22]报道一种有效的Rh(III)催化碳酸亚乙烯酯与偶氮苯的环化反应,合成传统合成方法无法实现的2H-吲唑-3-甲醛(图7e)。其中,碳酸酯的两个碳原子分别参与了吲唑环和醛基的构建。Liu课题组[23]报道了一种通过Rh(III)催化的C-H键活化和烯胺酮与碳酸亚乙烯酯的乙烯基转移制备取代的1-羟基-2-萘醛的方法。通过大规模的制备实验和几个羟基导向衍生化反应,探索了该方案在构建1-羟基-2-萘和其他杂环分子中的潜力(图7f)。
Kim[24]报道了通过选择性Rh(III)催化N-芳基吲唑酮或N-芳基酞嗪酮与碳酸亚乙烯酯的C-H环化反应合成吲唑啉(图8a)和酞嗪啉(图8b)。从机理的角度来看,碳酸亚乙烯酯作为乙醛的替代物,能够进行[4+2]环化反应。观察到优异的化学选择性、区域选择性和广泛的官能团耐受性。Ma[25]报道了铑催化/游离氨基引导的吡咯/吲哚苯胺与碳酸乙烯酯的[5+1]环化反应,有效地合成了一系列有价值的4-甲基吡咯并[1,2-α]喹喔啉。与其他现有的转化不同,在该反应中,碳酸亚乙烯酯作为C1环单元来完成C-H转化(图8c)。
Hara等[26]开发了一种通过阳离子铑(I)/BINAP络合物催化1,6-和1,7-二炔与碳酸亚乙烯酯的脱羧[2+2+2]环加成制备取代苯酚的新路线(图9a)。

图9 碳酸亚乙烯酯环化反应(Ⅲ)
Muria课题组[27]报道了一种以碳酸亚乙烯酯为亚乙烯转移试剂的Rh催化的直接π-延伸法。该方法的显著特征是:非取代的亚乙烯稠合骨架可以通过C-H/C-H氧化环化一步构建,并且任何外部氧化剂和碱对于催化转化都不是必需的。合成的多芳香族化合物具有较强的发光性能,并且在固态中表现出良好的有序堆积结构(图9b)。Muria等[28]又报道了Cp*Rh催化,碳酸亚乙烯酯作为氧化乙炔替代物,苯甲酸直接合成3,4-未取代的异香豆素的反应。该反应既不需要氧化剂,也不需要碱,因为反应物可以同时满足这两种功能,产生碳酸作为唯一的副产物。该反应具有广泛的官能团相容性,并用于合成新的吲哚类生物碱分子(图9c)。
4 金属催化2-亚甲基环状碳酸酯的转化
作为一类结构特殊的碳酸酯,2-亚甲基环状碳酸酯具有独特的反应活性。2021年,Shu首次报道了吲唑酮导向的Rh(III)催化的C-H/N-H环化和C-H烯丙基化反应[29]。该反应主要通过使用5-亚甲基-1,3-二恶烷-2-酮作为可扩展的交叉偶联伙伴来进行,以令人满意的产率合成了相应的[4+3],[4+2]环化化合物与含烯丙醇的支链产物(图10a)。同年,Zhang课题组[30]已经开发了一种通过Rh(III)催化的C-H烯丙基化/环状马氏加成反应简洁合成含有甲基的C3季中心的异喹啉酮的方法。该反应耐受广泛的官能团和取代模式,适用于类固醇和阿达帕林衍生的N-甲氧基酰胺的后期多样化衍生(图10b)。

图10 2-亚甲基环状碳酸酯环化反应
Kim课题组报道了在阳离子Ru(II)催化下,偶氮甲亚胺与5-亚甲基-1,3-二恶烷-2-酮的反应,实现了桥四环的合成[31]。从机理上看,C-H烯丙基化反应生成的β取代烯丙基片段与偶氮甲基发生外型[3 + 2]环加成,从而在桥头碳中心形成带有羟基亚甲基的桥四环(图10c)。
5 结 语
环状碳酸酯作为一种多功能偶联试剂,已被广泛应用于过渡金属催化的C-H键活化与烯丙基取代反应中,环状碳酸酯开环形成的含官能团的烯丙基结构片段又能在过渡金属作用下关环,使其为一系列结构新颖、复杂的有机分子与杂环化合物提供了高效合成方法。目前报道的过渡金属催化的C-H键活化与烯丙基取代反应主要使用铑、铱、钌等催化剂,廉价的第一过渡系的金属催化体系报道很少。
该领域有几个发展方向未来值得深入研究:1)新型的官能团化环状碳酸酯的合成及其合成转化;2)应用光催化或电催化等新兴技术手段,开发廉价金属催化体系;3)通过C(sp3)-H键活化的官能团化环状碳酸酯的转化反应。

