基于Box-Behnken响应面法优化玄参多糖提取工艺及体外抗氧化活性研究
马舒伟,刘兴艳
(1.浙江药科职业大学 中药学院,浙江 宁波 315500;2.宁波职业技术学院 化工学院,浙江 宁波 315800)
玄参为玄参科玄参属植物,性微寒,味甘、苦、咸,具有清热凉血,滋阴降火,解毒散结。用于热入营血,温毒发斑,热病伤阴,舌绛烦渴,津伤便秘,骨蒸劳嗽,目赤,咽痛,白喉,瘰疬,痈肿疮毒[1]。目前,国内报道玄参多糖提取方法主要为酶法[2],然而,其并未考虑因素之间相互影响,酶提取方法工艺有待验证和优化。微波萃取技术被用作提取植物多糖,节省时间和劳动力,有更多的空间去升高多糖的提取率,操作简单,节约能源[3]。本实验采用添加复合酶的水作为溶媒,微波提取玄参多糖的方法,利用Box-Behnken效应面法提高玄参多糖的提取率,用Design-Expert软件进行数据处理,获得玄参多糖提取工艺中最佳参数。
1 实验材料
1.1 仪器
紫外可见分光光度计(日本岛津);202-0S 电热鼓风干燥箱(湖南湘仪);3-18K 高速冷冻离心机(德国 SIGMA);DK-420 数显恒温水浴槽(上海坤诚);BS124S 型电子天平(北京赛多利斯);WD700TL17-3微波炉(广州格兰仕);PHS3Cs 型pH计(上海雷磁)。
1.2 药材与试剂
玄参由浙江磐安药材种植基地提供,经宁波市中医院贾占东副主任医师鉴定为玄参科植物玄参Scrophularia ningpoensis Hemsl.的干燥根。玄参干燥药材粉碎后过80目筛网,常温阴凉放置待用;D-无水葡萄糖标准品(中国食品药品检定研究院);纤维素酶:400 U/mg(北京奥博星生物技术有限责任公司);木瓜蛋白酶:50万U/g(上海源叶生物科技有限公司);果胶酶:500 U/mg(上海跃腾生物技术有限公司);乙醇、苯酚、浓硫酸等其他化学试剂均为分析纯;实验中提取用水为去离子水。
2 实验方法
2.1 玄参多糖的制备
取玄参药材粉末置于圆底烧瓶中,加入含有酶的蒸馏水,浸泡30 min 后微波提取3 次,每次30 min,放置室温,抽滤,收集合并滤液,减压回收蒸馏水,浓缩,离心(5 000 r/min,20 min)至无沉淀为止,继续浓缩,获得浓缩液,加入乙醇至醇浓度为80%,沉淀过夜,抽滤,收集沉淀物,获得滤饼,并依次用无水乙醇和丙酮洗涤数次,烘干,称重。
2.2 玄参多糖含量的测定[4-5]
采用苯酚-硫酸法测定玄参多糖的含量,对照品选用葡萄糖标准品。
2.3 玄参多糖提取率的计算
取玄参多糖提取物用蒸馏水充分溶解后,采用苯酚-硫酸法测定玄参多糖溶解液的多糖含量,测定波长为490 nm。绘制葡萄糖标准品的浓度和吸光度的标准曲线,作为参照标准测定多糖溶液中葡萄糖浓度。
依据式(1)计算玄参多糖的提取率(EE)。
式中,EE 玄参多糖的提取率(%);Ci为样品葡萄糖测定浓度;V为玄参多糖溶液的体积(mL);N为测定前多糖溶液稀释倍数;M为玄参粉的质量(g)。
2.4 Box-Behnken效应面法优多糖提取工艺[6]
2.4.1 Box-Behnken 实验设计
选取复合酶添加量(酶比例∶果胶酶∶木瓜蛋白酶∶纤维素酶=1 ∶1 ∶1)、提取温度和提取时间3因素为自变量,每个因素设置3水平,玄参多糖的提取率为因变量。采用Box-Behnken 中心组合设计响应面实验。微波炉功率设置为3 000 W,多糖溶液pH 为7.0。试验因素及水平见表1。Box-Behnken 实验方案与结果见表2。
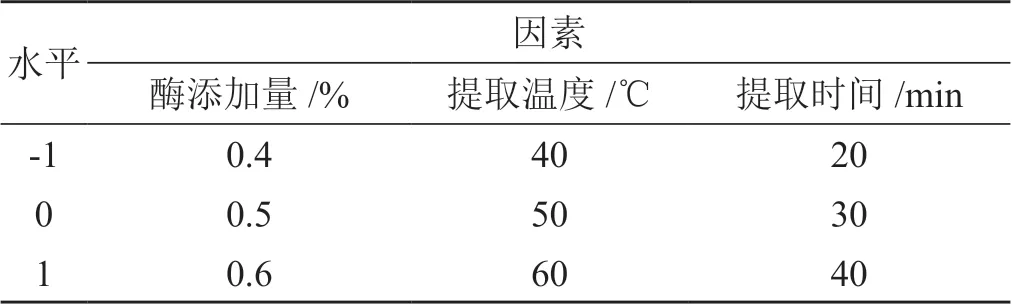
表1 工艺因素水平
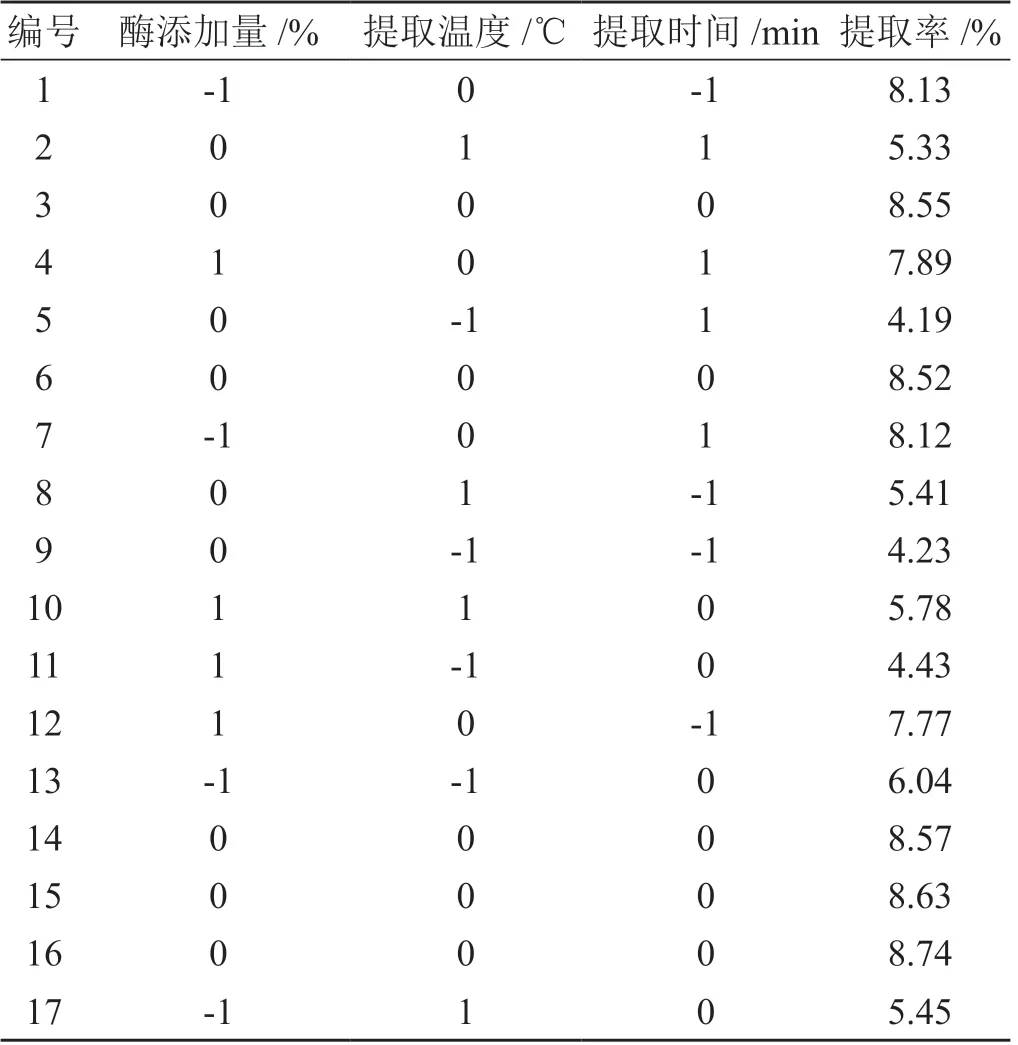
表2 工艺Box-Behnken 实验方案与结果
2.4.2 模型的拟合
利用 Design-Expert 软件对表2中的数据进行回归分析,获得酶添加量(A)、提取温度(B)、提取时间(C)与玄参多糖得率Y之间的回归方程,拟合的方程为:Y=8.6-0.23A+0.38B-0.00125C-0.49AB+0.033AC-0.01BC+0.00525A2-3.18B2-0.63C2(R=0.9918,P<0.01)。方差分析表明,拟合得到的回归方程,P<0.01,说明本实验研究范围内该模型具有统计学意义。B、B2、C2三个因素对多糖得率具有显著性的影响,呈现为极显著影响(P<0.01)。模型拟合极显著(P<0.01),失拟项P>0.05,说明实测值与预测值之间无失拟存在,该数学模型具有较好的预测性。
2.4.3 效应曲面分析
讨论酶添加量、提取温度和提取时间3个因素对于响应值的响应,采用Design-Expert 软件绘制三维曲面图(图1)。比较3组曲面响应图发现,酶用量与提取时间、酶用量与提取温度的响应曲面图表现较为陡峭的曲面,因此酶用量和提取温度对玄参多糖提取率的影响最为显著。Design-Expert 软件计算分析表面,提取玄参多糖的最佳工艺:酶添加量为0.4%,提取温度为49.85℃,提取时间为29.74 min,理论计算最优多糖得率达8.85%。便于实际可操作性,酶添加量为0.4%,提取温度为50℃,提取时间为30 min。
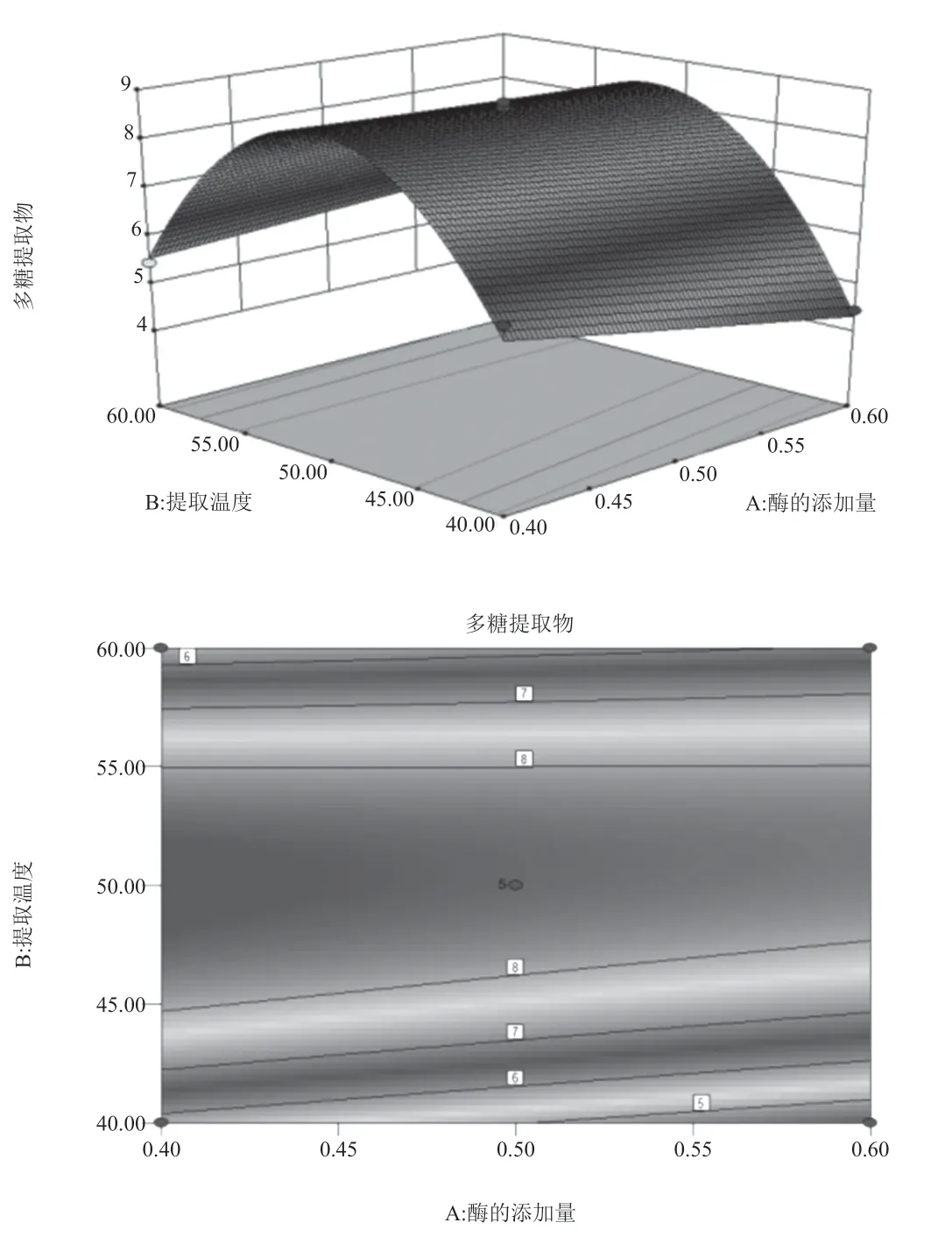
图1 酶用量的三维曲面图
2.4.4 验证实验
准确称取玄参药材粉末3份,每份20.0 g,按优化后工艺提取多糖,提取三份玄参药材粉末,多糖提取率分别为8.64%、8.82%和8.83%,平均值8.76%。其结果与预测值8.85%基本一致,真实实验结果与回归方程预测值非常接近,说明多糖提取工艺科学合理。同时,回归方程模型的准确性已验证,本实验获得多糖提取的最佳工艺的结果非常有意义。
2.5 抗氧化活性
DPPH 自由基清除能力[7]:将粗玄参多糖配制不同浓度溶液(50~300 µg/mL),配制浓度为0.1 mol/L的DPPH 甲醇溶液200 µL,将不同浓度的20 µL 多糖溶液分别加入 DPPH 甲醇溶液。混匀后置于无光环境中反应60 min,于517 nm 波长下测定吸光度。以纯水作为空白,计算玄参多糖对DPPH 自由基的清除率,使用维生素E(VE)作为阳性对照。以式(3)计算DPPH 自由基清除率。
用半清除率IC50表示玄参多糖抗氧化能力。
式中,Ai为混匀后0 min 吸光度;Aj为混匀后静置60 min 吸光度;Ac为空白溶液的吸光度。
结果如图2所示,不同浓度多糖清除DPPH 自由基的能力具有差异性,其中酶辅助法获得的多糖清除DPPH自由基能力最强,且在浓度80~240 μg计量之间,存在剂量依赖性。240 μg 和280 μg 浓度之间对DPPH自由基清除率无显著性差异,推测可能多糖对DPPH自由基清除能力具有饱和性。
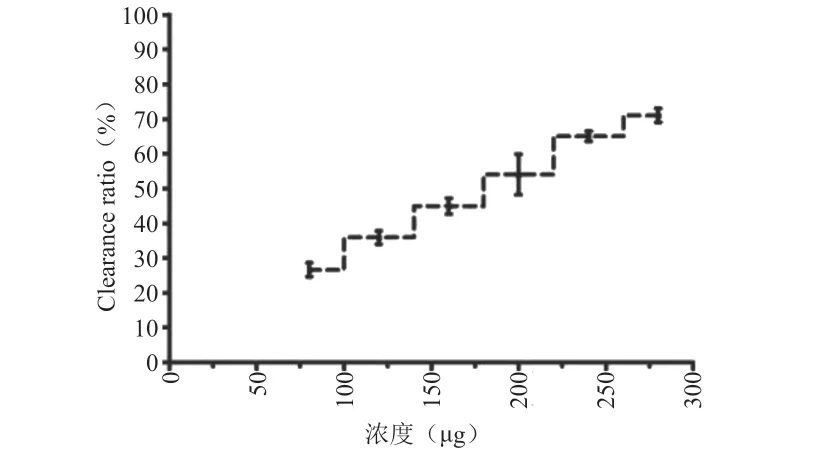
图2 玄参多糖体外抗氧化活性
3 结束语
以BoxBehnken 实验设计和响应面分析法预测的玄参多糖最佳提取工艺,结果发现,真实实验结果和模型预测结果具有高度的拟合度,说明回归方程可靠。
多数天然来源的多糖具有抑制体内的氧化应激,可通过直接清除氧化自由基、抑制氧化产物和络合金属离子间接抑制产生活性氧等途径实现抗氧化作用。本实验考察了酶辅助微波提取法获得的玄参多糖进行的抗氧化作用的验证,发现玄参多糖对DPPH 自由基具有显著的清除能力,且呈明显的剂量依赖性,说明酶法辅助提取温和,减少对多糖的天然结构的破坏,最大程度保留玄参多糖结构的天然性,未能改变多糖的构象结构,这可能是多糖提高DPPH 自由基清除能力的结构基础。由于微波为高效、瞬时提取,同时选择不同比例的酶作为辅助提取,极大提高了多糖提取效率,同时,保持低温环境下提取,尽量保持多糖活性不被破坏。提取多糖体外抗氧化活性证明,采用酶辅助微波提取法能够最大程度地保持多糖抗氧化活性。

