斜生栅藻对全氟辛酸和Zn2+联合胁迫的生理生化响应
杨顺航,李立杰,余佳妮,葛 恒,马永华,廖木兰 ,尤德雨,李慧明,谭凤霞,柴 毅1,,,汪正刚
(1.长江大学湿地生态与农业利用教育部工程研究中心,湖北 荆州 434025;2.长江大学动物科学技术学院,湖北 荆州 434025;3.长江大学农学院,湖北 荆州 434025;4.荆州市渔都特种水产养殖公司,湖北 荆州 434000)
全氟辛酸(Perfluorooctanoate,PFOA)是典型的全氟化合物(Perfluorinated compounds,PFCs),是一种新兴的、持久性的环境污染物,普遍存在于各种环境介质中,尤其在水环境中表现出明显的远距离迁移性和汇集性[1]。目前在我国长江[2-3]、钱塘江流域[4]及湖泊[5]中均有检出。研究表明PFOA 会对动物的生长发育、繁殖、代谢和免疫等造成毒性作用[6-9],并可以通过食物链富集积累,严重危害生物健康。我国于2020 年将PFOA 列入《优先控制化学品名录》[10]。
锌是常见的重金属污染物之一,通常用于金属开采和精炼,会与废水污染物一起进入水生系统[11],具有难降解性。在工业化地区的河流[12-13]、河涌[14]和湖泊[15-16]中普遍检出。Zn是水生生物生长生理必需的微量元素,适度摄入有助于增强免疫力及抗病能力,而过量摄入则会对其生长、组织发育、免疫等生理生化功能造成影响[17-21]。
随着环境污染问题的加剧,水生生物可能暴露在多种污染物下,如重金属和持久性有机污染物。近来的研究越来越关注不同种污染物对水生生物可能的联合作用,如微塑料和铅对铜绿微囊藻(Microcystis aeruginosa)[22];马度米星铵和铜对鲫(Carassius auratus)[23];银和二氧化钛纳米颗粒对大型水蚤(Daphnia magna)[24]。然而,目前关于全氟化合物和重金属对水生生物尤其是藻的联合毒性作用的研究报道较少。微藻是水生态系统中主要的初级生产者,具有体积小、世代周期短和对环境敏感等特点,也是食物链中富集环境污染物的起点。因此,本研究通过探究PFOA 和Zn 单一及联合胁迫对斜生栅藻(Scenedesmus obliquus)藻细胞生长、光合色素、抗氧化酶活性和转化氨氮等的影响,阐明二者对斜生栅藻的联合毒性作用,明确重金属和全氟化合物在水环境中的暴露风险,以期对水环境风险评价、管控、可持续发展与利用及污染水体中藻类参与的氮循环提供理论基础。
1 材料和方法
1.1 材料
受试生物:斜生栅藻(S.obliquus,FACHB-13)购自中国科学院水生生物研究所淡水藻种库。
试剂:七水合硫酸锌ZnSO4·7H2O(CAS7446-20-0)纯度为99%,购自阿拉丁试剂有限公司;全氟辛酸(PFOA,CAS335-67-1)纯度为96%,购自sigma-aldrich 化学制品有限公司;其余试剂均为分析纯。
1.2 藻种扩大培养
采用BG11 培养基进行接种,将其置于光照培养箱(GZX-250BSH-Ⅲ,上海新苗医疗器械制造有限公司)中扩大培养。培养条件:温度(25±1)℃,光暗比12 h:12 h,照度5 000~8 000 lx,每日摇动培养瓶3~4次,每7~14 d转接一次,藻类进入对数生长期后使用改良的BG11培养基(未添加ZnSO4·7H2O)饥饿培养3 d 后进行实验。配制的BG11 培养基及玻璃器皿均经120 ℃高压蒸汽灭菌锅灭菌30 min。扩培与转接均在无菌操作台中操作。
1.3 实验设计及方法
实验方法参照《淡水生物水质基准推导技术指南》[25],微藻采用静态暴露方式。将ZnSO4·7H2O 与PFOA 分别溶于水配置成一定质量浓度的母液。根据预实验结果设定PFOA 和Zn2+对斜生栅藻急性毒性效应的浓度,如表1。用培养基稀释,现用现配。选取对数生长期的斜生栅藻藻液,以3 000g离心15 min,去离子水重悬,再离心,重复3 次,去除藻细胞表面去除的残留物质,藻泥加入300 mL 锥形瓶中,再加入培养液稀释已配置的母液至所需质量浓度,藻液培养体积为150 mL,初始藻密度为1 ×106mL-1,空白组(组号1)和实验组均设三个重复。为防止藻细胞粘在瓶壁,每日摇动培养瓶3~4 次,实验周期为96 h。
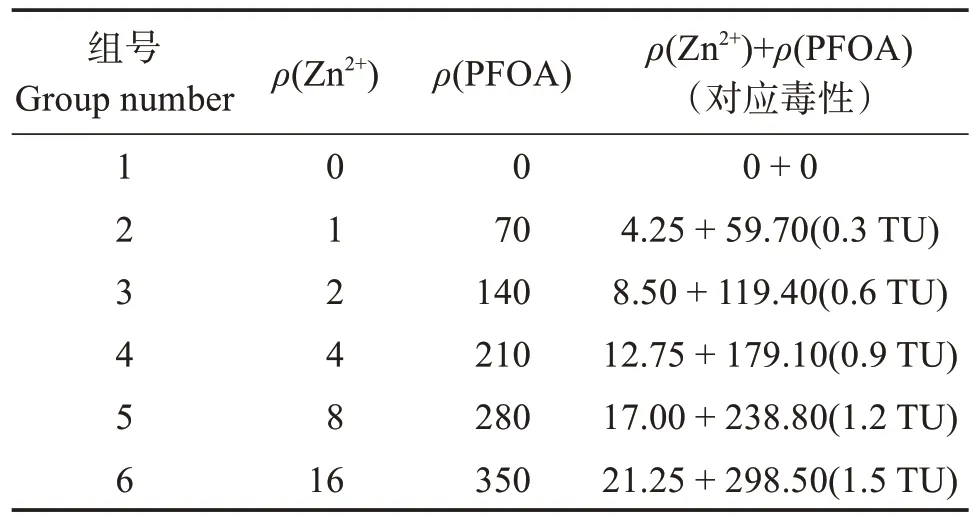
表1 锌、全氟辛酸单一及联合实验设计Table 1 Design of single and compound exposure groups to Zn2+and PFOA mg/L
单一毒性实验测得PFOA 和Zn2+对斜生栅藻的96 h-EC50,定义EC50(PFOA)+EC50(Zn2+)=1 TU(毒性单位),根据预实验结果,联合毒性实验梯度设置如表1。每组三个平行,并设置空白对照组。
1.4 藻细胞浓度测定
用血细胞计数板对藻细胞进行计数,波长685 nm下测定藻液光密度,建立不同藻细胞浓度和光密度之间的线性关系(ŷ=80.897 1x-0.139 1,R2=0.997 6),根据光密度线性方程计算出的藻细胞浓度表示生物量,每24 h 计测定各组斜生栅藻的光密度,实验结束后绘制生长曲线[26]。
1.5 叶绿素a(Chl a)质量浓度测定
在实验结束时,各处理组取5 mL 藻液,以3 000g离心15 min,并用预冷的磷酸盐缓冲液(PBS,0.01 mol/L,pH 7.3)清洗3次,去除上清液,加入5 mL体积分数为95%的乙醇在75 ℃水浴锅中水浴3 min。再次离心后测定在649 nm和665 nm处光密度,并依据下面公式进行计算叶绿素a质量浓度(mg/L)[27]:
1.6 生理生化指标、活性氧自由基(ROS)、藻细胞膜通透性和线粒体跨膜电位(Δψm)测定
总抗氧化能力(T-AOC)、丙二醛(MDA)含量、总蛋白含量(TP)、活性氧自由基(ROS)和总超氧化物歧化酶活性(SOD)用南京建成生物工程研究所相应的试剂盒(A015-3-1、A003-1、A045-4、E004-1-1、A001-3-2)进行测定。二乙酸荧光素(Fluorescein Diacetate,FDA)法测定细胞通透性[28]。罗丹明(Rhodamine 123,Rh123)法测定线粒体跨膜电位(Δψm)[28]。
1.7 细胞表面形态分析
96 h 时,对照组、16 mg/L Zn2+处理组、350 mg/L PFOA 处理组与1.5 TU 联合暴露处理组分别收集5 mL 藻细胞。藻细胞固定加入0.01 mol/L PBS(pH 7.3)清洗三次,在真空低温干燥机中-75 ℃脱水6 h,再喷金45 s,使用扫描电镜(SEM,TESCAN VEGA 3)观察拍照[26]。
1.8 暴露液指标测定
1.8.1 暴露液中总氮、硝态氮、氨氮含量的测定 取50 mL 藻液用循环水式真空泵抽滤,抽滤后的滤液过孔径0.45 μm滤膜得到滤液。
总氮含量用碱性过硫酸钾消解紫外分光光度法测定[29]。硝态氮含量用紫外分光光度法测定[30]。氨氮含量用纳氏试剂比色法测定[31]。
1.8.2 Zn2+和PFOA 浓度的测定 取实验前后的藻液,高速离心(4 500g,10 min)获得上清液,利用原子吸收分光光度法[32]对上清液中的Zn2+浓度进行测定,利用高效液相色谱法(HPLC)[33]对上清液中的PFOA 浓度进行测定,重复三次取平均值为上清液中Zn2+和PFOA的浓度,计算去除率(%)。
式中:N,去除率(%);c1,去除前水体中污染物质量浓度(mg/L);c2,去除后水体中污染物质量浓度(mg/L)。
1.9 数据处理
1.9.1 急性毒性 利用概率单位-质量浓度法[9]计算96 h-EC50。
式中:N1为t1时刻的细胞数,Nn为tn时刻的细胞数。
式中:Uc为对照组的比生长速率,Ut为处理组的比生长速率。
把各浓度的生长抑制率I转换为概率单位,进行线性回归分析,得到回归方程,并计算PFOA 和Zn2+分别对斜生栅藻的96 h-EC50。
1.9.2 联合毒性 利用毒性单位法(TU)、添加指数法(AI)和混合毒性指数法(MTI)三种方法评定联合毒性效应[34]。
1.9.3 数据统计分析 实验均进行三次重复,数据采用SPSS(PASW Statistics 18)软件进行Probit 拟合、单因素方差分析(ANOVA)的LSD 多重比较(P<0.05时差异显著)。用Graphpad Prism 8.0绘图。
2 结果
2.1 锌和全氟辛酸对斜生栅藻生长的影响和毒性效应
不同暴露条件对斜生栅藻生长情况的影响如图1 所示,随着培养时间的延长,各处理组的细胞浓度基本均呈现升高趋势,在实验所选的处理浓度,污染物对斜生栅藻表现出明显的抑制作用(P<0.05),且随着浓度增高抑制作用增强。在96 h时抑制率最高。

图1 不同暴露条件对斜生栅藻的生长影响Fig.1 Growth of Scenedesmus obliquus under different exposure conditions
根据概率单位-质量浓度法获得Zn2+与PFOA对斜生栅藻的EC50拟合曲线整理数据如表2,可知Zn2+和PFOA 的96 h-EC50分别为14.17 mg/L 和198.98 mg/L,即锌离子对斜生栅藻的生长抑制更为明显毒性作用更强,两种污染物联合胁迫对斜生栅藻的96 h-EC50为0.97 TU。根据毒性单位法、相加指数法和混合毒性指数法算出数值如表3,综合三种毒性评价方法得出结论,两者对斜生栅藻的联合毒性作用应为部分相加作用。
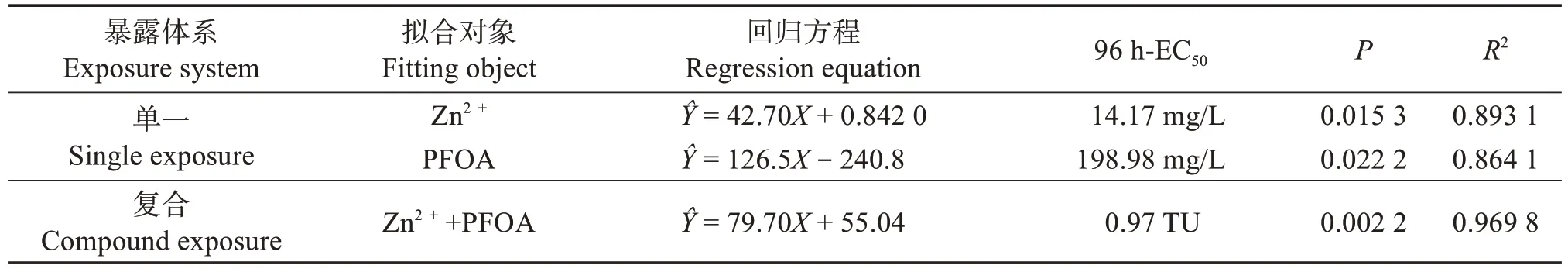
表2 线性拟合模型参数和96 h-EC50值Table 2 Parameters of linear fitting model and the 96 h-EC50 values

表3 联合作用类型Table 3 Joint action type
2.2 锌和全氟辛酸对斜生栅藻Chl a含量的影响
Zn2+和PFOA 对斜生栅藻Chl a 含量的影响如图2 所示。96 h 培养中,随暴露浓度的增加,斜生栅藻Chl a含量与其生长情况呈现相似的递减规律,且均差异显著(P<0.05),表现出剂量-效应关系。斜生栅藻在单一Zn2+暴露中,随着Zn2+浓度的升高,各浓度组Chl a 含量呈现下降趋势,16 mg/L Zn2+处理组质量浓度最低,为0.38 mg/L(图2(a))。在PFOA单一暴露组中(图2(b)),不同浓度的PFOA 处理组Chl a含量均低于对照组,其中280、350 mg/L的处理组之间无明显差异(P>0.05),分别为0.39、0.35 mg/L。Zn2+和PFOA 联合暴露体系中(图2(c)),各组Chl a含量均呈现下降趋势,且差异显著(P<0.05),且在1.5 TU时达到最低为0.37 mg/L。
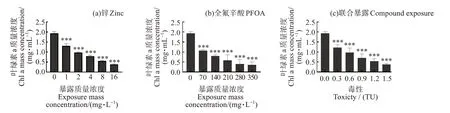
图2 不同暴露条件下斜生栅藻的叶绿素含量变化Fig.2 Changes of chlorophyll content in Scenedesmus obliquus under different exposure conditions
2.3 锌和全氟辛酸对斜生栅藻细胞膜通透性和线粒体跨膜电位(Δψm)的影响
如图3,单个细胞膜通透性水平随污染物浓度的升高而升高,Δψm呈现降低趋势。4~16 mg/L Zn2+处理组与对照组间差异显著(P<0.05),单个细胞膜通透性水平分别为对照组的1.37~2.55 倍,Δψm相比对照组分别下降18.88%~45.88%。在PFOA单一暴露组中(图3(b))各处理组与对照组间均差异显著(P<0.05);Zn2+和PFOA 联合暴露体系中(图3(c)),0.6~1.5 TU处理组细胞通透性水平为对照组的1.28~2.64倍,差异显著(P<0.05)。Δψm水平相比对照组下降10.02%~45.13%,差异显著(P<0.05)。
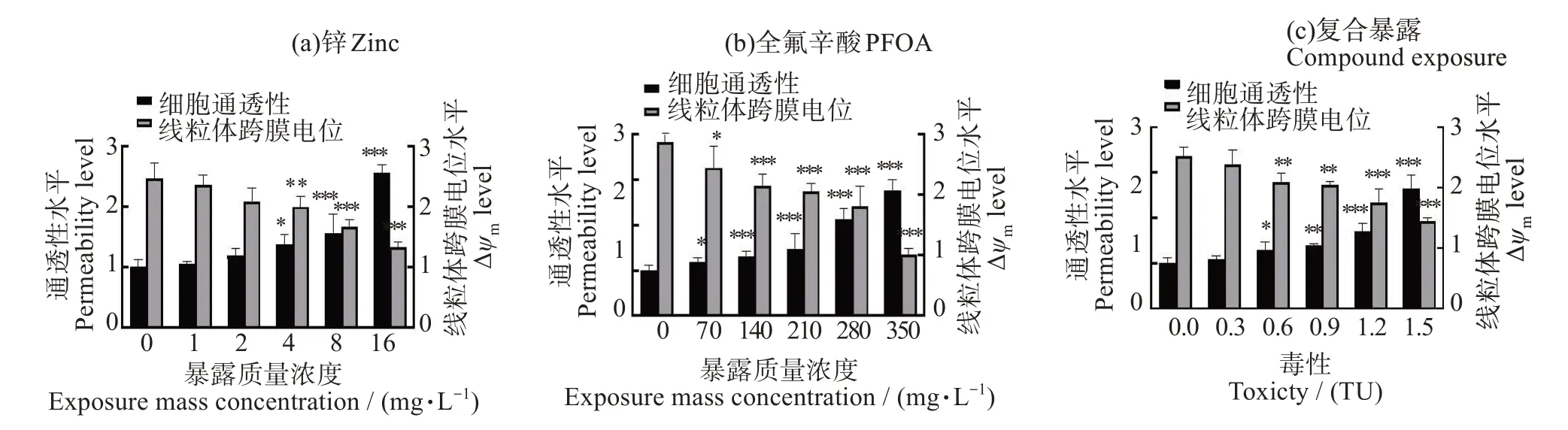
图3 不同暴露条件下斜生栅藻的细胞通透性和线粒体跨膜电位变化Fig.3 Changes of cell permeability and mitochondrial transmembrane potential in Scenedesmus obliquus under different exposure conditions.
2.4 锌和全氟辛酸对斜生栅藻ROS和MDA的影响
不同暴露条件下斜生栅藻的ROS和MDA 的变化如图5 所示,在96 h 实验中,ROS 和MDA 含量均随污染物浓度的增加而升高。如图4(a),8、16 mg/L的Zn2+处理组与对照组相比差异显著(P <0.05),ROS 分别为对照组的2.17、4.32 倍,MDA 为对照组的1.21、1.43 倍。由图4(b),与对照组相比,140~350 mg/L 的PFOA 处理组差异显著(P<0.05),350 mg/L 的处理组ROS 和MDA 最高,分别为对照组的4.68 和1.68 倍。联合暴露体系中(图4(c)),1.2、1.5 TU处理组ROS含量与对照组相比差异显著(P<0.05),分别为对照组的2.84、4.51 倍,0.6~1.5 TU处理组MDA含量为对照组的1.30~1.65倍,差异显著(P<0.05)。
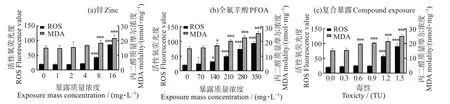
图4 不同暴露条件下斜生栅藻的ROS和MDA变化Fig.4 Changes of ROS and MDA in Scenedesmus obliquus under different exposure conditions
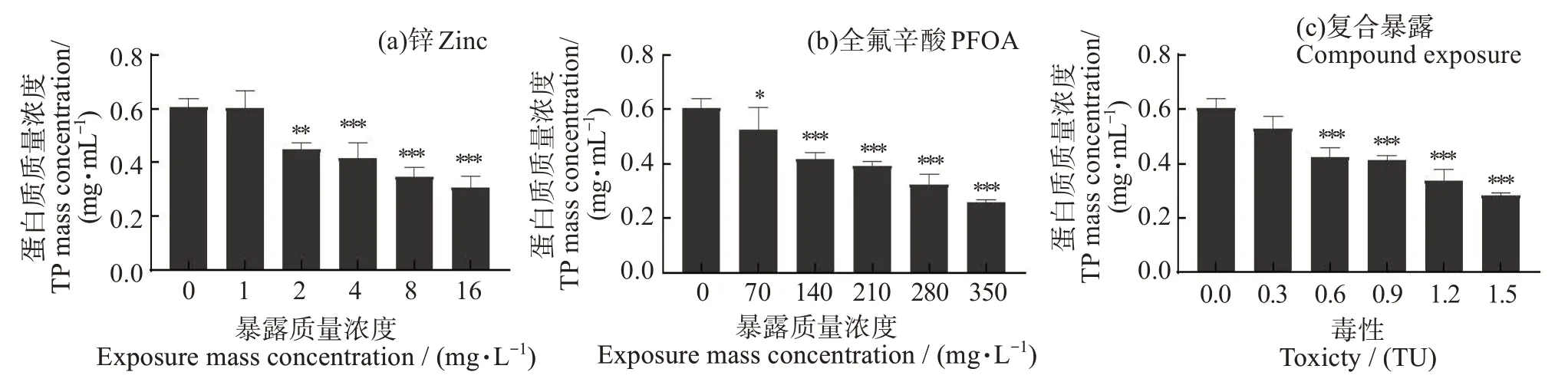
图5 不同暴露条件下斜生栅藻的总蛋白含量的变化Fig.5 Changes of TP in Scenedesmus obliquus under different exposure conditions
2.5 锌和全氟辛酸对斜生栅藻抗氧化酶和能量代谢的影响
不同暴露条件对斜生栅藻的TP 含量的影响如图5 所示,在96 h 实验中,随着污染物浓度的升高,各组的TP 质量浓度均呈现明显降低趋势。Zn2+、PFOA 单一及联合暴露中斜生栅藻的最低TP 质量浓度均为污染物最高浓度组,且分别为对应批次中对照组的50.97%、42.93%、47.13%。
不同暴露条件对斜生栅藻的T-AOC 和SOD 活性影响如图6 所示,T-AOC 和SOD 活性随着污染物浓度的升高呈现升高趋势。如图6(a),2~16 mg/L的Zn2+处理组T-AOC 为对照组的1.42~2.64 倍,差异显著(P<0.05)。1~8 mg/L Zn2+处理组SOD 活性,与对照组相比没有显著差异(P >0.05),16 mg/L的处理组与对照组相比差异显著(P<0.05),为其的1.26倍。在PFOA单一暴露组中(图6(b)),不同浓度的PFOA 处理组T-AOC 和SOD 活性均高于对照组,且350 mg/L 处理组最高,分别为对照组的3.15 和1.47 倍。联合暴露体系中(图6(c)),1.2 TU、1.5 TU处理组T-AOC 分别为对照组的2.03、2.95 倍,SOD活性分别为对照组的1.21、1.38倍。
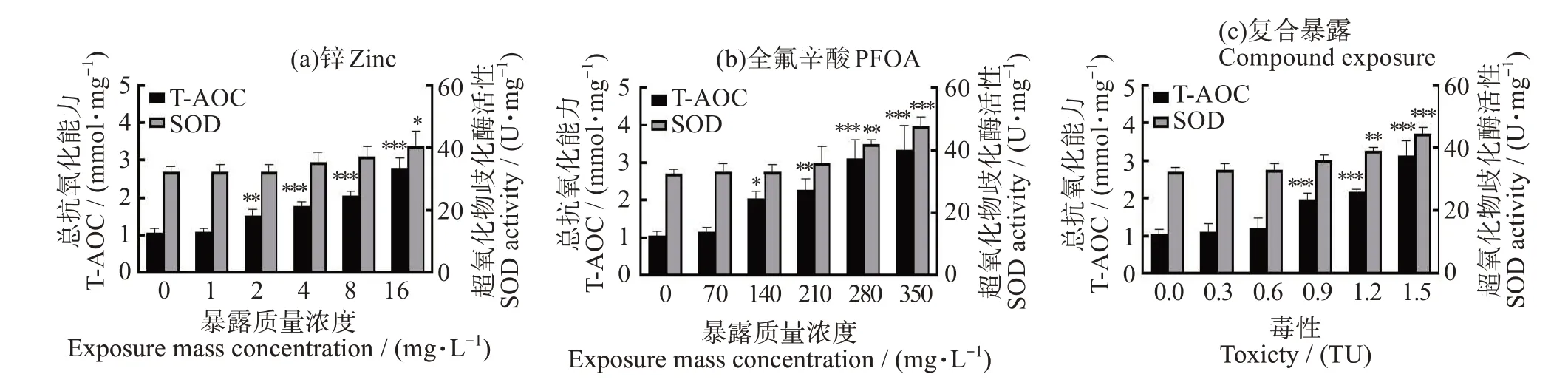
图6 不同暴露条件下斜生栅藻的总抗氧化能力和超氧化物歧化酶活性变化Fig.6 Changes of T-AOC and SOD in Scenedesmus obliquus under different exposure conditions
2.6 生理生化指标之间的相关系数
如表4所示,ROS与MDA、T-AOC、SOD活性和细胞膜通透性水平呈显著正相关,分别与Chl a、TP和Δψm呈显著负相关。

表4 斜生栅藻各参数之间的Pearson相关系数Table 4 Pearson correlation coefficient matrix among parameters of Scenedesmus obliquus
2.7 锌和全氟辛酸暴露对藻细胞的损伤
藻类细胞的表面形态如图7。对照组藻细胞外部形态呈现椭球形且结构完整,细胞表面鞭毛清晰可见(图7(a))。而16 mg/L Zn2+处理组(图7(b))中藻细胞外部形态溶解破裂,部分碎裂物团聚在一起。350 mg/LPFOA 处理组(图7(c))中藻细胞外部可见明显溶解破裂且有严重的变形。1.5 TU联合暴露组(图7(d))中藻细胞表面形态变形,有部分团聚体吸附导致细胞裂解,间隔模糊。

图7 不同暴露条件下斜生栅藻外部形态变化Fig.7 Changes of external form in Scenedesmus obliquus under different exposure conditions
2.8 锌和全氟辛酸暴露浓度对斜生栅藻转化氨氮的影响
由图8 可以看出,不同浓度的污染物对暴露液中总氮和氨氮含量存在明显影响,整体呈现升高趋势,硝态氮一直处于较低水平。
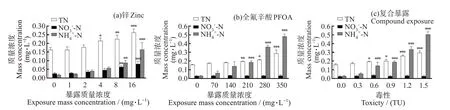
图8 不同暴露条件下斜生栅藻暴露液中总氮、硝态氮、氨氮含量变化Fig.8 Changes of TN、NO3--N and NH4+-N Content in Scenedesmus obliquus under different exposure conditions
如图8(a)所示,培养96 h 后,4~16 mg/L 的Zn2+处理组总氮质量浓度(0.21~0.26 mg/L)显著高于对照组(0.162 mg/L)(P<0.05)。暴露液中的硝态氮一直处于较低水平(0.026~0.081 mg/L),高浓度处理组间(8、16 mg/L)差异显著(P<0.05)。对照组中氨氮质量浓度仅为0.017 mg/L,而16 mg/L 的Zn2+处理组中氨氮质量浓度达到0.163 mg/L。
如图8(b)所示,280、350 mg/L 的PFOA 处理组总氮质量浓度(0.21、0.28 mg/L)已明显高于对照组(0.166 mg/L)。硝态氮含量(0.027~0.032 mg/L)无明显变化趋势。各处理组暴露液中氨氮质量浓度(0.06~0.48 mg/L)均高于对照组(0.029 mg/L)。
联合暴露体系中(图8(c)),0.6~1.5 TU 处理组暴露液中总氮质量浓度(0.19~0.29 mg/L)显著高于对照组(0.16 mg/L)(P<0.05)。硝态氮处于低水平(0.024~0.036 mg/L)。0.6~1.5 TU 处理组暴露液中氨氮质量浓度(0.14~0.50 mg/L)显著高于对照组(0.027 mg/L)(P<0.05)。
2.9 锌和全氟辛酸暴露浓度对斜生栅藻去除率的影响
不同暴露条件斜生栅藻对Zn2+和PFOA 的去除率影响如图9 所示。Zn2+单独暴露时,斜生栅藻对其的去除率随处理组浓度的升高呈现先升后降最后达到平稳状态的趋势,且在其质量浓度为2 mg/L时去除率最高为42.83%,大于8 mg/L去除率达到平稳状态,为14%左右;PFOA 单独暴露时,斜生栅藻对其的去除率一直处于平稳状态,在2%左右;联合暴露时斜生栅藻对Zn2+的去除率随处理组浓度升高呈现先降低后趋于稳定在10%左右,而对PFOA 的去除率略低于单独暴露时的,为1.1%左右。
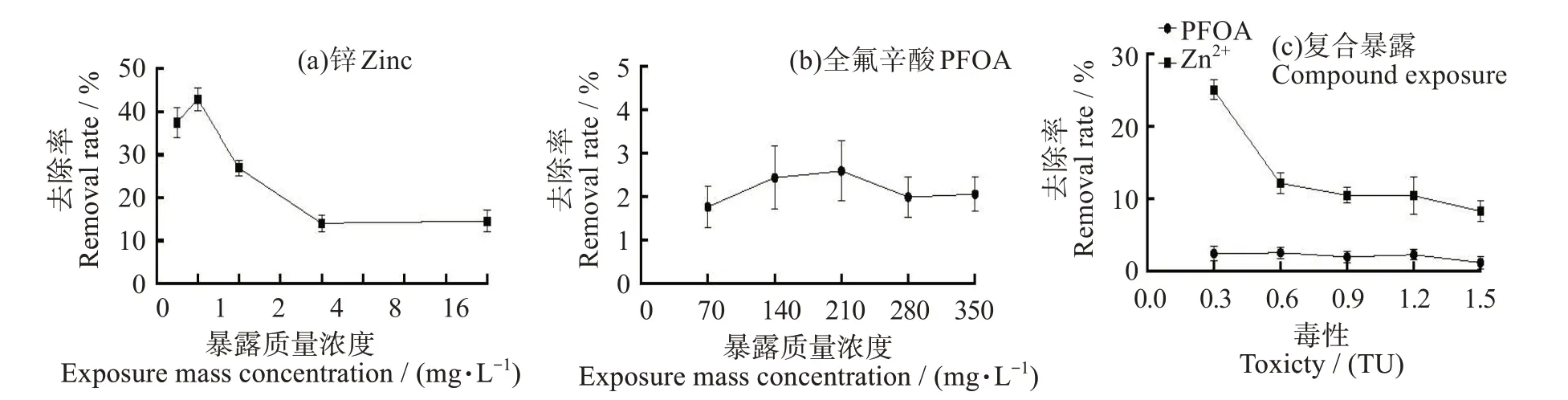
图9 锌和全氟辛酸不同暴露条件下斜生栅藻对其去除率的变化Fig.9 Efficiency of Scenedesmus obliquus in removing zinc and PFOA
3 讨论
3.1 锌和全氟辛酸对斜生栅藻生长的影响
在本研究中,Zn2+和PFOA 单一及联合暴露时,随污染物浓度的升高,对斜生栅藻的生长表现出明显的抑制作用,Zn2+和PFOA 的96 h-EC50分别为14.17 mg/L 和198.98 mg/L,联合胁迫对斜生栅藻的96 h-EC50为0.97 TU。根据毒性单位法、添加指数法和混合毒性指数法计算得出两种污染物对斜生栅藻的联合作用类型为部分相加作用。田永静等[35]研究发现锌与双酚A 对普通小球藻(Chlorella vulgaris)的联合作用类型为协同作用,即联合暴露会加强其在水环境中的毒性效应。周静韵等[9]研究发现PFOA 和PFNA 对杜氏盐藻(Dunaliella salina)的联合毒性表现为相加效应,对三角褐指藻(Phaeodactylum tricornutum)为协同效应,实验范围内PFOA 和PFNA 对两种藻均表现出明显的抑制作用。这与本研究结果相一致,二元混合物毒性增强。在本研究中,观察细胞外部形态时发现Zn2+单一暴露和与PFOA 联合暴露时,细胞外部可见明显团聚体缠绕在藻细胞周围,PFOA 处理组的藻细胞可见明显的裂解和变形。这可能是因为锌在水体中单独暴露时为自由离子[36],通过与斜生栅藻细胞膜蛋白配体结合表现出生理活性,并替代藻细胞原有的必要元素,参与到细胞生化反应中,导致蛋白质构型变化和斜生栅藻细胞应激,表现为中毒。PFOA 会与细胞膜表面的疏水位点结合,破坏细胞膜完整性,导致胞外污染物进入细胞内损伤细胞器,进而对栅藻胞内代谢产生抑制作用。当Zn2+和PFOA 联合暴露时,PFOA 可能会与Zn2+络合成新的产物,这种新的络合物可能会增加斜生栅藻分子配位点或与原本分子配位点的酸碱软硬程度更接近,从而表现为更高的毒性[37]。
细胞膜对细胞内外物质交换发生作用[38]。污染物胁迫时,微藻首先会通过自身细胞壁所含官能团或分泌胞外物质与污染物发生螯合,已进入胞内的会在细胞质中络合形成沉淀,排出胞外[39]。因此,污染物对微藻的损伤首先体现在破坏藻细胞膜和细胞器内膜系统[40]。本研究中,Zn2+和PFOA 单一及联合胁迫下,细胞膜通透性随暴露浓度的增加呈上升趋势。在观察细胞外部形态时发现,16 mg/LZn2+处理组、350 mg/LPFOA 处理组、1.5 TU 联合暴露组这三种条件下的藻细胞可见明显的变形甚至裂解破碎。说明污染物一方面会过氧化细胞膜上的酶和磷脂等物质,另一方面,污染物还会与膜蛋白结合形成配位键,使蛋白质内部作用力网络发生变化而导致蛋白质构型变化,最终损伤细胞膜,表现为细胞膜通透性升高及渗透压发生变化[41],导致细胞内蛋白质流失和细胞凋亡。毕相东等[42]研究小檗碱对铜绿微囊藻(Microcystis aeruginosa)细胞膜通透性的影响时也发现同样规律。
Chl a 含量变化可以反应微藻的光合作用状况[43]。在本研究中,随着污染物浓度的升高,斜生栅藻Chl a 含量显著下降(P<0.05)。其原因是Zn2+和PFOA 及其络合物均能抑制光合作用相关酶的活性,损伤细胞膜和叶绿体结构以阻碍光合色素合成,破坏光合作用,影响能量储备[44]。本实验中,当Zn2+和PFOA 质量浓度高于2、140 mg/L,联合毒性超过0.6 TU 后,TP 含量呈现明显下降趋势,最低TP含量均为污染物最高浓度组。TP 含量与Chl a 含量呈现正相关,说明光合作用的减弱导致蛋白质代谢合成途径受到抑制。前人研究发现,较高浓度的Zn2+会抑制蛋白核小球藻(Chlorella pyrenoidosa)的光合作用,浓度继续增大则会抑制浮游植物的生长、破坏光合器官[35];PFOA 对蛋白核小球藻的生长具有抑制作用,叶绿素和光合系统也受其负面影响,并且与其光合代谢的相关基因大部分表现出下调[45]。这与本研究结果相一致。
线粒体跨膜电位(Δψm)是由于线粒体内膜两侧的电子分布的不对称而导致的。正常情况下,线粒体内膜渗透性非常低,这是保持电化学质子梯度和氧化磷酸化的基本结构[46],而当线粒体内膜被破坏时,Δψm水平就会降低并且导致藻细胞凋亡。本研究中,16 mg/L 的Zn2+、350 mg/L 的PFOA 和1.5 TU处理组Δψm水平分别为对照组的40.75%、34.89%和39.81%。这表明高浓度污染物能够引起级联反应,导致细胞凋亡。其具体作用机制是:一方面高浓度的污染物会导致线粒体外膜对蛋白质的通透性增高,可溶性的少量膜间蛋白从线粒体释放出来[47]。同时释放Caspase 活化物细胞色素C,导致细胞凋亡[48]。引起Δψm水平降低[49]。另一方面,污染物胁迫时,线粒体通透性转换孔(MPTP,MPT pore)开放,允许相对分子质量小于1.5×106的分子通过,从而导致内膜两侧离子梯度消失,Δψm水平降低,释放凋亡诱导因子(Apoptosis inducing factor,AIF)引起细胞凋亡。
3.2 锌和全氟辛酸对斜生栅藻的抗氧化体系的影响
在微藻中,产生ROS 的主要途径有叶绿体光合与线粒体电子传递链以及细胞膜上的氧化还原反应[50],正常情况下,抗氧化系统能快速清理机体正常产生的少量ROS,使ROS产生和抗氧化系统清除速率一直处于动态平衡中。在接触到污染物时,藻细胞会产生大量的超过抗氧化系统承受的ROS,并在细胞内累积,毒害藻细胞的光合器官,引起抗氧化系统响应和膜脂质过氧化(主要产物为MDA)[51]。
本研究中ROS 含量随污染物浓度的增加而升高。16 mg/L Zn2+、350 mg/L PFOA 和1.5 TU 处理组ROS 水平分别为对照组的4.32、4.68、4.51 倍。这表明斜生栅藻在受到高浓度污染物胁迫时,光合作用和线粒体电子传递受阻,细胞膜损伤,过剩的电子就会进入分子氧,从而生成ROS。抗氧化系统不能有效清除ROS,就会引起ROS含量升高。藻细胞内ROS的产生与累积可能是污染物致毒机制之一。
T-AOC 是反映机体抗氧化系统功能的综合指标,SOD 是抗氧化系统的重要组成部分,机体利用抗氧化系统分解细胞中由于应激反应所产生的过量ROS[51-52]。在本研究中,T-AOC 和SOD 活性在高浓度处理组受到诱导而呈现升高趋势,16 mg/L Zn2+、350 mg/L PFOA 和1.5 TU 处理组T-AOC 分别为对照组的2.64、3.15、2.95 倍,SOD 活性分别为对照组的1.26、1.47、1.38 倍。这表明,随着污染物浓度增加,藻细胞产生清除过氧化物、维持细胞功能的应激反应,此时抗氧化系统激活抗氧化酶来清除ROS。沈洪艳等[52]研究头孢噻肟钠对斑马鱼(Danio reriovar)SOD 活性、MDA 含量及DNA 损伤的影响,以及Kuang 等[53]研究镉对铜绿微囊藻抗氧化反应时也发现同样的现象和规律。
MDA 含量能够反映细胞生物膜受到氧化作用的破坏程度[51]。本研究中MDA 含量在高浓度处理组胁迫条件下显著增加(P<0.05),16 mg/L Zn2+、350 mg/L 的PFOA 和1.5 TU 处理组MDA 水平分别为对照组的1.43、1.68、1.65 倍。这表明受到高浓度Zn2+、PFOA 单一及联合胁迫时,抗氧化系统不足以清除过量ROS 导致膜脂过氧化反应程度提升,生成大量MDA,破坏细胞氧化作用,加剧细胞膜损伤。
3.3 锌和全氟辛酸暴露浓度对斜生栅藻转化氨氮的影响
氮素是植物生长发育所必需的营养元素,也是水体环境中对养殖动物产生威胁的污染物之一[54-55]。本研究中氨氮含量与总氮含量均随污染物浓度的增加而增加,且污染物浓度越高差异越明显,其中最高浓度联合暴露处理组与对照组差异最为明显,硝态氮则一直处于较低水平(0.024~0.081 mg/L)。这可能是因为低浓度污染物能够诱导斜生栅藻细胞产生金属硫蛋白(MT)等污染物抗性蛋白,这些蛋白能够结合污染物使污染物对藻细胞的毒性减弱,而较高浓度污染物破坏了细胞膜等结构,使抗性蛋白从细胞内外流,毒性显著增强,氨氮吸收过程受到的抑制作用增强,暴露液中的氨氮和总氮含量升高,这也说明Zn2+和PFOA 混合时毒性增强。转化生成的硝态氮含量低,说明Zn2+和PFOA 单一及联合暴露时均未对氨氮转化过程相关酶或者基因产生较大的影响。这与前人的研究结果[56]基本一致。
3.4 锌和全氟辛酸暴露浓度对斜生栅藻去除率的影响
本研究中,Zn2+单独胁迫斜生栅藻时,随着Zn2+初始浓度的升高,去除率先升高后降低最后稳定在14%左右,推测斜生栅藻对Zn2+存在一个固定的去除阈值,在达到这个值之前斜生栅藻会持续去除Zn2+,而较高浓度的Zn2+会对斜生栅藻产生毒害作用,造成细胞壁破碎,去除率持续下降,直到斜生栅藻细胞产生的应激反应中和Zn2+的毒害作用,最终达到动态平衡,此时去除率保持平稳状态。PFOA单独胁迫斜生栅藻时,斜生栅藻对其的去除率相对较低且一直在2%左右波动。PFOA 是一种疏水阴离子化合物,疏水性有利于藻细胞对其去除,但其阴离子官能团与带负电荷的藻细胞之间的静电作用不利于藻细胞对其吸附,在斜生栅藻去除PFOA以静电作用为主,即呈现排斥作用导致去除率较低[57-58]。联合暴露时,斜生栅藻对Zn2+的去除率随处理组浓度升高呈现降低后稳定于10%左右,且从趋势看同初始浓度时对Zn2+的去除率略小于Zn2+单一暴露时,而对PFOA 的去除率与其单独胁迫时相差不大,这归因于有部分Zn2+与PFOA 结合形成络合物,其不与细胞壁上的官能团结合,而是部分进入藻细胞内产生毒害作用。
3.5 锌和全氟辛酸单一及联合暴露毒性效应
污染物之间的相互作用通常分为拮抗、加和、部分加和及协同作用。对斜生栅藻的联合毒性研究中,王璞等[59]研究发现相同浓度Cd2+和纳米二氧化钛nTiO2的72 h-EC50值与单一实验处理组相比显著上升,表现为拮抗效应;姜航等[60]研究发现MPs和ROX 单一及联合处理组均能显著抑制斜生栅藻的藻密度与Chl a含量,两者的联合毒性作用为拮抗作用。本研究结果表明,锌和全氟辛酸对斜生栅藻的联合作用类型为部分相加作用,毒性强度表现为联合胁迫>锌>全氟辛酸。在自然水体中,重金属和全氟化合物是长期共存的,而两者对水生生物的长期联合效应尚未探明,因此,有关重金属和全氟化合物对水生生物的慢性毒性实验及微藻对两种污染物的吸收降解和生物富集研究有待后期开展。
4 结论
锌和全氟辛酸对斜生栅藻的联合作用类型为部分相加作用,毒性强度表现为联合胁迫>锌>全氟辛酸。Zn2+和PFOA 单一及联合暴露时,高浓度处理组(16 mg/L Zn2+、350 mg/L PFOA 和1.5 TU 处理组)会显著影响斜生栅藻的光合系统和抗氧化体系(P<0.05),破坏细胞膜和线粒体结构。联合暴露时抑制氨氮吸收作用更为明显。斜生栅藻对PFOA 的去除率仅有2%,对Zn2+去除率最高(37.5%)且随暴露浓度的增加而逐渐降低,表明斜生栅藻可以有效去除锌污染,但对全氟辛酸污染去除效果欠佳。

