维生素C对禁食黄颡鱼抗氧化能力和肌肉品质的影响
汪 兰,夏雨婷,胡 澳,陈 朗,郭晓嘉,乔 宇,吴文锦,石 柳,黄 云,彭条凤,熊光权,陈 胜
(1.湖北省农业科学院农产品加工与核农技术研究所,农业农村部农产品冷链物流技术重点实验室,湖北 武汉 430064;2.湖北省农业科技创新中心农产品加工研究分中心,湖北 武汉 430064;3.湖北工业大学生物工程与食品学院,湖北 武汉 430068;4.湖北华醇食品有限公司,湖北 荆门 420800)
黄颡鱼(Pelteobagrus fulvidraco)隶属于鲇形目(Silurformes)鲿科(Bagride)黄颡鱼属(Pelteobagrus),其肉质鲜甜美味,是近些年我国大范围推广养殖的淡水经济鱼类。黄颡鱼主要以鲜活品畅销于国内,在东南亚国家也拥有巨大的市场潜力[1]。然而,鲜活水产品在运输环节不可避免会产生应激,目前水产养殖行业普遍采用的缓解运输应激的技术包括增强鱼体营养物质供应、避免高温养殖以及禁食暂养等[2],其中禁食暂养是最普遍的缓解手段[3]。禁食暂养目的是维持鱼类在生存环境条件下的能量代谢,减少捕捞或者运输导致的应激反应,使肠道分泌物排空,降低耗氧量,提高鱼体的抗逆能力以及肌肉品质[4]。
前人研究发现维生素C(VC)因其抗氧化作用能够有效缓解治疗家禽、牲畜运输过程中应激带来的不利影响[5-6]。另外,VC同样常被用作饲料添加剂激活生物体内相关酶活,能够防治鱼类贫血症和出血症,促进鱼类快速生长,增强机体抵抗性并提升特异性免疫功能[7-9]。本研究团队之前发现运输水体中添加VC能够缓解运输热应激引起的虹鳟(Oncorhynchus mykiss)应激反应以及改善肌肉品质[10]。但目前尚缺乏关于VC用于黄颡鱼禁食暂养改善其肌肉品质的研究报道。本研究通过探究不同添加浓度VC对禁食暂养的黄颡鱼血清和肌肉抗氧化特性及肌肉品质的影响,以期探索更为有效的鱼类暂养手段,为鲜活黄颡鱼的耐运性及品质提升提供理论依据。
1 材料与方法
1.1 原料和试剂
鲜活黄颡鱼,(130 ± 20)g,购于湖北省武汉市白沙洲生鲜市场。
维生素C(VC)购于国药集团化学试剂有限公司;超氧化物歧化酶(SOD)试剂盒、过氧化氢酶(CAT)试剂盒、还原型谷胱甘肽(GSH)试剂盒、丙二醛(MDA)试剂盒、总蛋白(TP)试剂盒 南京建成生物工程研究所。
1.2 仪器
便携式pH 计、电子分析天平、TGL-24MC 台式高速冷冻离心机,购于长沙平凡仪器仪表有限公司;CR-400 色差计,购于日本Konica-Minolta 公司;TA-XT Plus 质构仪,购于英国Stable Micro Systems公司;UV-2550 分光光度计,购于日本岛津公司;HH-6数显式恒温水浴锅,购于常州国华电器有限公司;NMI20-025V-I成像系统,购于日本尼康公司。
1.3 方法
1.3.1 暂养处理 选取200 尾健康黄颡鱼,以40 尾为一组分别放置于5 个30 L 的专用运输尼龙袋中,每个运输袋中装有20 L 曝气水,运输水温为15.6 ℃,溶氧量8.7 mg/L。运输30 min 放到湖北省农业科学院农产品加工与核农技术研究所室内循环水养殖系统,将200 尾黄颡鱼平均放置在4 个不同的水箱里(1.12 m× 0.70 m × 0.32 m),分为4 组:T0-0组(0 mg/L VC,暂养0 d)、T0-5组(0 mg/L VC,暂养5 d)、T10-5 组(10 mg/L VC,暂养5 d)、T30-5 组(30 mg/L VC,暂养5 d),水中添加VC含量参考文献[11]并略微修改。以50 尾为一组进行暂养,然后用200 mg/L 的MS-222 麻醉进行麻醉,取新鲜背部肌肉测定肌肉品质部分指标,另取血清和背部肌肉,液氮速冻后放入-80 ℃冰箱待测。
1.3.2 抗氧化物质测定 将-80 ℃存放的血清和鱼肉放在4 ℃冰箱解冻3 h,准确称取组织质量,按照质量:体积=1 g∶9 mL 的比例加入4 ℃质量分数0.86%生理盐水,在冰水浴的条件下进行均质,制成质量分数20%的组织匀浆,将制备的组织匀浆在4 ℃下以3 500 r/min离心10 min,取其上清液测定蛋白质量,采用钼酸铵法测定CAT,采用比色法测定GSH,采用TBA 法测定MDA,采用WST-1 法测定SOD,均使用酶标仪并严格按照试剂盒说明书操作。
1.3.3 离心损失率的测定 称取2 g 鱼肉样品,并裁剪纱布,称量纱布的质量记为m1(g);用纱布包裹鱼肉后,称取纱布和鱼肉总质量,记为m2(g)。用两张大滤纸包裹纱布和鱼肉,将其置于离心管中,以3 500 r/min常温离心10 min,再次称其质量,记为m3(g)。离心损失率(%)按下列公式计算:
1.3.4 色泽测定 将经过处理的黄颡鱼背部肌肉取出,使用色差仪测定样品剖面的亮度L*、红绿度a*、黄蓝度b*值。a*值正值表示红色,负值表示绿色;b*值正值表示黄色,负值表示蓝色。先对仪器进行校准,在对其所需部位进行测量,每组样品测5 次,取平均值按下列公式计算:
1.3.5 质构特性测定 取黄颡鱼背部肌肉,采用质构仪测定弹性和黏性。将样品置于P/36R 探头下,测试条件为:测前速率2 mm/s、测中速率0.5 mm/s、测后速率2 mm/s、测试深度5 mm、触发力为49 N、计算阈值为20 g。每组样品每个平行重复测定9次,结果取平均值。
1.3.6 剪切力测定 将鱼肉修剪为鱼块后,将其置于质构仪A/CKB 探头下,剪切力测定参数为:力臂25 kg、压缩变形50%、测前速率5.0 mm/s、测中速率1.0 mm/s、测后速率5.0 mm/s。
1.3.7 pH 值测定 将鱼肉剁碎,称取1.0 g 的鱼肉装入15 mL 离心管,加入9 mL 蒸馏水,置于4 ℃冰箱静置30 min,用精密pH 计测定上层澄清液pH 值并记录。每个样品做3次平行实验,结果取平均值。
1.3.8 组织微观结构观察 沿着垂直于鱼肉肌纤维方向进行取样(1 cm×2 cm×6 mm),将其置于质量分数4%的多聚甲醛固定液中固定24 h 以上。固定完成后取出进行修整,依次放入质量分数15%、30%蔗糖溶液中脱水。脱水完成后吸干表面水分,置于包埋台上,组织周围滴加冷冻切片包埋剂,然后将其放在冰冻切片机上速冻包埋,切片,厚度为8~10 µm,苏木素-伊红染液染色,然后置于光学显微镜下观察组织微观结构,利用Case Viewer 和Image J软件处理图像。
1.4 数据处理
数据使用Excel 软件进行处理,采用SPSS 27.0软件中的Duncan 法进行差异显著性分析,P<0.05表示差异显著,用GraphPad Prism 5.0软件作图。
2 结果
2.1 维生素C对禁食黄颡鱼血清抗氧化体系的影响
如图1所示,经过5 d禁食暂养,相比于T0-0组,T0-5 组的黄颡鱼血清中CAT、GSH、谷胱甘肽过氧化物酶(GSH-PX)活性和脂质过氧化产物MDA 含量均显著下降(P<0.05),而超氧化酶歧化酶(SOD)活性无显著变化(P>0.05)。暂养5 d 后,随着维生素C 添加量的增加,黄颡鱼血清中抗氧化物质的活性呈现先上升后下降的趋势,脂质过氧化产物MDA 的含量呈现先下降后上升的趋势。其中,相比于T0-5 组,添加10 mg/L VC的禁食暂养组(T10-5)血清中抗氧化物质SOD、CAT、GSH、GSH-PX 活性均显著增强(P<0.05),而添加30 mg/L VC的禁食暂养组(T30-5)的血清中除GSH 活性显著升高(P<0.05),其他抗氧化物质活性未有显著变化(P>0.05)。

图1 维生素C对禁食黄颡鱼血清中抗氧化体系的影响Fig.1 Effects of temporary VC supplementation on antioxidant system in the serum of yellow catfish after fasting
2.2 维生素C对禁食黄颡鱼肌肉抗氧化体系的影响
如图2所示,经过5 d暂养,相比于T0-0组,T0-5组黄颡鱼肌肉中SOD 活性显著较高(P<0.05),CAT、GSH 活性和MDA 含量显著较低(P<0.05)。T10-5组肌肉中SOD 和GSH 活性显著高于T0-5组,而T30-5 组肌肉中SOD 和GSH 活性显著低于T0-5组,这两组CAT 活性和MDA 含量未有显著变化(α=0.05)。

图2 维生素C对禁食黄颡鱼肌肉中抗氧化体系的影响Fig.2 Effects of temporary vitamin C supplementation on antioxidant system in the muscle of yellow catfish after fasting
2.3 维生素C对禁食黄颡鱼肌肉组织结构的影响
如图3 所示,相比于T0-0 组,T0-5 和T10-5 组的黄颡鱼肌肉组织结构有明显的改变,表现为肌肉间隙逐渐缩小,肌肉组织逐渐变紧,纤维变得结构更加致密均匀。而T30-5 组的肌肉组织则又表现为相对松散的结构,且肌肉间隙变大。
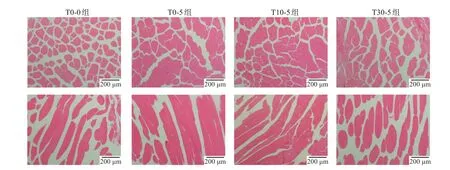
图3 维生素C对禁食黄颡鱼肌肉组织结构的影响Fig.3 Effects of temporary vitamin C supplementation on histology of muscle in yellow catfish after fasting
2.4 维生素C对禁食黄颡鱼肌肉品质的影响
如图4 所示,相比于T0-0 组,暂养5 d 能显著改变黄颡鱼肌肉的白度值和离心失水率(P<0.05),对pH 值影响不大。随着维生素C 添加量的增加,黄颡鱼肌肉pH 值显著降低(P<0.05),白度值先增加后下降,离心失水率先降低后升高。暂养5 d 能显著降低黄颡鱼肌肉的剪切力、硬度、咀嚼性、黏性(P<0.05)。随着维生素C 的添加,黄颡鱼肌肉的剪切力、硬度、咀嚼性、黏性、弹性均呈现先上升后下降的变化。相比于T0-5组,T10-5组肌肉的剪切力、硬度、咀嚼性和黏性显著升高(P<0.05),弹性有所升高但不显著(P>0.05),T30-5 组肌肉的硬度显著升高(P<0.05),但剪切力、咀嚼性、黏性和弹性未有显著变化(P>0.05)。T30-5 组相比于T10-5 组的肌肉剪切力、咀嚼性、黏性均显著下降(P<0.05),硬度和弹性有所下降但不显著(P>0.05)(表1)。
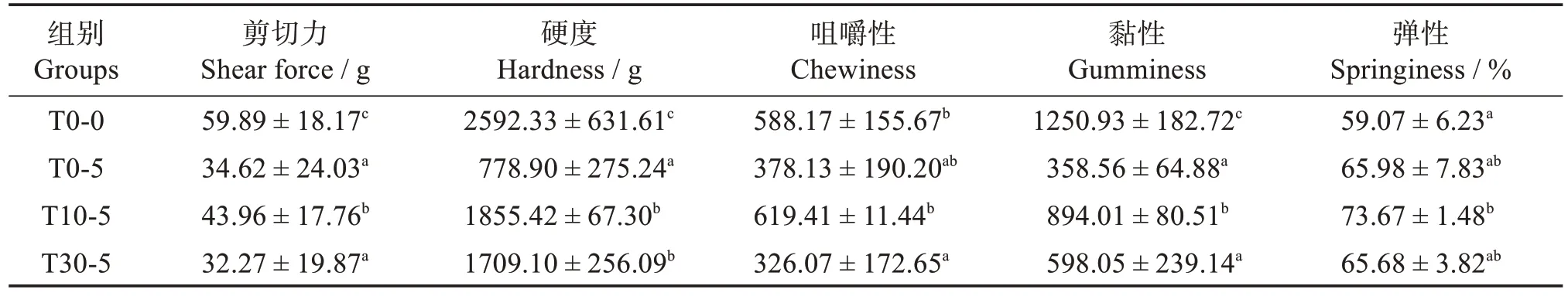
表1 维生素C对禁食黄颡鱼肌肉质构特性的影响Table 1 Effects of temporary vitamin C supplementation on muscle texture characteristics of yellow catfish after fasting

图4 维生素C对禁食黄颡鱼肌肉品质的影响Fig.4 Effects of temporary vitamin C supplementation on muscle qualities of yellow catfish after fasting
3 讨论
鱼类在过程中普遍存在着应激反应,表现为鱼体代谢过程显著加强,大量氧自由基生成引起氧化应激,进一步导致机体细胞、组织损伤,引发生理紊乱和严重的经济损失[11]。VC具有促进鱼类生长、减少组织氧化损伤、提高抗应激能力及免疫力、促进机体代谢和缓解重金属对机体的危害等作用[12-16]。本研究在黄颡鱼禁食暂养条件下进一步探究不同VC含量添加对黄颡鱼抗氧化能力和肌肉品质的影响。
鱼类表现的抗氧化应激能力主要依靠抗氧化系统起作用,分为酶促抗氧化系统和非酶促抗氧化系统,酶促抗氧化系统中有包括SOD、CAT、GSHPX,非酶类抗氧化物质系统有GSH[17]。本研究发现,相比于T0-0 组,T0-5 组血清和肌肉中的抗氧化物质活性显著下降,这可能是因为鱼体应激产生大量的自由基,导致抗氧化系统被激活,抗氧化酶活性增强,以更好清除所产生的自由基。而禁食暂养有助于鱼体恢复生理稳态,抗氧化物质活性随之减弱。类似的研究发现运输应激会引起黄颡鱼SOD活性显著升高,麻醉剂的添加会降低鱼体活动,改善应激反应,降低SOD的活性[18],而氨氮胁迫会导致虹鳟(Oncorhynchus mykiss)肌肉中SOD、CAT 活性显著增强[19],也会导致红鳍东方鲀(Takifugu rubripes)血清中SOD、CAT、GSH-PX 和GSH 活性显著增强[20]。本研究也发现10 mg/L VC禁食暂养5 d能显著提高黄颡鱼血清和肌肉中抗氧化物质的活性,这与VC作为饲料添加剂能增强黄颡鱼幼鱼血清中抗氧化物质活性和增强草鱼(Ctenopharyngodon idella)SOD、GSH 活性以应对重金属诱导的氧化应激的结果一致[1,21]。此外,添加10 mg/L VC组血清和肌肉中GSH 酶活性均高于其他三组,说明浓度为10 mg/L 的VC能够增强黄颡鱼的非酶促抗氧化系统,增强清除自由基的能力[22]。而在血清中,GSH-PX 的酶活性最高,这是由于GSH-PX 能够催化GSH 将H2O2分解为水,添加10 mg/L的VC能够促进GSH-PX酶活性增加,从而加速GSH 对H2O2的分解,达到清除自由基的目的。30 mg/L VC禁食暂养组相比于10 mg/L VC禁食暂养组的黄颡鱼抗氧化能力显著下降,这可能是因为较高浓度VC会损坏黄颡鱼抗氧化系统,导致抗氧化物质的活性下降。与刘汉鹏等[23]关于盘丽鱼(Symphysodon aequifasciata)幼鱼VC最适添加量以及Xu 等[24]关于VC对银鲑(Oncorhynchus kisutch)抗氧化能力的研究结果一致,本研究也发现黄颡鱼抗氧化能力随着VC的浓度先上升后下降,10 mg/L低质量浓度VC能促进黄颡鱼抗氧化能力。MDA 作为脂质氧化的主要产物,具有非常强的生物毒性[25-26],常常作为评价水产品肌肉品质劣变的关键指示物[10,27-28]。本研究中MDA 的含量与抗氧化物质活性的变化呈现相反变化特征,这也与周传朋等[29]对鱼类抗氧化体系的研究结果一致。
黄颡鱼作为重要的淡水经济鱼类,其消费状况与肌肉品质密切相关。禁食暂养作为水产品上市前的重要环节能够有效改善鱼类品质[2],本研究中T0-0 组的肌纤维间隙明显增大,样品组织结构较为松散,这说明黄颡鱼在经过运输后氧化应激增强,导致品质劣化。而禁食暂养组肌纤维间隙减小,且T10-5组纤维间隙较紧密,说明添加10 mg/L VC能够维持肌肉组织的完整性。此外,添加30 mg/L VC的肌肉纤维组织结构完整性被破坏,导致细胞发生破裂。VC添加的量不同对禁食暂养黄颡鱼的肌肉品质会有不同程度的影响。pH 值虽能一定程度上反映鱼肉的新鲜度[30],但由于VCpH 呈酸性,这导致鱼肉的pH 随着维生素的添加显著降低。添加10 mg/L的VC白度值最高,说明通过向水体添加适当浓度的VC,能够使黄颡鱼色泽更鲜亮。通过禁食暂养后,离心损失率均较T0-0 组有所降低,说明黄颡鱼经过禁食暂养后能够提高肌肉的保水性。T10-5 组离心损失率最低,说明添加10 mg/L 的VC能够进一步增强肌肉的保水,而添加30 mg/L VC又会导致肌肉水分的流失,持水力降低。质构能够评价肌肉组织的物理特性,分别从剪切力、硬度、弹性、咀嚼性等指标来评价肌肉的品质的好坏[31]。研究结果发现随着VC添加量的增加,黄颡鱼肌肉的剪切力、硬度、咀嚼性、黏性、弹性均呈现先上升后下降的变化状态,这表明10 mg/L 的VC能显著提高黄颡鱼肌肉的质构特性,使鱼肉更加紧致且富有弹性,增强鱼肉的口感,而30 mg/L 的VC对肌肉品质没有显著的影响,与前文抗氧化能力的结果以及组织结构的结果一致,也与前人报道的饲料添加VC提高草鱼[32]、大菱鲆(Scophthalmus maximus)[33]肌肉品质的研究结果一致。
4 结论
禁食暂养5 d 能有效缓解因运输导致的黄颡鱼应激反应,相较于T0-0 组,其抗氧化物质活性下降,肌肉品质提升。而10 mg/L 的维生素C 禁食暂养能显著提高黄颡鱼抗氧化能力和肌肉品质,但较高质量浓度(30 mg/L)维生素C 对黄颡鱼的提升效果并不明显,甚至产生负面影响。

