胶原蛋白Ⅴ型2链对胃癌细胞增殖、迁移和侵袭及肿瘤生长的调控作用
仇建玲,吴胜文,俞进友,朱正峰
作者单位:扬州大学建湖临床医学院,江苏 盐城 224700
胃癌(GC)是一种常见的消化道恶性肿瘤,其全球发病率排名第5 位,病死率排名第2 位[1-2]。随着医疗技术的发展,该病通过手术切除联合放疗、化疗治疗,病人的生存期明显得到延长。但是,晚期或转移病人的预后仍不令人满意。由于早期胃癌的症状不明显,缺乏特异的诊断方法,大多数病人确诊时已中晚期,错失手术切除的机会。因此,鉴别胃癌中异常表达的关键基因是早期诊断、治疗胃癌病人的重要途径。胶原蛋白是细胞外基质的主要成分,胶原Ⅴ型α2 链(COL5A2)则为胶原蛋白家族的重要成员[3-4]。COL5A2 参与免疫系统调节、血管生成和肿瘤转移,在结直肠癌、乳腺癌和骨肉瘤的发生发展中具有一定作用[5-7]。近两年,COL5A2在胃癌中的功能不断被挖掘,但是其对胃癌细胞的恶性细胞表型变化的作用尚未清楚。本研究推测,COL5A2 可能是胃癌的潜在生物标志物和治疗靶点,于2022 年1—3 月开展研究COL5A2 对胃癌细胞增殖、迁移和侵袭及肿瘤生长的调控作用,报告如下。
1 材料与方法
1.1 材料15只SPF雄性裸鼠[BALB/c-nu,5~6周,(18±2)g]购自北京维通利华实验动物技术有限公司。
正常人胃黏膜上皮细胞GES-1、胃癌细胞MGC-803 、MKN-45 、SGC7901 均购自中国科学研究院上海细胞库;慢病毒表达载体pHBLV-U6-MCS-CMVZsGreen-PGK-PURO、慢病毒包装载体均购自汉恒生物科技(上海)有限公司;碘化丙啶(PI)染液购自美国Sigma 公司;荧光定量聚合酶链式反应(qRTPCR)试剂盒购自北京天根生化科技有限公司;CCK8 试剂盒、5-乙炔基-2'-脱氧尿苷(EdU)细胞增殖检测试剂盒均购自日本TAKERA 公司;实时荧光定量 PCR 系统购自美国ABI 公司;多功能凝胶成像系统购自美国BIO-RAD;Beckman Lab Quanta SC 型流式细胞仪购自美国Beckman Coulter公司。
1.2 方法
1.2.1细胞的培养 GES-1、MGC-803、MKN-45、SGC7901 细胞在37 ℃的饱和湿度5%二氧化碳的恒温细胞培养箱中培养,所有培养液为DMEM 培养基(含有10%胎牛血清+1%双抗)。常规检测支原体污染评估,每2天更换一次培养基。
1.2.2细胞分组与处理 根据Gene ID: 1290,NCBI参考序列:NC_000002.12的COL5A2基因的SD 序列在siDirect 2.0 中设计、筛选COL5A2 的干扰序列(CAGAAGAATGGTACAAATCCAAG),正向序列:5′UGGAUUUGUACCAUUCUUCUG3′反向序列5′GAAGAAUGGUACAA AUCCAAG3′。将酶切后的干扰载体pHBLV-U6-MCS-CMV- ZsGreen-PGKPURO 与干扰COL5A2 连接,插入感受态,菌液鉴定后扩大培养,抽提质粒。然后进行慢病毒的包装,将质粒与慢病毒包装辅助质粒(psPAX2 载体和pMD2G 载体)进行高度提取,转染至293T 细胞,培养48 h 后,收集上清浓缩纯化,获得高滴度的慢病毒溶液。将沉默COL5A2 的慢病毒转染至MKN-45细胞,在37 ℃,5%二氧化碳细胞培养箱中培养8 h,更换新培养基继续培养48 h,RT-qPCR、WB 实验验证沉默效率,设为shRNA 组、shRNA-COL5A2 组。未转染的MKN-45 细胞在含有10%胎牛血清的DMEM培养基中培养,设为NC组。
1.2.3COL5A2 在胃癌中的数据挖掘 在starbase中的panGene Diff Exp 搜索COL5A2 在胃癌STAD 中的表达。GEPIA 检索COL5A2 在胃癌“STAD”中的表达及对胃癌分期、生存的预测。
1.2.4COL5A2 表达检测 qRT-PCR 实验、WB 实验检测不同组细胞中COL5A2 的mRNA 和蛋白表达水平。qRT-PCR 实验:对数期的细胞用0.25%胰酶消化,收集,用TRIzol液提取总RNA。在RNA 分离后,将10 μg 总RNA 与2 U/μg RNase R 在37 ℃下培养45 min。随后使用RNA 浓缩、回收试剂盒对产品进行纯化,并以纯化的产物为底物合成cDNA。用RT-qPCR 试剂盒检测cDNA 中COL5A2 的表达。GAPDH 做内源内参,2-ΔΔCt法计算结果。COL5A2:正向,AACATCAGTTGGGTGGAG,反向,CTTGAAATCGGTGTAGGC;GAPDH:正向,ATCCGATT ACCGATACCTAGACC,反向,ATGGACTATATCCGACGACGA。
蛋白质印迹实验:胰酶消化对数生长期细胞,收集。用RIPA 裂解液、超声裂解充分裂解细胞,提取总蛋白。DC 蛋白测定检测蛋白浓度,加样前100 ℃变性5 min。分离凝胶、浓缩凝胶使用6%~15%浓度的聚丙烯酰胺配置,灌胶。电泳时,开始用80 V电压10 min,然后继续使用120 V电压1.5 h,最后用25 V 电压电泳2 h。结束后,用转膜仪湿转至PVDF 膜,再用5%的脱脂乳封闭液室温封闭2 h。在4°C 的低温条件下将膜与一抗溶液(兔抗COL5A2多抗,1∶1 000;兔抗CyclinD1、CDK4 多抗,1∶1 500)孵育过夜。在室温下与500倍稀释的HRP标记的二抗孵育1 h。Image Lab 图像采集和分析软件分析条带强度。
1.2.5细胞增殖检测 克隆形成实验、CCK8 实验、EdU染色检测细胞的增殖情况。
克隆形成实验:将各组细胞以1 000 个细胞/孔的密度接种6孔细胞培养皿。细胞培养15 d,PBS洗涤,4%多聚甲醛固定20 min,1%结晶紫染色30 min。在显微镜视野内随机选择的5 个区域进行菌落计数。
CCK8实验:将各组细胞以5×103个细胞/孔的浓度接种到96 孔板中。然后在490 nm 处检测光密度(OD490)。
EdU 染色细胞增殖检测:使用EdU 检测试剂盒检测细胞的增殖能力。将大约105个细胞接种到24孔培养皿,并与DMEM 培养基孵育24 h。每个孔加入400 μL 的EdU 培养液(50 μmol/L),37 °C 培养4 h。用PBS 洗涤2 次,将细胞用150 μL 的4%多聚甲醛固定30 min,用150 μL 的甘氨酸(2 g/L)脱色5 min,并在脱色摇床中用0.5%Triton X-100 渗透10 min。将每个孔中的细胞依次与400 μL 1×Apollo 染色溶液和400 μL 1×Hoechst3342 溶液在黑暗中反应30 min。最后,荧光显微镜下捕获细胞图像,并使用Image J软件计算EdU阳性率。
1.2.6细胞周期分布检测 PI 染色检测细胞周期分布:0.25%的胰酶消化细胞,用4 ℃的PBS 溶液悬浮,制成单细胞悬液。用70%乙醇溶液4 ℃固定 30min,避免细胞成块,需保持单悬液。RNase A 去除多余的RNA。加入PI 染色(50 mg/L),避光染色30 min。上流式细胞仪进行细胞周期的分布检测,Summit 4.0分析实验结果。
1.2.7细胞迁移侵袭检测 Transwell 实验、伤口愈合实验检测细胞的迁移、侵袭能力。
Transwell 法检测细胞迁移、侵袭。将各组细胞用无血清培养基饥饿培养12 h,按照每孔1×104个细胞(100 μL)的密度,将细胞接种在Transwell 小室(8 μm 孔径)上室。将600 μL 含有20%胎牛血清的培养基放入下室,把细胞放在培养箱中培养24 h。取出培养箱,用棉签擦拭未穿膜的细胞,将附着于膜下表面的细胞用90%乙醇固定10 min,0.1%结晶紫染色5 min,PBS 冲洗3 次,倒置显微镜下拍照,随机选择5个区域进行细胞计数。
伤口愈合实验:将各组细胞接种在6孔培养板,每孔1×105个细胞,用不含血清的培养基在37 ℃,5%二氧化碳的条件下培养24 h。然后,在每个孔的底部用200 μL 的无菌枪头垂直底部直径划线。测量划痕宽度,并记录为0 h(mm)。将培养液更换为新鲜的无血清培养基,继续培养24 h,再次测量,并记录划痕宽度24 h(mm)。划痕愈合率的公式为(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%。
1.2.8裸鼠成瘤实验 将裸鼠采用随机数字表法分为3 组,每组5 只,标记为NC 组、shRNA 组、shRNA-COL5A2 组。将各组细胞用PBS 溶液收集,皮下注射至小鼠左腋窝下,每只106个细胞(1 mL)。第7、14、21、28 d 测量一次肿瘤体积(最长直径mm×最短直径mm)。实验结束时处死所有小鼠,解剖并称肿瘤质量(g)。该方案符合一般动物实验伦理学原则。肿瘤组织用4%多聚甲醛保存。
1.2.9免疫组织化学实验检测肿瘤组织PCNA 蛋白 取出固定12 h 的肿瘤组织,制作石蜡切片。石蜡切片在二甲苯中脱蜡,然后依次用无水乙醇、90%乙醇、70%乙醇各处理5 min。置于95 ℃的3%EDTA(pH 8.0)溶液中加热10 min 进行抗原热修复。然后用20%的山羊血清室温封闭30 min,再与500倍稀释的鼠PCNA单抗37 ℃孵育1 h,HRP标记的山羊抗鼠二抗(含0.05%的吐温-20)37 ℃孵育1 h,DAB 显色,苏木精复染。流水冲洗后,脱水、透明、封片,200倍显微镜下观察、拍照。
1.3 统计学方法SPSS26.0、Graphpad Prism 8.0 分析实验数据、绘制图片。每个实验重复3次,每次做3 个平行复孔。实验中的数据均为计量资料,±s表示,行单因素方差分析F检验和独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 COL5A2在胃癌中的表达与正常组织相比,胃腺癌组织中COL5A2 表达水平明显升高(P<0.05)见表1;STADⅡ~Ⅳ期胃腺癌组织COL5A2表达水平显著高于Ⅰ期(P<0.05);见表2,TCGA 数据库分析散点图显示胃腺癌组织中COL5A2表达水平明显高于正常组织(图1A)。与COL5A2 高表达组相比,COL5A2 低表达组的STAD 病人其总生存率[LogrankP=0.0074,HR=2,P=0.009 5]显著升高,见图1B。与GES-1 细胞相比,MGC-803、MKN-45、SGC7901 细胞中COL5A2 的mRNA 和蛋白表达均显著升高(P<0.05),见图2和表3。
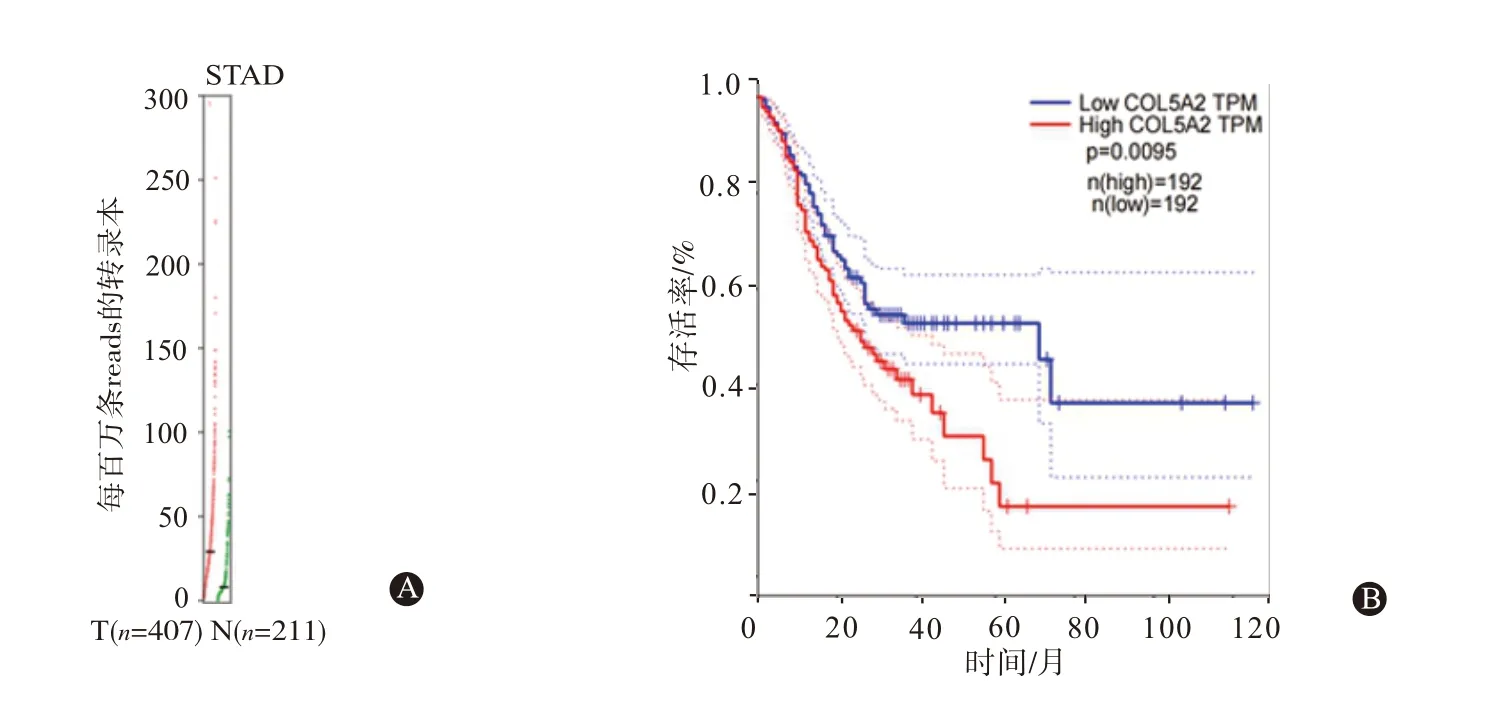
图1 COL5A2在胃癌组织中的表达:A为TCGA数据库分析COL5A2在STAD中的表达;B为COL5A2水平与存活率的相关性

图2 胃癌细胞COL5A2蛋白表达
表1 胃腺癌组织与正常组织COL5A2表达情况/± s

表1 胃腺癌组织与正常组织COL5A2表达情况/± s
组别胃腺癌组织正常组织t值P值组织数/个375 32 COL5A2表达4.74±0.45 2.53±0.26 27.37<0.001
表2 不同STAD分期胃腺癌组织COL5A2表达比较/± s

表2 不同STAD分期胃腺癌组织COL5A2表达比较/± s
STAD分期Ⅰ期Ⅱ期Ⅲ期Ⅳ期F值P值例数34 100 188 53 COL5A2表达4.26±0.38 4.80±0.46 4.78±0.44 4.78±0.45 14.64<0.001
表3 COL5A2在胃癌细胞MGC-803、MKN-45 、SGC7901中的表达/± s
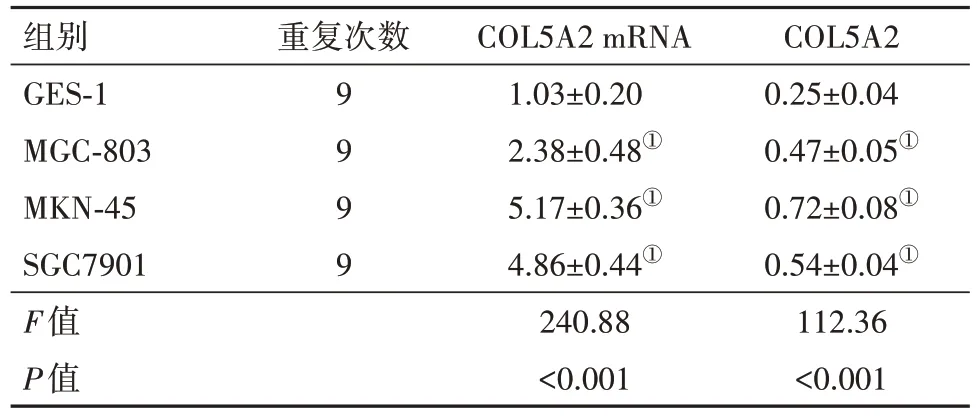
表3 COL5A2在胃癌细胞MGC-803、MKN-45 、SGC7901中的表达/± s
注:①与GES-1组相比,P<0.05。
组别GES-1 MGC-803 MKN-45 SGC7901 F值P值COL5A2 0.25±0.04 0.47±0.05①0.72±0.08①0.54±0.04①112.36<0.001重复次数9 9 9 9 COL5A2 mRNA 1.03±0.20 2.38±0.48①5.17±0.36①4.86±0.44①240.88<0.001
2.2 沉默COL5A2 稳转MKN-45 细胞模型构建及对细胞增殖的影响与shRNA 组细胞相比,shRNACOL5A2 组细胞COL5A2 的mRNA 和蛋白表达均显著降低,克隆形成细胞数显著降低,细胞在48、72 h的活性显著降低,EdU 阳性率显著降低(P<0.05),见表4,图3。

图3 5-乙炔基-2'-脱氧尿苷(EdU)染色细胞图(×200)
表4 沉默COL5A2的MKN-45细胞活性检测/± s
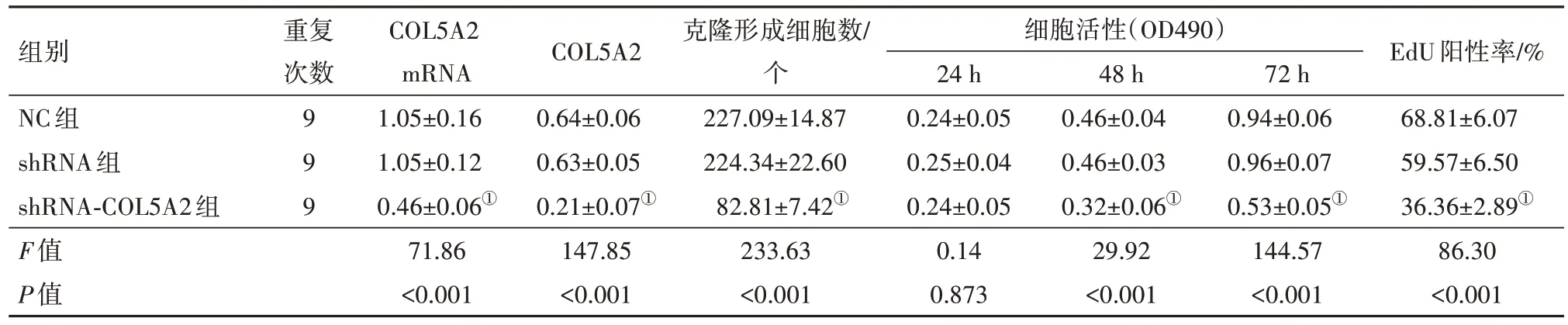
表4 沉默COL5A2的MKN-45细胞活性检测/± s
注:①与shRNA组相比,P<0.05。
组别NC组shRNA组shRNA-COL5A2组F值P值重复次数COL5A2 mRNA 1.05±0.16 1.05±0.12 0.46±0.06①71.86<0.001 COL5A2 0.64±0.06 0.63±0.05 0.21±0.07①147.85<0.001克隆形成细胞数/个227.09±14.87 224.34±22.60 82.81±7.42①233.63<0.001细胞活性(OD490)24 h 0.24±0.05 0.25±0.04 0.24±0.05 0.14 0.873 48 h 0.46±0.04 0.46±0.03 0.32±0.06①29.92<0.001 72 h 0.94±0.06 0.96±0.07 0.53±0.05①144.57<0.001 EdU阳性率/%68.81±6.07 59.57±6.50 36.36±2.89①86.30<0.001 9 9 9
2.3 沉默COL5A2 基因表达胃癌细胞周期和周期相关蛋白表达的影响与shRNA 组细胞相比,shRNA-COL5A2 组细胞在G1 期明显降低,S 期明显升高,CyclinD1 和CDK4 的表达蛋白均显著降低(P<0.05),见图4和表5。
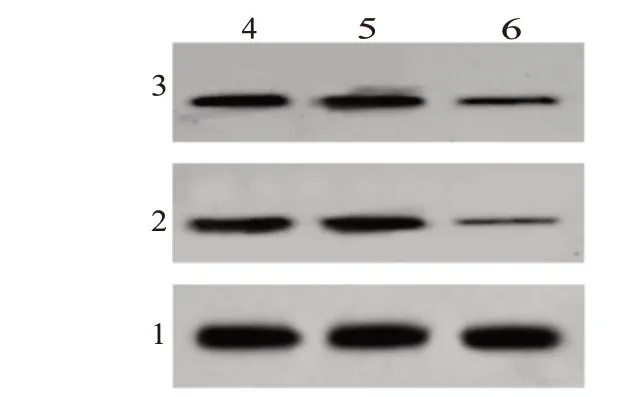
图4 CyclinD1、CDK4的蛋白表达
表5 沉默COL5A2诱导胃癌细胞周期阻滞和抑制CyclinD1和CDK4蛋白表达/± s
表5 沉默COL5A2诱导胃癌细胞周期阻滞和抑制CyclinD1和CDK4蛋白表达/± s
注:①与shRNA组相比,P<0.05。
组别NC组shRNA组shRNA-COL5A2组F值P值重复次数细胞周期CDK4 0.46±0.05 0.46±0.05 0.23±0.04①72.14<0.001 S G1 68.47±2.18 69.12±2.51 55.79±1.87①104.82<0.001 G2 18.71±1.79 17.72±2.11 18.10±2.12 0.55 0.582 9 9 9 12.25±1.99 12.27±2.05 21.59±3.71①35.73<0.001 CyclinD1 0.52±0.07 0.54±0.05 0.25±0.03①85.34<0.001
2.4 沉默COL5A2 对胃癌细胞迁移和侵袭的影响与shRNA 组细胞相比,shRNA-COL5A2 组细胞迁移数量和侵袭数量均显著降低,划痕愈合率也显著降低(P<0.05),见表6。
表6 沉默COL5A2对胃癌细胞迁移和侵袭的影响/± s
表6 沉默COL5A2对胃癌细胞迁移和侵袭的影响/± s
注:①与shRNA组相比,P<0.05。
组别NC组shRNA组shRNA-COL5A2组F值P值重复次数9 9 9迁移数/个230.70±17.01 217.74±34.76 112.03±12.80①68.86<0.001侵袭数/个124.26±11.57 116.16±6.30 41.51±11.18①188.20<0.001划痕愈合率/%83.16±3.16 83.81±5.97 66.07±3.94①44.68<0.001
2.5 沉默COL5A2 基因表达对胃癌细胞移植瘤大小的影响与shRNA 组细胞相比,shRNA-COL5A2组裸鼠成瘤在14、21、28 d 的体积明显降低,肿瘤的重量也显著降低,组织中PCNA 蛋白显著降低(P<0.05),见表7,图5。
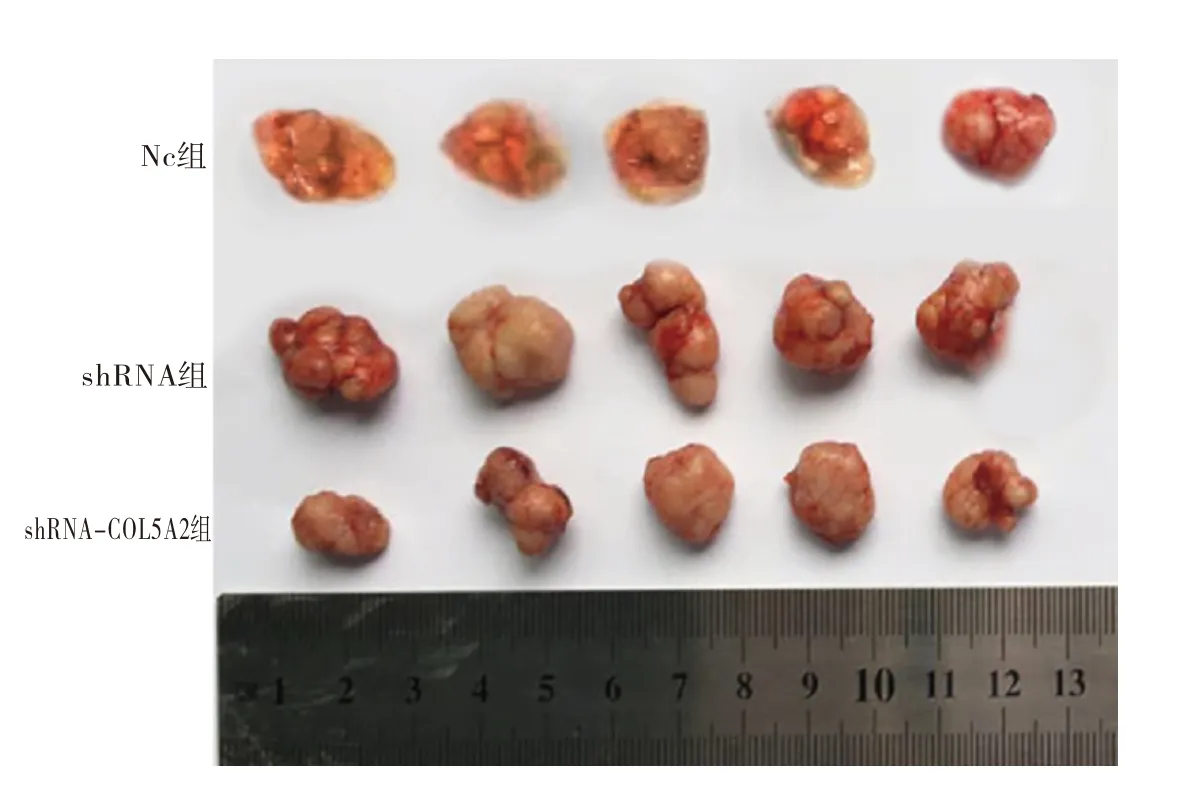
图5 裸鼠成瘤图
表7 沉默COL5A2基因对胃癌细胞体内移植瘤的影响/± s
表7 沉默COL5A2基因对胃癌细胞体内移植瘤的影响/± s
注:①与shRNA组相比,P<0.05。
组别NC组shRNA组shRNA-COL5A2组F值P值体积/mm3 PCNA 0.74±0.05 0.72±0.08 0.29±0.05①153.08<0.001重复次数5 5 5 7 d 30.42±1.84 27.41±3.15 29.48±2.89 2.96 0.071 14 d 178.63±13.33 177.40±16.43 148.65±7.62①15.37<0.001 21 d 433.57±31.38 411.74±31.01 320.99±17.63①42.64<0.001 28 d 604.92±93.81 648.84±70.21 415.94±32.82①27.93<0.001质量/g 0.82±0.05 0.83±0.08 0.34±0.07①153.46<0.001
3 讨论
细胞外基质是人体组织微环境中分布最广泛的组成部分,其各成分的失调在肿瘤微环境的生成、维持中起至关重要的作用[8]。细胞外基质包括基底膜和间质基质两种基质,基底膜是位于上皮细胞、内皮细胞基底部的膜;间质基质是细胞外基质的主要成分,在细胞迁移、细胞黏附、血管生成、组织发育和修复中发挥重要作用[9]。肿瘤相关细胞外基质是肿瘤微环境失调的主要参与者,其在癌症的恶化、临床基因治疗效果及病人预后中具有很大的研究价值。
胶原蛋白是构成细胞外基质的骨架,它占人体总蛋白质质量的30%。基底膜的破坏、上皮细胞的间质转化是癌症发生、发展、转移的微环境信号。基底膜的主要成分是形成网络的胶原,如Ⅳ型和Ⅷ型胶原,而间质膜的主要是形成纤维的Ⅰ型、Ⅱ型、Ⅲ型、Ⅴ型、Ⅺ型等胶原和由基质中退行的成纤维细胞合成的珠状纤维状Ⅵ型胶原[10]。而关于胶原在肿瘤中的功能研究仍在进行,目前学者认为胶原与肿瘤的生长、转移及维持肿瘤微环境有关[11-12]。本研究基于TCGA数据库发现,COL5A2在胃腺癌组织中高表达,并且与病人的分期、低存活率相关。
COL5A2 是COL5 家族成员,在肿瘤中的异常表达,影响肿瘤的恶性程度和进展[13],但COL5A2在胃癌中的临床作用及功能机制尚不清楚。Tan 等[14]发现,在胃癌细胞中,COL5A2 敲除能够抑制癌细胞的迁移能力,减少肝脏转移小鼠的肝结节数量,揭示在COL5 家族成员中,COL5A2 与晚期胃癌的关系最密切,COL5A2 高表达与不良预后相关。Ding 等[15]通过免疫组织化学法检测胃癌组织中COL5A2的表达与病理分级、转移、分期显著相关,是胃癌的独立预后因素。本研究结果显示:COL5A2 在胃癌中高表达,与病人预后差有关;体外细胞研究发现,敲减COL5A2 抑制癌细胞的增殖、迁移、侵袭,阻滞G1/S,体内裸鼠成瘤发现,敲减COL5A2后,肿瘤的生长得到控制,瘤子中PCNA 也降低。这些研究充分说明了COL5A2 在胃癌中发挥致癌作用,这也与Tan、Ding 的研究结果相吻合。同时,该研究结果还暗示了COL5A2 抑制剂在胃癌治疗中的前景。COL3A1/FBN1/COL5A2/SPARC-miR-29a-3p-H19 ceRNA 网络在胃癌中具有很高的预后价值[16-17],而本研究并未对COL5A2 在整个肿瘤环境中的调控网络进行研究,因此,本课题组计划开展COL5A2的肿瘤微环境调控机制探究,为COL5A2 在胃癌中的应用提供更充分的作用机制理论依据。
综上所述,COL5A2 在胃癌中高表达,促进癌细胞的增殖、迁移和侵袭,有利于裸鼠成瘤的生长,为胃癌的基因治疗提供新依据。

