糖尿病视网膜病变与睡眠障碍的相关性
周紫曦 王禹 臧博 丁晓霞 臧冬晓 李冬
作者单位:抚顺市眼病医院,抚顺 113000
糖尿病视网膜病变(Diabetic retinopathy,DR)是糖尿病的微血管并发症,是全球可预防性失明的主要原因[1]。据国际糖尿病联盟糖尿病图谱第10版报道,至2021年全世界有5.37亿人患有糖尿病,仅中国糖尿病患病人数达1.409亿,居全球首位。据估计,到2030年全球糖尿病患者总数将达到6.43亿,到2045年将增加到7.83亿。这种情况使DR的预防和治疗成为一项严峻的公共卫生挑战。鉴于糖尿病的发病率呈现持续上升的趋势,更深入地理解影响DR发病和进展因素变得越来越重要。目前经典危险因素如血糖控制、高血压控制状况和病程长短等并不能完全解释DR的发生和发展[2]。因此,寻找其他独立影响DR发生发展的危险因素对于降低其带来的社会负担至关重要。
睡眠是人类健康的重要组成部分,它对许多生理功能起到恢复作用。睡眠模式和质量的干扰与一系列健康并发症有关,包括心血管疾病、代谢功能障碍和认知障碍等。睡眠障碍已被确认是引发和加速若干疾病的独立风险因素[3-4]。长期的睡眠剥夺、葡萄糖代谢改变等与胰岛素抵抗有关[5],这些使个体更易患上糖尿病及其并发症。此外,某些睡眠障碍中的夜间低氧血症可能加重视网膜缺血,进一步导致DR的进展[6]。因此,近年来已有DR与睡眠障碍关系的研究报道,但研究结果并不一致[7-9]。且研究多以西方人群为研究对象,由于中西方睡眠习惯的差异,DR对睡眠的影响也可能不同。同时,糖尿病患者常合并其他全身疾病,这种合并症会进一步使DR和睡眠之间的关系复杂化。因此本研究通过大样本量社区2型糖尿病患者的眼底检查以及应用睡眠质量量表评估来探讨控制多种混杂因素后,中国人群中DR严重程度与睡眠质量和睡眠时间异常之间的潜在关联,从而了解睡眠与DR的双向关系,在未来的临床工作中重视DR患者的睡眠问题,更早识别DR进展,以便更好为DR患者提供预防策略和干预手段,实现DR患者的全生命周期管理。
1 对象与方法
1.1 对象
纳入标准:①根据美国糖尿病协会的标准诊断为糖尿病[10]:空腹血糖(Fasting plasma glucose,FPG)≥7.0 mmol/L或2 h口服葡萄糖耐量试验(Oral glucose tolerance test,OGTT)≥11.1 mmol/L,或自我报告使用治疗糖尿病药物;②糖尿病确诊年龄>30 岁;③提供身份证明及在此社区居住至少6 个月。排除标准:①无法完成基本信息录入及相关病史采集;②眼底照片无法识别;③未完成匹兹堡睡眠质量指数(Pittsburgh sleep quality index,PSQI)量表;④通过询问病史有其他影响睡眠的全身性疾病,如内分泌疾病、中枢神经系统疾病、精神疾病、恶性肿瘤等器质性疾病。
抚顺市将军街道是抚顺市的老城区,也是抚顺市人口最多的街道,所辖15 个社区,其特点为人口密集且流动性小。据北京眼科研究表明,在已经确诊DR的患者中DR的进展率为35%[11]。考虑到95%的可信区间(Confidence interval,CI) (Z1-α/2=1.96)和0.05的精度(d),约需350例DR患者作为目标样本量。若中国糖尿病人群中DR的患病率约为30%[12],则需要1 167例糖尿病患者。预先估计约25%的患者可能失访,最终估计的样本量约为1 557 例2 型糖尿病患者。本研究于2012 年7 月至2013年5月在抚顺市将军街道通过调取居民健康档案、慢性病管理档案及逐一入户调查等方式,招募所有已明确诊断为2型糖尿病患者2 224例。
根据纳入对象的基本信息进行分组:如根据年龄分为≥65岁组和<65岁组;根据病程分为≥5年组和<5年组;根据教育程度分为文盲、小学、初中、高中、本科及以上组;根据收入分为高收入组(>5 000元)、中等收入组(3 000~5 000元)、低收入组(<3 000元)。根据是否有冠心病史、肾功能不全病史、认知障碍、焦虑症状等临床特征逐一分组。本研究遵循赫尔辛基宣言,并通过抚顺市眼病医院伦理委员会审批(批号:FSYBLL-2012-01)。所有纳入对象均被告知研究目的与步骤,并签署知情同意书。
1.2 方法
1.2.1 调查人员组成 由眼科医师2名,内科医师1名,眼科检查技师2名,验光师2名,问卷调查员3名组成检查队。
1.2.2 质量控制 参与本次研究的所有工作人员在研究前均经过标准化操作培训及考核,并完成3次预调查。眼底照片的判断由2名独立的阅片员分别检阅,不一致时由另一名高级阅片员确认评分。所有资料数据的录入应用Epidata双录入。在将军街道社区卫生服务中心设立检查现场,所有受检者在检查现场完成基本信息、相关病史以及问卷调查。
1.2.3 检查方法 收集受检者的基本信息(包括姓名、性别、年龄、吸烟及饮酒史等)以及通过自行设计的问卷采集患者的相关病史、全身疾病史、眼科病史及治疗情况等。纳入对象均行详细的血液检验,包括糖化血红蛋白、总胆固醇(Total cholesterol,TC)、甘油三酯(Triglyceride,TG)、低密度脂蛋白(Low density lipoprotein,LDL)和高密度脂蛋白(High density lipoprotein,HDL)等;眼科专科检查包括视力、眼压、B超、裂隙灯显微镜及散瞳后彩色眼底照相(VK-2,日本Kowa公司)。
1.2.4 诊断标准 高血压诊断标准按照2015年中国高血压防治指南[13]:收缩压/舒张压>140/90 mmHg(1 mmHg=0.133 kPa)。高血脂诊断标准依据中国成人血脂异常防治指南(2016年修订版)[14]:TC≥6.22 mmol/L,TG≥2.26 mmol/L,LDL≥4.14 mmol/L,HDL≤1.04 mmol/L。对于焦虑的认定根据在问卷中“您是否觉得有焦虑症状,如紧张担心、不安等等”问题的回答(1.我不觉得焦虑;2.我觉得轻度焦虑;3.我觉得极度焦虑)进行相应评估。
DR的诊断及分级依据改良美国早期治疗糖尿病视网膜病变研究小组(Early treatment diabetic retinopathy study,ETDRS)标准[15],根据眼底照片确定。眼底照相采集以视盘为中心,黄斑为中心,及黄斑颞侧、颞上、颞下、鼻侧共6方位45°照相以及黄斑立体照相。将10~20 分定义为无DR(0级);31~37分定义为轻度非增殖期糖尿病视网膜病变(Nonproliferative diabetic retinopathy,NPDR)(1 级);43~47 分为中度NPDR(2 级);53 分为重度NPDR(3级);60~85分为增生性糖尿病视网膜病变(Proliferative diabetic retinopathy,PDR) (4级)。
1.2.5 睡眠障碍及睡眠时间异常的诊断 睡眠障碍的评估采用PSQI[16],该量表由美国匹兹堡精神科医师Buysse博士等于1993年编制,用于评定被试者近1个月的睡眠质量的量表,适用于睡眠障碍患者、精神障碍患者的睡眠质量评价,同时也适用于一般人睡眠质量的评估。PSQI已经被证明是睡眠质量评价的有用、有效和可靠的衡量标准,是主观睡眠质量的黄金标准。PSQI评分组成部分包括主观睡眠质量、睡眠潜伏期、睡眠持续时间、习惯性睡眠效率、睡眠障碍、睡眠药物的使用和白天功能障碍。评分越高睡眠质量越差,总分>7分认定为睡眠障碍。本研究采用睡眠时间<6 h或睡眠时间>9 h认定为睡眠时间异常[17-19]。
1.3 统计学方法
横断面调查研究。采用SPSS 26.0统计学软件进行数据分析。计量资料符合正态分布的采用±s表示,不符合正态分布的采用M(Q1,Q3)表示;计数资料采用n(%)表示。糖尿病患者不同特征分组间(如年龄、性别、教育程度、病程等)的PSQI得分比较采用t检验或H检验。采用广义评估方程评估分析不同程度DR对睡眠障碍和睡眠时间异常的影响,矫正因素包括年龄、性别、病程、LDL、TC、中风、冠心病、肾功能不全、焦虑、认知障碍及其他眼病(包括角膜白斑、青光眼、白内障、视网膜动静脉阻塞、视网膜脱离)等。所有统计学检验均为双侧检验,以P<0.05为差异有统计学意义。
2 结果
共纳入2 型糖尿病患者2 224 例,最终眼底像和PSQI量表完整者1 408 例用于数据分析。其中男569例(40.4%),女839例(59.6%),年龄(33~91)(61.5±8.6)岁,受检糖尿病患者中诊断为DR患者516例(36.6%),其中根据PSQI量表评估睡眠障碍患者113例(21.9%)。纳入的DM患者中,根据PSQI量表评估睡眠障碍患者312 例,检出率为22.2%,睡眠时间异常患者300例,检出率为21.3%。
2.1 不同特征糖尿病患者PSQI得分情况
年龄≥65岁组的入睡时间、睡眠效率得分均高于<65岁组,差异均有统计学意义(t=-2.27,P=0.024;t=-2.94,P=0.003)。女性的睡眠质量(t=-2.99,P=0.003)、入睡时间(t=-5.15,P<0.001)、睡眠障碍(t=-5.46,P<0.001)、催眠药物(t=-3.22,P=0.001)和PSQI总分(t=-4.63,P<0.001)均高于男性,差异均有统计学意义。病程≥5年组患者的睡眠质量(t=-2.13,P=0.033)、睡眠障碍(t=-2.82,P=0.005)和日间功能障碍评分(t=-2.25,P=0.025)均大于<5年组患者。在文盲、小学、初中、高中、本科及以上组中,5 组间的睡眠质量(H=13.27,P=0.010)、入睡时间(H=21.18,P<0.001)、睡眠效率(H=13.70,P=0.008)、睡眠障碍(H=18.78,P=0.001)、日间功能障碍(P=16.74,P=0.002)以及PSQI总分(P=24.32,P<0.001)差异均有统计学意义。在低收入、中等收入和高收入组中,3 组间的睡眠质量(H=6.61,P=0.037)、睡眠障碍(H=20.31,P<0.001)、日间功能障碍(H=6.42,P=0.040)和PSQI总分(H=9.33,P=0.009)差异均有统计学意义。有冠心病史的患者睡眠质量(t=-4.92,P<0.001)、入睡时间(t=-3.41,P=0.001)、睡眠障碍(t=-6.18,P<0.001)、催眠药物(t=-3.05,P=0.002)、日间功能障碍(t=-3.13,P=0.002)和PSQI总分(t=-5.00,P<0.001)均大于无冠心病史的患者,差异均有统计学意义。肾功能不全患者的催眠药物得分大于无肾功能不全患者,差异有统计学意义(t=-2.71,P=0.007)。认知障碍患者的入睡时间(t=-2.50,P=0.013)、睡眠时间(t=-2.00,P=0.045)、睡眠效率(t=-2.37,P=0.019)、睡眠障碍(t=-3.33,P=0.001)、催眠药物(t=-2.25,P=0.025)、日间功能障碍(t=-3.16,P=0.002)以及PSQI总分(t=-3.61,P<0.001)均大于无认知障碍患者,差异有统计学意义。自觉有焦虑症状的患者睡眠质量(t=-5.92,P<0.001)、入睡时间(t=-4.24,P<0.001)、睡眠时间(t=-2.67,P=0.008)、睡眠障碍(t=-7.98,P<0.001)、日间功能障碍(t=-5.57,P<0.001)以及PSQI总分(t=-6.23,P<0.001)均大于无焦虑症状的患者,差异均有统计学意义。见表1。
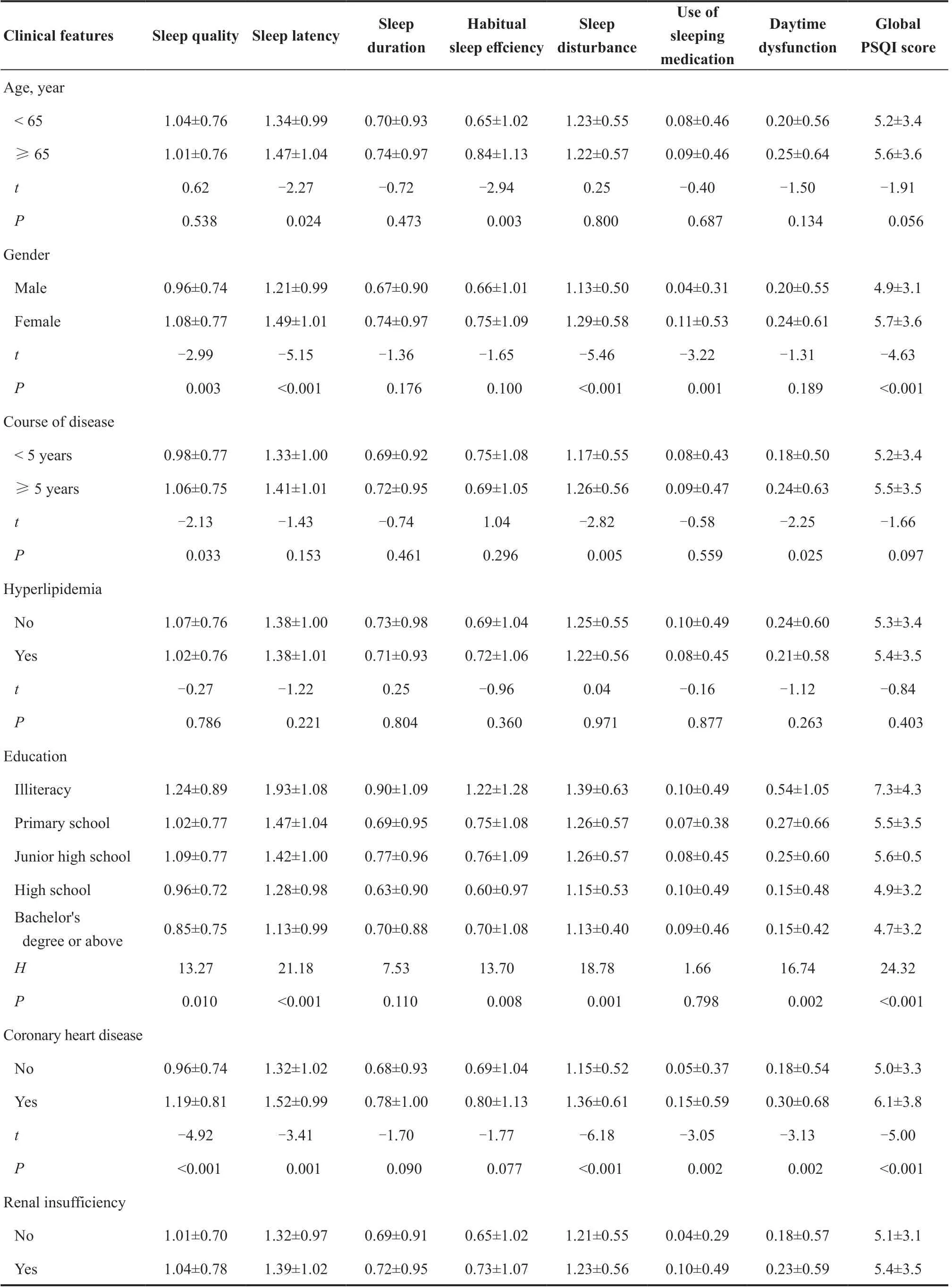
表1.不同特征糖尿病患者匹兹堡睡眠质量指数得分(分)情况Table 1.Pittsburgh sleep quality index score (points) in different diabetes groups
2.2 DR严重程度与睡眠障碍关系
根据广义评估方程分析,在未进行调整前,PDR是睡眠障碍的危险因素(OR=2.37,95%CI:1.13~4.97,P=0.023)。在控制年龄、性别因素后PDR作为睡眠障碍的危险因素更为明显(OR=2.67,95%CI:1.30~5.48,P=0.007)。在调整了年龄、性别、病程、教育、LDL、TC、冠心病、肾功能不全、焦虑、认知障碍及其他眼病(包括角膜白斑、青光眼、白内障、视网膜动静脉阻塞、视网膜脱离)后,PDR的睡眠障碍发生率为非DR的2.374 倍(OR=2.37,95%CI:1.08~5.20,P=0.031);而未发现轻度NPDR(OR=0.86,95%CI:0.61~1.21,P=0.395)、中度NPDR(OR=0.90,95%CI:0.57~1.40,P=0.896)及重度NPDR(OR=1.38,95%CI:0.76~2.50,P=0.294)与睡眠障碍相关。
2.3 DR严重程度与睡眠时间异常关系
根据广义评估方程分析,在未进行调整前以及在控制年龄、性别因素后均未发现DR与睡眠时间异常相关。在调整了所有协变量后,发现重度NPDR睡眠时间异常发生率为非DR的1.814倍(OR=1.81,95%CI:1.03~3.19,P=0.039);但未见轻度NPDR(OR=0.85,95%CI:0.64~1.13,P=0.259)、中度NPDR(OR=0.92,95%CI:0.64~1.34,P=0.663)和PDR(OR=1.04,95%CI:0.48~2.27,P=0.913)与睡眠时间异常相关。
3 讨论
本研究通过对大样本量的2型糖尿病患者观察分析,探讨了DR严重程度与睡眠障碍、睡眠时间异常之间的潜在关联。我们的研究发现,PDR与睡眠障碍的发生明显相关,而重度NPDR则与睡眠时间异常明显相关。这些发现为进一步探索DR的发病机制提供了新的线索。目前关于睡眠和DR之间关系的研究多探讨阻塞性睡眠呼吸暂停与DR的关系[20],而应用标准睡眠质量量表探讨DR与睡眠质量、睡眠时间的研究鲜见报道。
杨海敏等[21]的1 项以300 例DR患者为对象的研究发现,DR患者中,睡眠障碍患者占57.3%,而本研究结果显示DR患者中睡眠障碍者占21.9%,出入较大。杨海敏等[21]的研究中纳入的DR患者均为住院治疗的患者,通常病情较重,且患者会受到环境变化及情绪和噪音等的影响,进而出现睡眠障碍,因此可能出现睡眠障碍问题的患者较多。国内外对于睡眠障碍和DR关系的研究结果不尽相同,Morjaria等[22]的1 项将健康人设置为对照组的研究中并未发现睡眠障碍和DR的关系,该研究同样选用PSQI量表作为评估睡眠障碍的方法,本研究结论与之一致,即并未发现非DR患者与DR患者之间睡眠质量和睡眠时间差异有统计学意义。而Zheng等[8]的1 项Mate分析证实DR患者的PSQI得分明显高于非DR组,与本研究结果相反,该结论不一致的原因可能为研究方法不同。印度的1 项研究[18]报道了DR患者的整体PSQI评分高于非DR患者,该研究对DR进行了严重程度的分级,将DR分为非DR、轻度NPDR、中度NPDR、严重DR(重度NPDR+PDR),结果发现随着DR严重程度的增加,日间功能障碍的评分随之增加,但睡眠障碍发生率、PSQI总分及其他组成部分得分差异无统计学意义。韩国的1项基于全民的大样本量研究[7]和国内研究[23]都报道了PDR是睡眠障碍的危险因素,这与本研究结论一致。对于DR与睡眠质量相关的具体机制,推测是由于自主感光视神经节细胞(Intrinsically photosensitive retinal ganglion cell,ipRGC)受损所致。另一项临床研究显示与非糖尿病患者相比,糖尿病患者的视网膜厚度变薄,且视网膜厚度变薄者睡眠质量较差[24]。ipRGCs在眼睛的作用是将视网膜光刺激转化到视交叉上核,从而设置昼夜节律的光诱导,并最终控制松果体分泌褪黑素以调节睡眠[25]。视网膜神经纤维中的内丛状层(Inner plexiform layer,IPL)是由ipRGC组成,IPL的变薄可能代表ipRGC功能受损[24]。并且在刁莉莉等[26]的1项研究中证实了DR患者的IPL层比非DR患者薄,并且随DR严重程度的增加变薄程度加重。本研究结果显示,与无DR患者相比,只有PDR患者睡眠质量下降,NPDR与睡眠无关。这可能因为IPL只有在变薄到一定程度才会影响ipRGC。
Meng等[19]和Jee等[27]报道了长睡眠(>9 h)与DR相关;Raman等[17]的研究报道了与非DR相比,DR患者的睡眠时间异常患病率更高;新加坡的1项研究[28]发现白天过度嗜睡和威胁视力的糖尿病视网膜病变呈正相关,睡眠时长和中度NPDR呈U形相关,该研究对于睡眠障碍的评估采用自我报告方式,分别将睡眠时间<6 h和>8 h作为短睡眠和长睡眠的标准,本研究结论证实睡眠时间异常与重度NPDR相关。但既往的1 项研究[15]报道了DR与睡眠时长无关,该研究样本都来自印度,受检者的生活作息与我们不同,样本量较小也并未进行DR严重程度的分级,且其睡眠时间异常的界定值也与本研究不同,这些都可能造成了研究结果不一致。关于如何界定短睡眠和长睡眠,目前无既定共识,既往研究多将≤6 h的睡眠定义为短睡眠[17],>9 h的睡眠定义为长睡眠[18-19],我们也应用此标准界定。DR与睡眠时间异常相关的原因,既往研究证实褪黑素在重度NPDR和PDR中分泌显著减少,因为晚期视网膜光感知功能障碍会导致褪黑素的分泌改变,褪黑素在昼夜节律中起重要作用,影响睡眠[29]。另外随着DR严重程度的加重,患者生活质量下降、心情不佳[20]等因素都会影响到睡眠质量,从而使睡眠时间缩短或者代偿性延长。当睡眠不足或睡眠过多时炎性标志物增加(如白细胞介素-1β、白介素6、肿瘤坏死因子α及C反应蛋白等)[30],反过来又会加速DR发展,形成恶性循环。
本研究的优势是样本量相对较大,对眼底照片进行严格的检阅及分级,并且在评估睡眠障碍时采用了标准化问卷。但本研究也存在一定的局限性:首先,由于本研究为横断面研究,无法确定DR与睡眠障碍、睡眠时间异常之间的因果关系,未来需要通过前瞻性队列研究来进一步验证这一因果关系;其次,本研究的样本来自特定的地理区域,因此可能存在一定的地区选择偏倚,未来需要在更广泛人群中进一步验证研究结果;最后,本研究数据收集时间较早,可能无法完全反映当下DR和睡眠的关系。过去10 年间中国人的生活习惯因为互联网的普及经历了明显变化,特别是在晚上活动增加、熬夜现象普遍等方面,这些变化可能对睡眠模式产生明显影响,进而影响糖尿病患者的健康状况,包括DR的发展。但这种变化同时发生在DR人群和非DR人群,且组间没有很大差异,很可能不会影响本研究的结论。
综上,本研究发现DR的严重程度明显影响糖尿病患者的睡眠,重度NPDR患者更容易出现睡眠时间异常,PDR患者更易出现睡眠障碍。这些发现为进一步理解DR的发病机制提供了新的线索,也为DR患者的健康管理提供了新的思路。未来,针对DR患者的睡眠障碍和睡眠时间异常的干预,可能成为改善DR患者生活质量和预防DR、控制DR发展的重要手段。
利益冲突申明所有作者均声明不存在利益冲突
作者贡献声明周紫曦:数据整理;参与选题、设计及资料的分析和解释;撰写论文;根据编辑部的修改意见进行修改。王禹:参与选题、设计及资料的分析和解释,修改论文中关键性结果、结论;根据编辑部的修改意见进行核修。臧博、丁晓霞、臧冬晓、李冬:参与选题、设计和修改论文的结果、结论

