电催化还原废水中硝酸盐制氨的研究进展
赵 慧,王富东,钱光磊,雷太平,任春燕,谢陈鑫
(1.中海油天津化工研究设计院有限公司,天津 300131;2.广东石化有限责任公司,广东揭阳 515200)
氮作为肥料中的一种营养元素被广泛应用并以硝酸铵的形式存在,其中NH4+和NO3-均来自于Haber-Bosch工艺生产的氨〔1〕。氨也是许多含氮产品的重要化学前体,由于其具有高质量和体积储氢能力〔20 ℃和857 kPa下分别为17.7%(质量分数)和108 g/L〕,越来越多地被用作燃料、氢气载体〔2-5〕以及氨燃料电池的未来液化燃料〔6〕。然而,Haber-Bosch 工艺是能源密集型(约占全球总发电量的2%)过程,生产氨向大气中释放的CO2占所有温室气体排放的1.5%〔7〕。因此,促进水体中的氮循环来制备氨越来越受到关注。
硝酸盐是地表和地下水中常见的污染物,其来源包括化石燃料的燃烧、过量使用富含氮的肥料和废水的排放〔8-11〕,其大量排放对地下水、河流和湖泊造成严重污染〔12〕,对人体健康构成很大危害,并且破坏全球氮循环平衡,目前,已采用物理、化学、生物、电化学等方式来高效降解硝酸盐以降低水污染。其中,电催化还原法受到人们的关注,在各种硝酸盐电催化还原副产物中(N2、N2O、N2O-、NH4+),铵具有最高的经济价值。电催化硝酸盐制氨(electrochemical conversion of nitrate to ammonia,NO3-RR)有助于:1)从各种形式的废水中去除对环境有害的硝酸盐〔13-15〕;2)可持续生产“绿色”氨〔14-15〕;3)减少能源和碳足迹〔16〕。电催化还原生成的氨可以通过其他工艺从水溶液中回收。此外,硝酸盐电催化所需能源可来自风能、太阳能等可持续能源,进一步为恢复全球氮循环中的不平衡提供解决方案。因此,从环保和节能的角度出发,将水中的硝酸盐污染转化为可回收的铵/氨具有诱人的发展前景。
近年来,电催化还原的工作重点是开发更丰富、成本更低的电催化剂,直接还原NO3-成NH3,同时最大限度地减少副产物以及析氢(Hydrogen evolution reaction,HER)竞争反应,以实现高的NH3法拉第效率(FE)。笔者详细讨论了电催化还原处理硝酸盐制氨的机理,总结了国内外所用的不同电极材料,涵盖了多种过渡金属、贵金属和非金属电极材料,对电催化还原处理硝酸盐制氨的影响因素、所用反应器及工艺进行了总结,并展望了未来的研究方向。
1 电催化还原硝酸盐制氨机理
选择性硝酸盐还原为氨是一个需要多电子转移的复杂过程,涉及到从+5 价态到-3 价态的许多含氮物质的转化。从热力学上讲,有许多可能的产物〔包括NO2(0.77 V vs. RHE)、NO2-(0.94 V)、NO(0.96 V)、N2O(1.12 V)、N2(1.25 V)、NH2OH(0.73 V)、N2H4(0.82 V)和NH3(0.88 V)〕〔17〕,可以由硝酸盐和水在相似的还原电位下形成;从动力学上讲,硝酸盐还原为氨是将一个完全氧化的、带负电荷的多原子离子转化为一个完全还原的分子,增加了反应所需的过电位,使得反应也与析氢反应〔H2(0 V vs. RHE)〕竞争〔18〕。
NO3-RR 有直接和间接反应机制,直接反应机理需要在低浓度条件下进行,而间接反应机理需要在高浓度条件下进行〔19〕。由于水体中硝酸盐浓度通常较低,笔者重点讨论直接反应机制。直接反应机制分为2种途径〔20〕,直接电子转移还原和原子H*还原;同时将催化剂分为2类:第一类,直接电子转移途径,在强吸附硝酸盐的非贵金属纳米材料阴极(例如,Cu和CuNi)上占主导地位;第二类原子H*介导的途径,在具有较高氢吸附能力的贵金属阴极(如Pd、Pt、Rh等)上更易发生。笔者总结了可能的NO3-RR 机制,如图1 所示〔20〕。
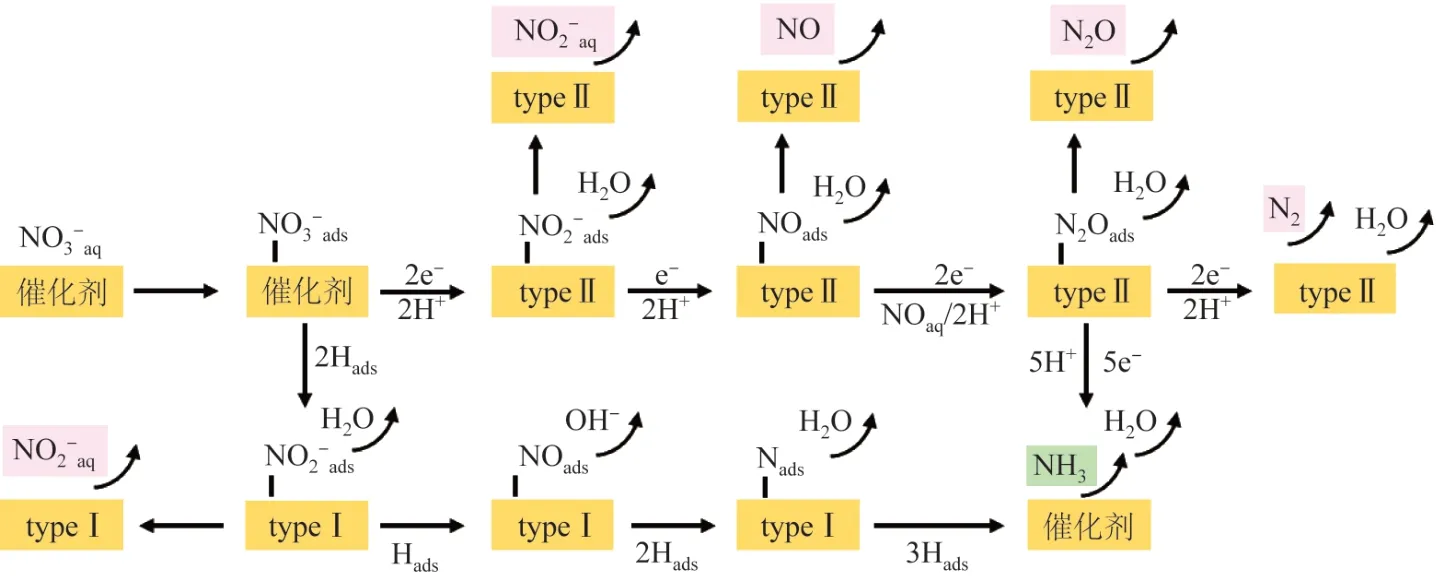
图1 可能的NO3-RR 机制Fig.1 Possible NO3- RR mechanisms
Huan NIU 等〔21〕以石墨相氮化碳(g-CN)负载单一过渡金属原子(TM,从Ti 到Au)为研究对象,并借鉴Yuhang WANG 等〔22〕提出的CuNi 合金的氧端(Oend)途径和Ranran JIA 等〔23〕提出的基于TiO2纳米管丰富的氧空位的氮端(N-end)途径,借助第一性原理计算,从理论上将单原子电催化硝酸盐还原制氨的反应路径以不同的NO 吸附方式分为5 种,分别为氧端途径(O-end)、氮端途径(N-end)、氮侧加氢(N-side)和氧侧加氢(O-side)4 种途径,以及通向生成N2的NO-二聚体途径。在TM/g-CN 上NO 更倾向于以氮端途径(N-end)方式吸附,因此,氮端途径(N-end)被认为是TM/g-CN 上的NO3-RR 最有利路径,NO3--RR 的详细途径如图2 所示〔21〕。

图2 NO3-RR 的详细途径Fig.2 Detailed pathways of NO3-RR
2 电极材料
在过去的几十年里,多种电极材料被应用在水溶液中进行硝酸盐的电催化还原反应,包括过渡金属、贵金属以及非金属等,并通过形貌尺寸调控、晶格缺陷构建、表界面设计、杂原子掺杂、空位工程等以及几种措施间的协同效应〔24-25〕对其进行改性。硝酸盐电催化还原制氨性能可通过电极电势、生成速率、法拉第效率、硝酸盐去除率、选择性等参数评估,电解池构型、操作参数等因素也有较大影响。
2.1 铜系金属及化合物
在过渡金属中,Cu 表现出最高的催化活性,能快速实现以铵根为产物的硝酸根还原,并且表现出最高的将硝酸根还原成亚硝酸根的电催化动力学。各种铜基催化剂,包括不同形貌的单质Cu(颗粒、纳米片、纳米块、纳米带、纳米线)〔26-29〕、Cu/氧化物复合催化剂〔30-32〕,铜基二元合金〔33-35〕等,被应用于电催化还原硝酸盐制氨。金属Cu 的优异性能源于其导电性好、析氢能力弱、催化性能稳定,提高了由吸附控制的第一电荷转移反应〔36-37〕。笔者总结了铜系金属及化合物电极在硝酸盐电催化还原成NH3/NH4+中的性能,如表1 所示。

表1 铜系金属及化合物电极用于电催化还原废水中硝酸盐制氨Table 1 Copper-based metal and compound electrodes for electrocatalytic reduction of nitrate to ammonia in wastewater
对催化剂微/纳米结构的合理调控可以提高硝酸盐电还原的性能。Xianbiao FU等〔27〕证实了在所有测试的Cu催化剂中,在-0.15 V vs. RHE下,Cu(111)纳米片的氨生成速率是Cu 箔的400 多倍、Cu 纳米块的3.1 倍和Cu纳米颗粒的1.7倍。Cu(111)纳米片在NO3-RR中优异的催化性能可归因于抑制析氢反应(HER)和提高决速步骤的电流密度(即速率),不同形貌Cu在碱性条件下的NO3-RR活性顺序:Cu纳米片>Cu纳米块>Cu纳米颗粒。Xiaodan WANG 等〔28〕提出了一种新型的三维(3D)Cu纳米带阴极用于高效的电催化还原硝酸盐,实验结果表明,三维(3D)Cu纳米带电极产生的准一级硝酸盐还原速率常数(0.035 8 min-1)比纯Cu 泡沫电极(0.000 2 min-1)高179 倍。Cu NWs(纳米线)能够获得等离子体活化电解质还原的较高电流密度〔29〕,Cu NWs电极(与泡沫铜和铝箔相比)更高的催化活性可归因于:1)抑制HER 的Cu0/Cu+活性位点的形成,这些界面活性位点通过降低形成*NOH 自由基的自由能,有利于硝酸盐还原为NH3;2)在纳米线活性位点附近合适的传质和停留时间;3)活性位点数量的增加。Yuting WANG 等〔30〕研究表明CuO NWAs(纳米线阵列)具有优异的法拉第效率(95.8%)和氨选择性(81.2%),CuO被电化学转化为Cu/Cu2O,作为活性相,界面处Cu2O到Cu 的电子转移可以促进*NOH 中间体的形成并抑制析氢反应,从而实现高选择性和法拉第效率,Cu/Cu2O NWAs 上产氢的能垒为0.33 eV,远高于Cu NWAs(0.12 eV),表明其对产氢有抑制作用;Cu/Cu2O NWAs 的电化学活性表面积(ECSA)(25.00 cm2)几乎是Cu 的3 倍,能够促进硝酸盐转化率。Tianyi WU等〔38〕构建了超薄Cu NSs/NF(多孔镍泡沫自支撑Cu 纳米片)微柱,Cu NSs/NF 显示出高达422 mF 的双电层电容值,表明电极-电解质界面的可及性大,与其他铜基电极相比,Cu NSs在硝酸盐还原中表现出明显的电位正移和更高的电流密度。Cu 和Ni具有相同的晶体结构(面心立方)〔34〕、相似的化合价、相近的原子半径和电负性,允许在整个成分范围内形成均匀的溶液。与Cu(和Ni)相比,富Cu 合金,特别是Cu80Ni20和Cu90Ni10,在还原硝酸盐和亚硝酸盐方面表现出更优异的性能,尤其是在中等负电位(E为-1.20~-1.05 V vs.Hg/HgO)时,表现出:1)更高的效率,合金支持更高的电流和更快的氧阴离子还原速率;2)更好的稳定性,合金电极观察到的电流衰减相对较低;3)较高的选择性,长时间电解NO3-溶液,Cu 产生NO2-和NH3的混合物,富含Cu 的合金几乎只产生NH3。Yuhang WANG 等〔33〕的研究表明,Ni合金化可以调节Cu的d带中心,并调节*NO3-、*NO2和*NH2等中间体的吸附能。
总体来讲,Cu 对HER 具有较高的过电位,并能在HER 前提供大量的吸附氢原子,有利于NO3-的还原。然而,Cu 在应用过程中仍然存在过电位高、电流密度低的问题〔41〕。
2.2 钴系金属及化合物
构建肖特基结已被证明是调节肖特基电催化剂界面电子密度的有效策略〔42〕,设计和合成在界面处具有肖特基整流效应的金属-半导体异质结构材料有望促进选择性硝酸盐电还原。Yu YU 等〔43〕自制了Co/CoO 纳米片阵列(Co/CoO NSAs),利用NO3-合成NH3,其优异的性能来自于Co/CoO 异质结构中整流肖特基接触导致的Co 电子缺失,界面处Co 向CoO的电子转移不仅可以抑制竞争析氢反应,还可以增加副产物的能垒,从而获得较高的法拉第效率和氨选择性。Xiaohui DENG 等〔44〕研究了金属钴纳米阵列(Co-NAs),得益于Co0的高内在活性、活性物种与导电基底和暴露大量活性位点的纳米结构之间的紧密接触,反应过程表现出优异的法拉第效率和高活性。Jiacheng LI 等〔45〕针对钴金属电极活性差、易钝化导致难以实用的瓶颈,通过缺陷碳的稳定固化作用,开发了一种磷掺杂的单原子钴催化剂材料,可有效避免偶联反应发生,使最终产物具有更高的氨选择性和还原活性。纳米结构Co3O4因其大的比表面积和高效的电子传递和利用能力,近年来引起了人们的广泛关注。Chen LI等〔46〕通过电沉积法制备出具有纳米片结构的Co3O4薄膜用于电催化硝酸盐合成氨反应的阴极。结果表明Co3O4纳米片的电阻小于固体颗粒的电阻,Co3O4纳米片电化学活性面积为20.16 cm2,是固体颗粒(14.49 cm2)的1.4 倍,大面积的暴露(311)晶面也可能对NO3--N 去除率的提高起到重要作用。但是,单一钴基材料存在自身本征的局限,如导电性低、比表面小、在电解质中不稳定等缺点〔47〕,且由于其昂贵的试剂和复杂的工艺,而在工程应用上受到限制〔48〕。笔者总结了钴系金属及化合物电极在硝酸盐电催化还原成NH3/NH4+中的性能,如表2 所示。
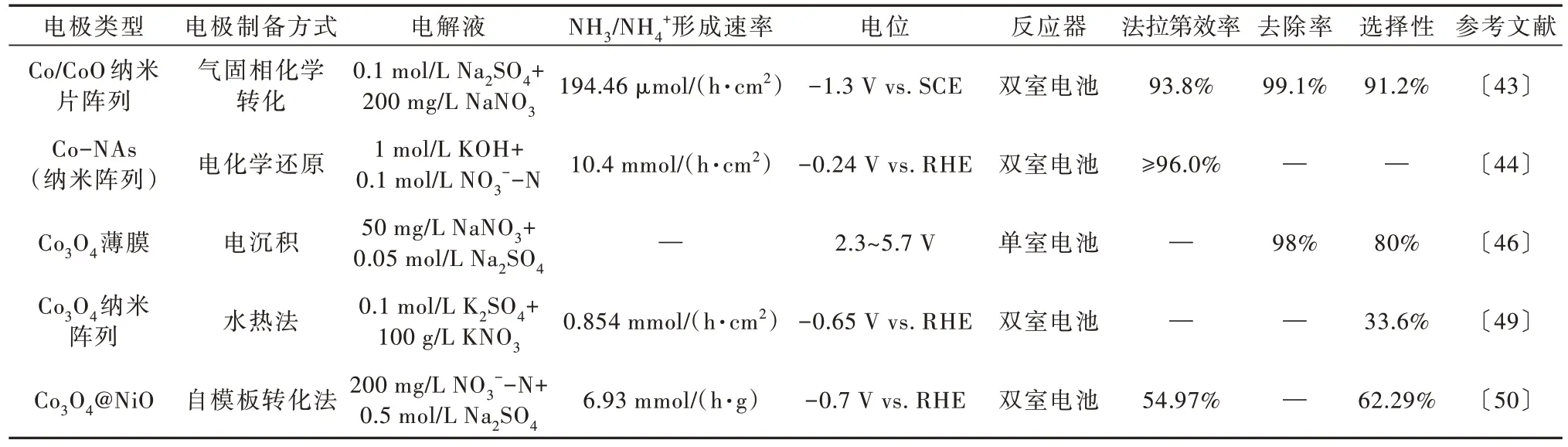
表2 钴系金属及化合物电极用于电催化还原废水中硝酸盐制氨Table 2 Cobalt-based metal and compound electrodes for electrocatalytic reduction of nitrate to ammonia in wastewater
2.3 铁系金属及化合物
受Haber-Bosch 催化剂(铁基化合物)和固氮酶(主要含Fe-Mo辅助因子)中Fe活性位点的影响〔51-52〕,铁系金属及化合物被用于电催化还原制氨的研究。以单质Fe、Fe2O3和Fe3O4作为电催化还原硝酸盐合成氨反应的试验中〔53〕,Fe2O3的催化性能十分优异。硝酸根的还原首先经历硝酸根的吸附,而带负电荷的硝酸根在铁原子上的吸附强度与铁原子表面的电荷密度相关,铁原子正电荷密度越大,吸附越强;Fe(Ⅲ)有利于促进硝酸根的吸附,即Fe2O3活性最高;而Fe3O4虽然也含有Fe(Ⅲ),但在铁位点数量保持相同的前提下,部分Fe(Ⅲ)被Fe(Ⅱ)替代,因此活性有所降低;单质铁由于只含Fe(0),正电荷密度最低,最不利于硝酸根吸附,因此宏观的NO3-RR 活性最差。Panpan LI 等〔54〕报道了一种铁基单原子催化剂,通过聚合物-水凝胶方法,用于在碳上制备具有均匀原子分散的氮配位Fe 位点。DFT 计算表明,单位点铁将经历一个硝酸盐占据的过渡中心,该过渡中心禁止水的吸附,即抑制了本体催化剂通常存在的竞争性反应。Zhenyu WU 等〔55〕以SiO2粉末为硬模板,采用过渡金属盐辅助碳化法合成Fe SAC(singleatom catalyst),DFT 计算表明,Fe 单原子催化剂可以有效地防止由于缺乏邻近金属位点而导致的N2所需的N—N 偶联步骤,从而提高氨产品的选择性,相同的合成方法用来制备了Co SAC 与Ni SAC,Co SAC 与Ni SAC 的NH3产率略低,其原子位点活性仅为Fe SAC 的1/3 和1/4,这表明Fe 原子中心具有独特的活性。结合我国作为铁资源大国的基本国情〔56〕,铁系金属及化合物的应用具有良好的优势。
2.4 钛系金属及氧化物
近年来,氧空位(OVs)被广泛应用于提高电(光)催化剂的性能〔57-59〕,TiO2中的OVs 可以使Ti3+与氧结合更强,从而提高氧还原能力〔60〕。Ranran JIA等〔23〕制备出具有丰富氧空位(OVs)的TiO2纳米管(TiO2-x)催化剂,作为硝酸盐电还原的阴极,在线差分电化学质谱(DEMS)和密度泛函理论计算揭示了氧空位在硝酸盐电还原中的作用,即硝酸盐中的氧原子填充在TiO2-x的氧空位中,削弱N—O 键,抑制副产物的生成,从而获得较高的法拉第效率和铵选择性。理论计算表明,在TiO2表面引入氧空位后,因Ti 元素多余3d 电子的影响,费米能级会移向导带最小能级(CBM),这使得TiO2-x表现出金属行为,从而提高了TiO2-x的导电性,有利于NO3-的电催化还原。Lele WANG 等〔61〕通过阳极氧化法制备了Ti 基纳米电极,钛基纳米电极较高的真实表面积,可以增强电极表面与电解液的接触,缩短质子的扩散距离,从而提高硝酸盐还原效率。此外,Ti 基纳米电极表面覆盖着明显均匀的管状结构,其表面形成的双电层增大了电极的表面积,修饰了电极的电子结构,从而增强了硝酸盐与阴极之间的电子转移,提高了硝酸盐的吸附和还原效率。虽然Ti 电极是一种较差的析氢催化剂〔18〕,但其是一种储量丰富、价格低廉的金属,且对酸性、碱性和高盐度溶液条件具有良好的耐腐蚀性,为实现高选择性还原硝酸盐阴离子提供了较大的操作条件窗口,这些特性使钛成为低成本电极的理想选择。
2.5 镍系金属及化合物
新型Ni 泡沫表现出异常强烈的HER 抑制,A.IARCHUK 等〔20〕通过动态氢气泡模板辅助电沉积工艺制备了新型泡沫镍催化剂,优化后的泡沫镍在理想电解液条件下,显现出了保持在95%以上法拉第效率(NH3),氢气是硝酸盐还原的唯一副产物,反应过程中没有其他含氮产物(例如NO、N2O 或N2)形成,表明泡沫镍能够实现硝酸盐到氨的100%选择性转化。镍电极可以在NO3-RR 过程中连续循环后自激活〔62〕,在硝酸盐到氨的转化中表现出出色的性能,具有相当高的选择性、寿命和法拉第效率。Wenxiao ZHENG 等〔62〕以自活化镍阴极进行了从基础到放大用于处理工业废水的研究,中试试验在湖南中石化催化剂有限公司所属化工厂进行,试验发现,活化后的阴极具有良好的处理实际废水的能力,当质量浓度从241 mg/L 到2 527 mg/L 时,硝酸盐转化率均超过92.0%,主要产物为氨,NH4+-N 选择性均大于92.5%,且随着初始浓度的增加法拉第效率增加。该电极具有高效去除率的原因是镍电极阴极腐蚀和化学氧化共同作用形成在Ni 电极表面生长了纳米尺寸的Ni(OH)2颗粒。不同于其他电极,原始泡沫镍电极对NO3-RR 表现出较低的活性,但循环电极显著地放大了活性。例如,第2 周期的Ni 电极明显优于第1 周期的电极,电解1 h 后NO3--N 的转化效率明显提高,从31.9% 提高到94.3%,且在20 次循环后变化不大,证实了自激活阴极的卓越寿命,而普通金属电催化剂在经过几个循环后通常会发生钝化和腐蚀。
笔者总结了铁/钛/镍系金属及化合物电极在硝酸盐电催化还原成NH3/NH4+中的性能,如表3 所示。

表3 铁/钛/镍系金属及化合物电极用于电催化还原废水中硝酸盐制氨Table 3 Iron/Titanium/Nickel-based metal and compound electrodes for electrocatalytic reduction of nitrate to ammonia in wastewater
2.6 钌系金属及化合物
使用传统的金属基催化剂〔64-66〕,只有在低过电位和小电流密度的情况下,才能获得良好的硝酸盐到氨的选择性,而在高过电位下,析氢仍然占主导地位。基于此问题,Jie LI 等〔67〕通过溶胶凝胶法和电催化拓扑还原法,设计出氧掺杂且直径仅有2 nm 的Ru 纳米团簇,可以实现5.56 mol/(g·h)的产氨速率,这主要归因于拉伸型张力Ru 表面提高双氢原子聚合的反应能垒,抑制析氢副反应,有利于氢自由基的产生,氢自由基通过抑制氢-氢二聚化在水分解过程中产生的拉伸晶格应变,在较低的动力学势垒下通过加氢限速步骤的中间产物来加速硝酸盐到氨的转化。此外,制备了Ru、Rh 和Ir 的无应变纳米晶体、过渡金属二硫化物、碳材料、金属有机框架(MOFs)和MOF 衍生的单原子催化剂,当在相同的条件下操作时,这些体系的NH3生成速率值比钌(Ru)纳米团簇低1~4 个数量级。Fengyang CHEN 等〔68〕通过阳离子还原法制备了Ru-Cu NW,对富Ru 区域的进一步研究表明,Ru 原子高度分散在Cu 基体中,而不是形成团簇,84%的Ru 以单原子形式孤立存在,没有形成相邻的Ru-Ru 键,因此,基于APT 的3D 断层扫描信息和上述所有表征,证实了Ru 掺杂物处于金属电子态,并且以孤立原子的形式高度分散在Cu 基底中。DFT 计算结果表明,由于N*从Ru-Cu 迁移到Cu-Cu 位所需的高反应能量(0.39 eV),高度分散和孤立的Ru 活性位起到限制NO3-RR 到Ru 原子的作用,从而最大限度地减少了与来自其他Ru 位点的N原子的形成,即抑制HER、吸热的NO2-脱附和表面N*物种的限制运动相结合,导致Ru-Cu NW 在较宽的电位范围内具有较高的NH3法拉第效率。
2.7 铑系金属
在低过电位的酸性介质中〔69〕,Rh 是目前对硝酸还原为NH3活性和选择性最强的纯金属。Huimin LIU等〔70〕展示了一种由分散在Cu 纳米线(NWs)上的Rh 团簇和单原子组成的电催化剂,在-0.2 V vs. RHE,最高的氨产率达到了1.27 mmol/(h·cm2)的记录值。通过电子顺磁共振、原位红外光谱、差分电化学质谱和密度泛函理论建模的详细研究表明,高活性源于Rh 和Cu 位点之间的协同催化作用,Rh 位点上吸附的氢转移到Cu 上吸附的邻位*NO 中间体,促进加氢和氨生成。虽然Rh对硝酸盐还原具有一定的活性,但受到析氢副反应易发和资源稀缺的影响〔71〕,在应用中受到限制。
笔者总结了钌/铑系金属及化合物电极在硝酸盐电催化还原成NH3/NH4+中的性能,如表4 所示。

表4 钌/铑系金属及化合物电极用于电催化还原废水中硝酸盐制氨Table 4 Ru/Rh-based metal and compound electrodes for electrocatalytic reduction of nitrate to ammonia in wastewater
2.8 非金属催化剂
非金属材料由于其具有成本低、机械强度显著、电子结构高度可调、耐用性好等优点,也被应用于硝酸盐的电催化还原阴极。Jing DING 等〔73〕研究了直接电还原硝酸盐的性能,以考察不同阴极〔石墨毡(GF)、Cu-Ni 合金Cu90Ni10、钛〕的效果。实验结果表明,这些电极在线性扫描伏安图中对硝酸盐去除率和阴极电流的性能依次为GF>Cu90Ni10>Ti。 与Cu90Ni10阴极相比,GF 阴极具有最高70%的硝酸盐去除率,也表现出更高的耐腐蚀性。
在这些阴极中,铜和铁因其效率高、成本低而被研究得最多。此外,铂类电催化剂(即Pt 和Pd)对NO3-RR 表现出优异的性能,但它们成本高,难以在应用中推广。
3 影响因素
3.1 电极电势
电极电势对于硝酸盐还原过程中的产物分布至关重要,这一点通过使用碱性溶液中的Cu 电极〔74〕得以证明。在-0.9 V vs. Hg/HgO 时,硝酸盐还原为亚硝酸盐;在-1.1~-0.9 V 之间,亚硝酸盐在长时间电解过程中被还原为羟胺,并进一步被还原为氨;在-1.1 V vs. Hg/HgO 时,亚硝酸盐被还原成氨。以电沉积制备的Cu-PTCDA 电极〔40〕,在双室电池中,NH3产率随着阴极电位的升高而逐渐升高,在-0.6 V vs.RHE 达到最大值(875±232) μg/(h·cm2),结合产率和法拉第效率,-0.4 V vs. RHE 是该体系的最佳电位,NH3产率高达(436±85) μg/(h·cm2),产NH3的法拉第效率为(77±3)%,法拉第总量高。Cu 纳米带〔28〕阴极对NO3--N 的去除效率随着外加电位的增加而增加,在-1.0、-1.2、-1.4、-2.0 V 电位下,反应时间为30 min 时,NO3--N 去除率分别达到24.2%、56.3%、91.5%和100%。对于Co-NAs〔44〕,在不同测试电位(-0.19、-0.09、0.01 V)下,对NH3的法拉第效率均高于96%。J. M. MCENANEY 等〔18〕试验发现,使用Nafion 隔膜的Ti 工作电极和Pt 对电极对硝酸盐还原进行研究,在测试的电位范围内(-1.5~-0.5 V)法拉第效率随外加电位的变化而显著变化,在-1.25~-1 V附近有一个相对的效率峰值(71%~73%)。
3.2 硝酸盐浓度
电催化还原硝酸盐的机理与反应物浓度有很强的依赖性〔19,75〕。一般来说,大多数硝酸盐还原反应是在低浓度的反应物(<1 mol/L)下通过直接反应机制进行研究的,并通过2 种不同的途径进行,即电子转移还原和原子氢还原。在较宽的NO3--N 质量浓度范围内(200~2 000 mg/L)〔62〕,硝酸盐的还原遵循Langmuir-Hinshelwood 动力学,其中零级反应在较高浓度时占主导地位,在较低浓度时遵循一级反应,法拉第效率随着NO3--N 浓度的增加而增加。Fengyang CHEN 等〔68〕使用CuO@Cu 泡沫电极,对10、32.3、100 mmol/L NO3-进行了试验,以涵盖家庭和重工业废水中预期的污染物浓度范围,NO3-对NH3的选择性达到99.8%,NH3的法拉第效率整体保持在90% 以上。对于Co-NAs 电极〔44〕,电流密度随着NO3-浓度的降低而降低,但系统对产物选择性的变化不明显。KNO3浓度为0.05、0.1、1 mol/L〔55〕,NO3-转化为NH3的法拉第效率分别为74.3%、71.8% 和73.5%,NO3-浓度对Fe SAC 的NH3选择性没有明显的影响,NH3产率随着KNO3浓度从0.05 mol/L 增加到0.5 mol/L 而显著提高,但继续增加到1.0 mol/L 时几乎保持不变。在硝酸盐浓度从0.05~1.0 mol/L 的动力学区域中,可能存在限速步骤从正级到零级的转变。对于一些实际应用,当某些来源的硝酸盐浓度较低或较高时,可以采取一些策略,例如使用成熟的工业浓缩过程来浓缩低浓度的硝酸盐,或稀释高浓度的硝酸盐。
3.3 pH
尽管人们对硝酸盐还原的研究主要集中在酸性介质中〔76〕,酸性介质中质子的存在极大地促进了硝酸盐的还原,但在较宽的pH 范围内探究硝酸盐还原的性能将有助于更深入地理解硝酸盐还原的机理和质子供体的作用,同时也有助于理解电极材料的电催化性能。在碱性溶液(pH=13)与在中性pH 下〔55〕,Fe SAC 对于NO3-转化为NH3的转化率与酸性溶液类似,但在碱性溶液中,过电位明显提高,而在酸性溶液(pH=1)中催化活性和选择性明显降低。对于钛阴极〔18〕,在强酸性条件和中高氨浓度下可获得对氨的较高的法拉第效率,这归因于硝酸根离子与质子反应的可用性更高,从而抑制了HER,有利于氨的生成。Rh 电极在中性和碱性介质中均具有活性〔76〕,在酸性介质中,Rh 电极上的硝酸盐还原活性都具有pH 依赖性,硝酸盐还原活性随着溶液pH 的升高而降低。当pH 为0~4 时〔77〕,主要产物为氨和羟胺,而在pH>4 时,Sn 电极还原硝酸盐主要产物为氮气、氧化亚氮、氨和亚硝酸盐。Co-NAs 在中性电解液(0.5 mol/L K2SO4,0.1 mol/L NO3-)中的NO3-RR 性能〔44〕,与在碱性(1 mol/L KOH、5 mmol/L NO3-;1 mol/L KOH、20 mmol/L NO3-)条件下相似,从-0.3~-0.6 V vs. RHE 均获得了96%以上的法拉第效率。3D Cu 纳米带阴极降解硝酸盐的试验中〔28〕,硝酸盐还原活性与pH 无关。J. M. MCENANEY 等〔18〕采用钛铂三电极体系,在0.1 mol/L NO3-电解质中,不同pH(0.77、2.95、10.05 和13.00)条件下进行测试,强酸条件(pH=0.77)下,显示了较高的法拉第效率,碱性条件显示了较低的法拉第效率。E. PÉREZ-GALLENT 等〔41〕用Cu 作阴极,研究结果表明,硝酸盐在铜上的还原是一个pH 依赖的反应,在使用酸性(0.1 mol/L HClO4)电解质时形成NO 和NH4+,在碱性(0.1 mol/L NaOH)电解质时形成NO2和NH2OH。铜单晶在酸性介质和碱性介质中硝酸盐还原的机理如图3所示〔41〕。
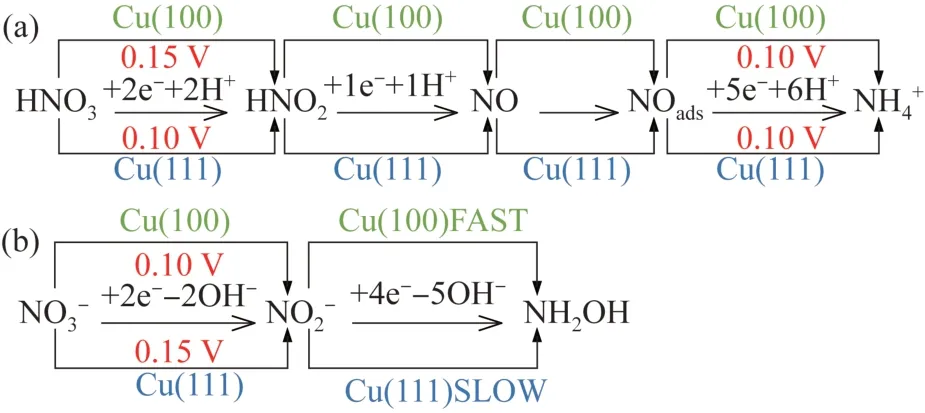
图3 铜单晶在酸性介质(a)和碱性介质(b)中硝酸盐还原的机理Fig.3 Proposed mechanism for nitrate reduction on copper single crystals in acidic media(a) and alkaline media(b)
硝酸盐的电催化还原机理对电解质溶液的酸碱性表现出强烈的依赖性。在中性和碱性条件下,NO3-的还原是由氢原子(Hads)介导的途径进行反应〔78-79〕。
3.4 电流密度
NO3--N 去除率随着电流密度的增大而增大〔46〕。大电流不仅有利于NO3--N 的去除,而且可能产生更多的H2和O2,特别是在高温下,有利于NH3-N 从溶液中逸出。然而,高电流密度往往意味着低的电流利用效率,电流效率随电流增大而减小。此外,由于溶液中NO3--N 浓度的降低,电流效率随时间而降低。自活化镍阴极对催化硝酸盐还原的活性〔62〕,法拉第效率和NH4+-N 选择性在很大程度上依赖于施加的阴极电流,如图4 所示,电流密度从10 mA/cm2增加到30 mA/cm2时,NO3--N 转化率和NH4+-N 选择性逐渐增加,更高的阴极电流意味着有更大的电势来驱动电子还原反应使NO3--N 转化为NH4+-N。但是,由于大电流下HER 的竞争增强,法拉第效率有所下降。

图4 电流密度对转换效率、NH4+-N选择性和法拉第效率的影响Fig.4 Current density on conversion efficiency,NH4+-N selectivity,and Faradaic efficiency
3.5 支持电解质
支持电解质是硝酸盐还原的重要影响因素之一〔80〕。Sn 电极在-1.8 V vs. Ag/AgCl 条件下,支持电解质阳离子对还原速率的提高顺序为Li+<Na+<K+<Cs+。在NH4+和多价阳离子的存在下,获得了较高的还原率,如Ca2+和La3+。支持电解质对阴离子还原速率的降低顺序为I->Br->Cl->F-。此外,在电解液中加入Cl-可以增加氮气的产量。Tianyi WU 等〔38〕利用Cu纳米带(Cu NSs)作为阴极,当体系中不加入氯化钠(NaCl),硝酸盐还原为NH3的选择性为93.3%,当体系中加入2 g/L NaCl、N2的选择性为97.2%。Chen LI等〔46〕向系统中投加500 mg/L 和1 000 mg/L Cl-时,NH3生成率分别从78% 降低到46% 和20%,当加入1 500 mg/L Cl-时,NH3可在240 min 内完全脱除。存在Cl-的双室电池〔73〕,中间膜只能选择性透过NH4+和H+,NO3-倾向于还原为N2。Cl-存在的溶液中发生式(1)~式(5)的化学反应。
综上所述,电催化还原硝酸盐反应的进行受诸多因素影响,可通过调控反应条件来得到目标产物。
4 反应器及生产工艺
4.1 反应器
研究者通常选择单室和/或双室电池评估电催化剂对硝酸盐还原的活性和选择性〔81〕,双室电池因为有阳离子交换膜(例如Nafion 膜)的存在,以静电排斥阴离子从阴极向阳极室穿越,在一定程度上减少了副反应的发生,在近些年的实验中备受青睐。Jing DING 等〔73〕研究了不同电池构型(单室电池SCC,双室电池DCC)电催化还原硝酸盐的性能,用GF 阴极对SCC 和DCC 中硝酸盐的电还原进行了研究,试验结果表明,SCC 体系中NO3-的去除率只有10% 左右,DCC 中NO3-的去除率高于75%。J. D.GENDERS 等〔82〕也报告了石墨在DCC 中具有75%的硝酸盐还原效率,而B. P. DASH 等〔83〕的研究表明,SCC 在电解9 h 后仅去除8%的硝酸盐。与单室反应器相比,双室电池中阳离子交换膜的存在阻碍了亚硝酸盐中间体向阳极室的转移,从而阻止了亚硝酸盐再氧化为硝酸盐〔74,84〕。
4.2 生产工艺
电催化还原生成的铵/氨可以通过不同工艺从水溶液中回收并利用。Jianan GAO 等〔31〕自制了电气化膜反应器,通过耦合阴阳极的配对电解法,利用阴极和阳极界面的强碱性和强酸性环境,实现了NH4+到NH3的相转移过程和随后的NH3酸化固定为(NH4)2SO4的过程,从而避免了酸碱危险化学品的输入,该反应器运行5 h 后,可在150 mmol/L NO3-的进水条件去除99.9%的NO3-,并获得99.5%的NH3回收率。Fengyang CHEN 等〔68〕将硝酸盐还原流出物流与空气汽提工艺相结合,利用该工艺,从电解液中吹脱出99.7%以上的生成氨,仅剩余0.55 mg/L,成功地获得了高纯度固体NH4Cl 和液体NH3溶液产品,展示了一个完整使用Ru-Cu NW 催化剂直接将含硝酸盐的进水转化为实际的氨产品,为将废水中硝酸盐转化为有价值的氨产品提供了一种实用的方法。
5 生产能耗
Haber-Bosch工艺生产1 mol氨大约消耗500 kJ〔85〕,即每生产1 kg 氨消耗近4 kW·h。将这一能耗与电催化还原比较,特别是Ru 纳米团簇催化剂〔14〕,基于电池电压为2 V、法拉第效率为100%、电流密度为223.3 mA/cm2和氨生成速率为1.17 mmol/(h·cm2)〔68〕的计算,对于1 kg 氨的生产,Ru 纳米簇催化剂需要约22 kW·h。Jianan GAO 等〔31〕自制的以CuO@Cu 泡沫为阴极的电催化膜池,(NH4)2SO4生产能耗为(21.8±3.8)kW·h/kg。虽然电催化还原的能耗基于小试试验,不同电极的能耗差别较大,且与Haber-Bosch 工艺生产相比还处于劣势,但将电催化还原技术与可再生能源结合应用,相关技术成果进行优化并推广应用仍具有广阔前景。
6 结论与展望
综述了电催化还原硝酸制氨研究进展,其中贵金属由于高昂的成本和稀缺性将阻碍其在未来的使用;非金属材料虽然具有成本低、较强的耐蚀性和良好的稳定性等优点,但在电催化应用中存在固有活性不足和动力学速率慢的问题〔86〕;过渡金属具有独特的电子结构和丰富的储量,过渡金属氧化物可作为活性相〔15〕,表现出了对NO3-RR 过程的优良催化性能,因此,成为研究的热点。
电催化还原制氨具有较好的前景,未来的研究应重点关注以下几个方面:1)需要对电催化还原制氨机理进行更深入的了解,以加速筛选特定催化剂,更好地促进催化剂朝着目标产物方向加速反应进程;2)筛选新的电极制备方法,促进电极材料的复合和创新,实现技术突破;3)进一步促进并扩大试验规模,在小试试验基础上进行实际废水中试及放大试验,促进目标产品的产出;4)通过可再生能源的应用及低成本催化剂的开发,降低运行成本。

