PLGA的降解行为及应用研究进展
陈泽宇,付 烨,张 茜,翁云宣
(北京工商大学轻工科学与工程学院,北京 100048)
0 前言
生物医用高分子材料是指用于人工器官、组织工程与再生医学、体内外诊断、药物制剂及医疗器械等领域的一类高分子材料。其中,可降解医用高分子材料在体内环境中能够因分子链发生特异性或非特异性断裂而逐步降解,且降解产物可以被人体吸收或经代谢过程排出体外。因此,这类材料在完成自身体内使命后能自动消除,不会对人类健康造成二次伤害,近些年来已经成为一类备受关注的生物医用材料[1]。脂肪族聚酯是一类典型的生物可降解高分子材料,其中聚乳酸(PLA)是目前产业化最成熟、产量最大、应用最广泛的材料之一,具有良好的生物相容性及生物可降解性等优点。但是,PLA 均相条件下成核能力弱、结晶速率低,常规加工方法只能得到低结晶度甚至非晶态的制品,导致力学性能、耐热性能大大降低;同时PLA 的亲水性差、降解周期长,这些局限性在一定程度上制约了PLA 的应用[2-3]。聚羟基乙酸(PGA)是目前降解速度最快的脂肪族聚酯材料之一,且降解条件温和,在自然环境下就可降解为二氧化碳和水;同时由于结构规整,结晶性能优于PLA,具有良好的力学性能和气体阻隔性能,但也有加工难度大、韧性不足等缺点[4-5]。
通过乳酸(LA)和羟基乙酸(GA)共聚,可以充分利用PLA 和PGA 的优点,并弥补各自的缺点,得到的PLGA 具有良好的可降解性、生物相容性和突出的力学性能、耐热性、降解可控性[6],使其成为第一批被美国食品药品管理局(FDA)认证的可降解医用高分子材料,广泛应用于药物控释、医用纤维材料、骨组织工程支架等领域[7-8]。
PLGA 通常为白色固体,玻璃化转变温度在40~60 ℃之间,常温条件下为玻璃态,分子链表现出较强的刚性,一般为无定形或半结晶型聚合物[9]。研究表明不同的聚合方法、共聚单体比例及相对分子质量,会赋予PLGA 不同的聚集态结构,进而影响其亲疏水性、机械强度及生物降解速率等[10]。本文就PLGA 的合成、聚集态结构、降解性能及应用进展等进行综述。
1 PLGA的合成
PLGA 的性能取决于其共聚单体组成比例、分子量及分子量分布、纯度等因素,不同方法制备的PLGA在性能参数上也存在差异。因此,越来越多的研究者关注PLGA 的合成工艺及方法[11]。目前,合成PLGA常用的2种方法是开环聚合法和直接缩聚法。
1.1 开环聚合法
开环聚合法可以更好的控制单体聚合,获得较高分子量的聚合物,是目前较为成熟且应用最广泛的PLGA 合成方法[12]。该方法是通过LA 和GA 分别脱水环化制备得到丙交酯和乙交酯,乙交酯和丙交酯提纯后进一步开环聚合,得到相对分子量较高的PLGA。开环聚合法又分为开环无规共聚法和开环交替共聚法。其中,开环无规共聚法是首先合成乙交酯和丙交酯,随后二者进行开环共聚合成PLGA,具体工艺流程如图1所示,该方法可以通过调节乙交酯和丙交酯的比例控制PLGA 的组成,但是由于乙交酯和丙交酯的竞聚率不同,所以很难得到组成均一的PLGA[13]。而开环交替共聚法是首先通过酯化和环化反应合成乙丙交酯单体,随后将乙丙交酯单体进行开环共聚合成PLGA,如图2所示,该方法合成的PLGA 结构更加规整,研究发现LA 甲基单元带来的空间位阻以及规整的交替结构分布使PLGA 的降解性能更加稳定[14]。尽管开环交替共聚合成的PLGA结构更加规整,但乙丙交酯单体通常难以获得,目前最常用的合成方法仍然是开环无规共聚法。此外,由于开环聚合需要合适的催化剂以制备所需分子量的PLGA,寻找最佳的催化体系也是开环聚合的研究重点。目前工业上制备PLGA 使用最广泛的催化剂是辛酸亚锡,但聚合得到的PLGA 即使经过多次沉淀仍无法完全去除锡,而锡杂质会对人体产生毒性作用。Giram 等[15]采用L-脯氨酸锌和辛酸亚锡制备了低分子量PLGA 共聚物,首次根据OECD-1 毒性指南对合成的2 种PLGA 进行了安全性和毒性比较,发现使用L-脯氨酸锌作为催化剂合成的PLGA 无毒性,在生物医用领域可以进行更深入的探索。总的来说,获得结构可控的PLGA 和制备新型低毒催化剂是未来开环聚合的研究重点。
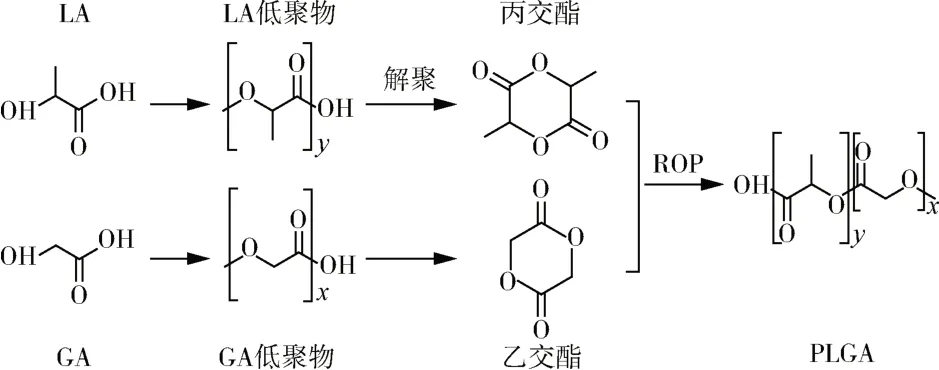
图1 开环无规共聚PLGA的制备Fig.1 Preparation of PLGA by ring-opening polymerization
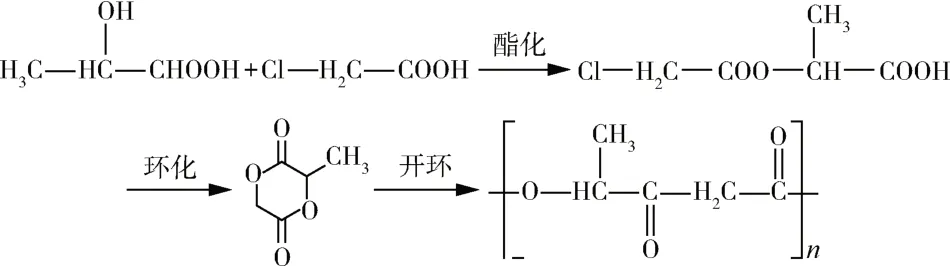
图2 交替聚合PLGA的制备Fig.2 Preparation of PLGA by alternating polymerization
1.2 直接缩聚法
与开环聚合法不同,直接缩聚法是一种通过溶液缩聚或熔融缩聚使LA 和GA 分子发生脱水缩合反应来制备PLGA 的方法[16]。其中,溶液缩聚制备PLGA的优点是反应温度始终处于体系的共沸点下,易于控制,可避免由于升温和局部过热而带来的聚合物降解。缺点是由于使用了大量的有机溶剂,具有污染大、提纯困难的缺陷[17]。而熔融缩聚则不使用溶剂,得到的产物纯度高,工艺路线简单经济,技术也日趋成熟。Wang 等[18]采用融熔缩聚法对比分析了不同反应条件下合成的PLGA,研究发现反应温度和压力分别为165 ℃、70 Pa、催化剂(SnCl2)含量为0.5 %、聚合时间为10h 时,PLGA 的产率最高。但总的来说,融熔缩聚反应过程中会生成小分子物质,当单体达到一定转化率时,反应很难再向生成大分子的方向进行,只能得到分子量低且分子量分布较宽的PLGA。随后,为了获得高分子量的PLGA,研究者通过2 种方法进行处理:一种方法是在熔融缩聚完成后继续进行固相缩聚,进而可得到重均分子量最高为80 000 的聚合物;另一种方法是通过引入羟基型扩链剂和羧基型扩链剂以提高PLGA 的分子量。但2 种方法合成的PLGA 均为无规共聚物,结构规整度差,同时固相缩聚反应时间长,而扩链产物中也常会发生交联影响产物性能[19-21]。
开环聚合法和直接缩聚法均属于化学合成方法,不可避免地涉及金属催化剂的使用和残留单体的去除,进而影响生物医学应用材料的生物相容性和生物安全性。近些年来,人们探索了一种新兴的代谢工程途径用来合成PLGA。其中具有代表性的是Lee 等的研究工作,该工作中报道了一种在大肠杆菌中利用碳水化合物一步发酵生产PLGA 的新方法,这种异源生物合成方法为PLGA的合成开辟了新途径[22]。
2 PLGA的聚集态结构
由于PLGA 是LA 和GA 经缩合聚合或乙交酯和丙交酯经开环聚合得到的共聚物,因此单体种类、共聚单体比例和分布是影响其聚集态结构的关键[23-24]。而聚集态结构中,结晶结构对PLGA 降解性能的影响尤为显著,因此本节主要综述PLGA 结晶结构的研究进展。对PLGA 单体种类而言,原料乳酸具有旋光性,导致PLGA 具有不同异构体。熊等[25]指出PLGA 的结晶性能随旋光度的减少而显著降低,甚至不结晶,同时由于人体只具有分解L-乳酸的酶,因而通常采用L-乳酸来合成PLGA。Tsuji等[26]研究发现对于缩合聚合制备的无规PLGA,在低LA 含量(0~20 %)和高LA 含量(73 %~100 %)范围内聚合物处于结晶状态,且LA 和GA 形成了共晶结构,在LA 含量高的PLGA 中,GA 作为缺陷并入了LA的结晶单元中,而LA含量低的PLGA中,LA 作为缺陷并入了GA 的结晶单元中[图3(a)]。缺陷单元排入晶格通常会减弱无规共聚物的结晶程度,改变其结晶结构,因此LA 含量在31 %~65 %范围内PLGA 是无定形的,而结晶PLGA 的结晶度也均低于纯PGA 和PLA。Sato 等[27]进一步发现共晶结构的存在,使GA 羰基上的O 原子与LA 甲基上的H 原子之间形成了新的分子间氢键作用,进而使PLGA 形成了均匀的片晶结构[图3(b)]。Wang 等[28]通过研究无规共聚的PLGA(GA∶LA=5∶95和90∶10)在等温结晶过程中的结构演变发现共聚物中GA 含量的降低会导致结晶速率的降低,Fu 等[29]进一步对比了PGA、PLGA(GA∶LA=5∶95和90∶10)在更宽温度范围等温结晶过程中的结构特征,同样发现GA含量的增大可以加快共聚物的结晶速率。
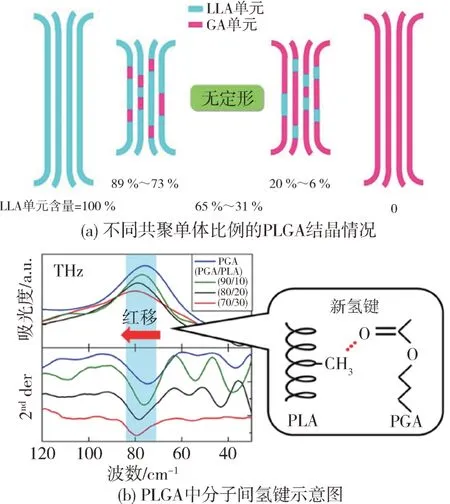
图3 不同共聚单体比例的PLGA结晶情况和PLGA中分子间氢键示意图[26-27]Fig.3 Crystallization of PLGA with different comonomer proportions and schematic diagram of intermolecular hydrogen bonding in PLGA[26-27]
在结晶性能调控方面,高分子制品在加工过程中会受到包括温度、拉伸、剪切等外场作用,通过改变加工条件可实现制品的结构和性能调控[30-31]。潘等[32]系统地研究了共聚组成和结晶温度(Tc)对高GA 含量的PLGA 的结晶动力学、结晶结构及加热和退火引起的结构演变的影响。如图4所示,研究表明受动力学控制,LA 单元作为缺陷排入晶格形成共晶结构,与PGA相比LA 的加入抑制了结晶。低Tc下形成的缺陷结构是亚稳态的,而高Tc下更容易形成热力学稳态晶体,且形成的结晶结构更规整,因而结晶度随Tc的增加而增大。加热和退火使缺陷晶体先熔融再重结晶形成热力学更稳定的晶体。Benjamin 等[28-29]探究了PGA 和PLGA 纤维在热拉伸和热处理过程中的结构与性能关系。结果发现在相同加工条件下提高热拉伸温度可以增大结晶尺寸,玻璃化转变温度以及拉伸强度。在热处理过后,PGA 和PLGA 纤维的结晶度,玻璃化转变温度和拉伸强度均较未热处理前显著增加。Wang等[33]探究了拉伸和松弛状态下的PLGA(LA 含量为8 %)纤维,在加热和退火过程中的微观结构演变。结果表明热处理会使结晶变得完善,增大结晶尺寸、晶胞参数和结晶度,进而改善力学性能;松弛状态的PLGA结晶性能优于拉伸状态,展现出更大的晶体尺寸、晶胞参数和结晶度;同时观察到加热过程中,温度在60~80 ℃范围内LA 会排出晶格,得到稳定的结晶结构。Dong 等[34]用原位广角X 射线衍射(WAXD)、小角X 射线衍射(SAXS)和差示扫描量热分析(DSC)技术,对比了100、120、140 ℃热处理温度下PLGA 纤维的晶体结构变化,发现在120 ℃下PLGA纤维的等温结晶时间最短,结晶速率最高。
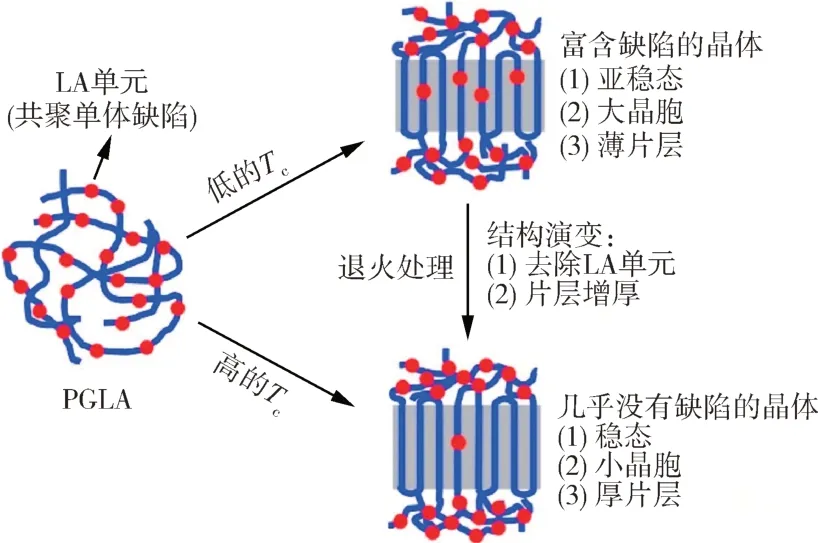
图4 不同Tc及热处理条件下PLGA的结晶结构示意图[32]Fig.4 Schematic illustration for Tc-dependent crystalline structure of PGLA[32]
此外,研究者们还通过接枝、添加成核剂、引发剂、制备共混物等方法来调控PLGA 的聚集态结构。Santos 等[35]以微晶纤维素和白炭黑为填料制备了PLGA共混物,其中微晶纤维素对共混物的结晶起到了成核剂的作用,随着微晶纤维素含量的增加,共混物的结晶度增大,2 种填料共同添加可进一步显著提高结晶度。Dai等[36]以N′N-亚甲基双丙烯酰胺(MBAM)为交联剂对四臂PLGA 进行交联,合成了一种高结晶度的PLGA 材料,通过改变交联剂含量可使结晶度控制在30 %~78 %,交联后的PLGA降解速率显著降低,进而有效减少降解过程中形成的LA,更有利于细胞的生长。Tsuji等[37]分别合成了P(LLA-alt-GA)和P(DLA-alt-GA)对映体交替乳酸共聚物,并制得了二者的立体络合物,研究发现与纯共聚物相比,立体络合物共混物的熔点温度(187.6 ℃和187.8° C)远高于纯共聚物的熔点温度(74.6~83.2 °C),且立体络合物微晶球晶径向生长速率要比纯共聚物的最大值高2个数量级,具有更优异的结晶性和热稳定性,因此将不同对映体共混是制备高结晶性可降解材料的一种有效方法。
3 PLGA的降解性能
PLGA 的降解主要是水解降解,过程分为4 个阶段:(1)水合作用:水分子渗透到非晶区并破坏范德华力和氢键,导致玻璃化转变温度降低;(2)初始降解:聚合物主链由于水解而使酯键断裂,导致分子量和力学性能下降,在此过程中非晶区先降解,然后扩展至晶区;(3)持续降解:聚合物变成低聚物碎片,整体质量开始减少;(4)增溶:低聚物进一步水解,变成尺寸更小的碎片或单体溶解在介质中[38-39]。总的来说,PLGA 的降解性能主要取决于共聚单体比例、结晶度、相对分子质量、pH值、热处理条件以及机械载荷等[40]。
3.1 共聚比例
由于GA 单元比LA 单元亲水性强,因此共聚物中GA 含量越高降解速率快。Gentile 等[41]总结了不同共聚单体比例的PLGA 的降解周期,如表1所示,可以看出PLGA的降解周期随LA含量的增加而成倍增长,其中LA∶GA=50∶50 时,降解速率最快,较纯PLA 快近10倍。
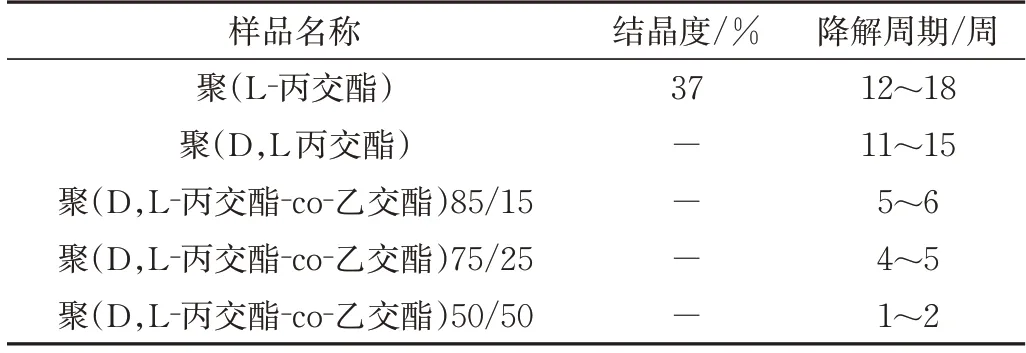
表1 不同共聚单体比例PLGA的降解周期[41]Tab.1 Degradation cycle of PLGA with different proportions of copolymer[41]
3.2 结晶度
在降解的前2个阶段,降解速率严重依赖于聚合物的聚集态结构,即无定形和结晶结构。与无定形区域相比,聚合物的结晶区域显示出更高的耐降解性。Fredericks 等[42]提出PLGA 水解过程中水分子优先扩散进入松散的无定形区,使无序的分子链发生断裂,这些断裂的分子链由于运动能力增强会再次有序排列形成结晶结构,即发生了断裂诱导结晶,而后水分子慢慢浸入结晶区使分子量变得足够小而全部溶解,因此结晶度在降解过程会先增大后减小。
3.3 相对分子质量
分子量较低的PLGA具有较短的分子链,其降解时间较短,降解速率较快。Kumskova等[43]对比分析了3种不同相对分子质量PLGA(LA∶GA=50∶50)的降解特性,结果显示相对分子质量越低的PLGA表现出更高的降解速率。Lee 等[44]将此规律归因于低分子量PLGA分子链间的物理缠结少,能够在水合过程更快的形成孔隙,因此生成低聚物的速度较快,降解时间变短。
3.4 pH值
一方面降解产生的酸性产物会导致体系pH 急速下降,形成酸性的微环境,对PLGA 起到自催化作用而加速降解[45];另一方面,在碱性环境中随着pH 值的增大,酯键更容易断裂,同时过量的碱还可以起到中和作用,进而促进水解反应的进行。因此,过酸和过碱环境都会促进PLGA的降解[46]。
3.5 热处理条件
Wang 等[47]对比了不同热定型温度下PGA 和PLGA(LA含量为8 %)纤维在体外降解过程中的结构演变,结果显示原始PGA 纤维在降解21天后残留量仅为10 %,热定型后的PGA 纤维在21 天后残留量超过40 %,28 天后残留量约为15 %,而原始PLGA 纤维在降解28天后残留量小于40 %,热定型后的PLGA 纤维在28 天和42 天的残留量分别保持在80 %和20 %左右。即随热定型温度的升高降解速率降低,且PGA 比PLGA 更容易发生降解。同时由于纤维状样品中同时存在纤维晶和片晶,且纤维晶和片状晶体的降解速率不同,使结构演变更为复杂(图5),但LA单元的引入显著降低了无定形区和结晶区降解速率的差异,使二者在降解初期几乎同时降解,导致PLGA 的降解机制不同于PGA 纤维,该研究有望为制备高性能纤维提供理论依据。
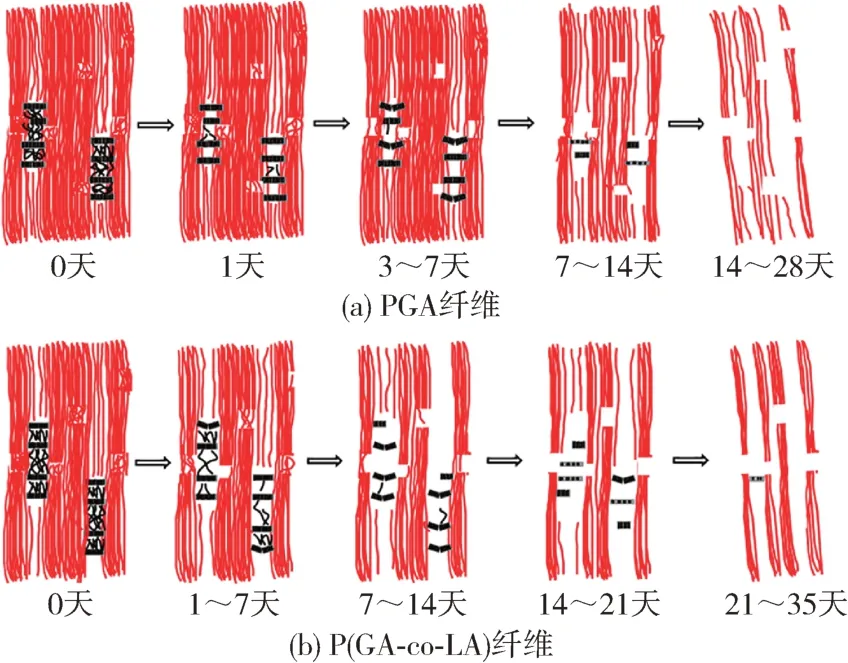
图5 PGA和 PLGA纤维的体外降解示意图[47]Fig.5 Schematic diagram of a four-stage model of the in-vitro degradation mechanism of the original PGA and P(GA-co-LA)fiber samples[47]
3.6 机械载荷
Li等[48]对比了施加拉伸应力与未施加拉伸应力的PLGA 支架在PBS 溶液中的降解行为,在降解过程中,由于施加机械载荷改变了PLGA 的结构,如链单元或侧基的键长、键角、分子链的取向和伸长等,这些因素共同作用下使水分子更容易进入PLGA 内部,导致施加了机械载荷的PLGA 降解速率更快。Chu 等[49]研究了不同流体剪切应力下PLGA的降解行为,也得到相似的结果。Markocic 等[50]分别采用模压法和间歇压力急冷法制备了普通的PLGA 片材和PLGA 发泡片材,由样品表面形貌及质量损失情况得到发泡PLGA 片材的降解速率慢于模压法制备的PLGA片材。
3.7 其他
老化条件、孔隙率等因素也会影响PLGA 的降解。Yoshioka等[51]研究了物理老化对PLGA(LA∶GA=75∶25)薄膜降解性能的影响,结果表明在老化过程中,体积收缩会伴随着微观结构非均质波动,加速水分子扩散,进而导致老化后的PLGA 薄膜的降解速率高于未老化样品。PLGA 的孔隙率也会影响水解的速率,研究表明多孔PLGA 泡沫由于其较薄的壁厚和较大的表面积而具有较小的自催化作用,因此无孔PLGA 样品的水解降解速度比多孔泡沫样品快[52]。
4 PLGA的应用
在众多的生物可降解高分子材料中,线性脂肪族聚酯的研究和应用是最广泛的,这类聚合物作为生物医用高分子材料,在人体内会最终降解代谢为二氧化碳和水,不会对人体产生伤害,因此被广泛用于药物控释、医用手术缝合线、骨组织工程等生物医学领域,如图6所示[53]。
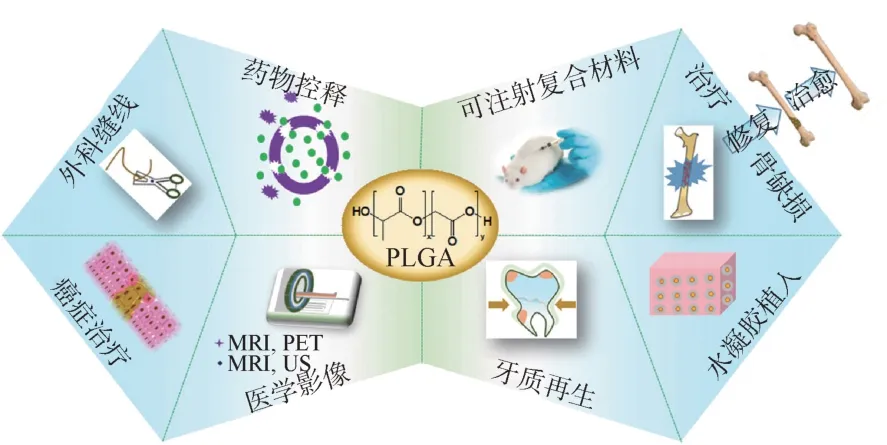
图6 PLGA在生物医学领域的应用[53]Fig.6 Applications of PLGA in different biomedical fields[53]
4.1 药物控释
PLGA 被广泛用作药物传递系统的材料。通过将药物封装在PLGA 微球、纳米粒子或薄膜中,可以实现药物的缓慢释放,增加药物的稳定性和生物利用度,并控制药物释放速率,从而提高治疗效果[54-55]。PLGA 药物释控的机制是通过PLGA 的降解实现,当PLGA 暴露在体内时,水分子的渗透会导致PLGA 的降解并形成微孔结构,从而使药物从微孔中释放出来。PLGA药物控释的速率可以通过多种因素进行调节,包括PLGA 的化学结构、相对分子质量、组成比例、材料的形状和制备方法等。通过调节这些因素,可以实现从几天到几个月甚至更长时间的药物递送[56]。为了改善PLGA 的制剂性质,如药物稳定性、降解性、释放特性和药物靶向性等,需要对PLGA 进行结构修饰。如图7所示,通过引入聚乙二醇(PEG)、聚环氧乙烷(PEO)可以提高PLGA 的亲水性。通过接枝聚乙烯醇(PVA)可将PLGA 的降解机理由本体侵蚀转变为表面侵蚀,进而改善PLGA 的降解性能,并接枝含正电荷的基团(如氨基)以增强细胞黏附和药物吸收[57]。此外,Wang等[58]采用壳聚糖通过物理吸附和化学结合的方法对PLGA 的表面进行了改性,制造了一种新型的基于PLGA 的药物递送系统,壳聚糖修饰过的PLGA 纳米颗粒的表面呈正电性,正电荷和亲水性诱导了较长时间及高积累的药物释放,为扩展基于PLGA 的药物递送系统的应用提供了新方法,并为细胞分子靶向偶联提供了可能。
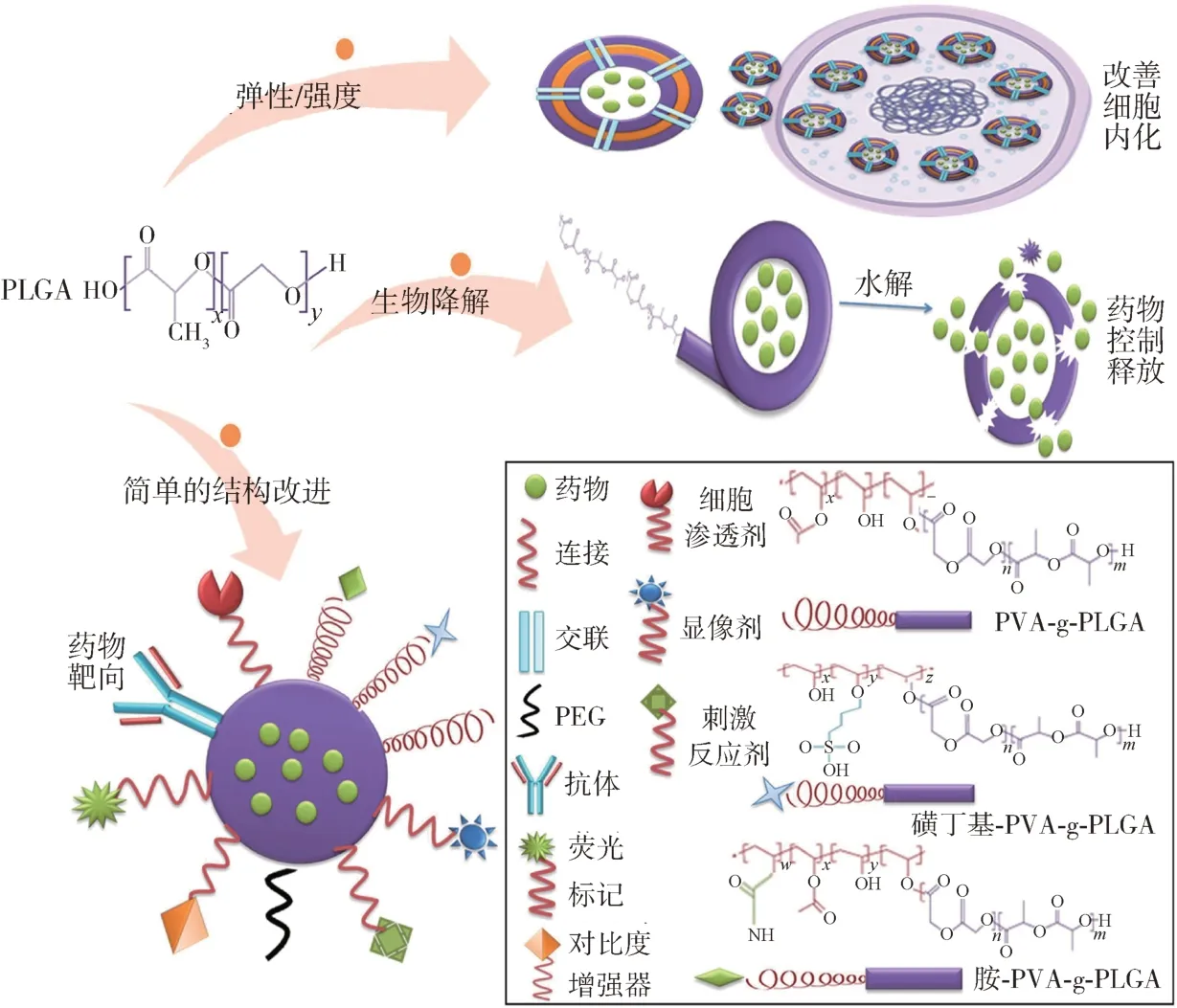
图7 PLGA药物释控及结构修饰示意图[56]Fig.7 Schematic diagram of drug release control and structural modification of PLGA[56]
4.2 医用手术缝合线
缝合线是外科手术中用于缝合伤口的一种特殊用线,但传统的缝合线往往需要在伤口组织愈合后进行拆除,对组织造成二次伤害。20 世纪70年代,基于PGA 的可吸收缝合线被开发出来,随后又发明了PLGA 缝合线,该手术缝合线在伤口愈合中展示出良好的拉伸强度和优异的生物相容性,正逐步取代传统的肠线缝合线。近年来随着研究的不断深入,人们已经不再满足于单一功能的PLGA 手术缝合线,Huh等[59]提出了一种可生物降解的PLGA 手术缝合线,该缝合线与药物输送载体通过物理编织的方式结合,不仅可以保持自身的力学性能,还可以实现局部持续的药物释放,缓解伤口愈合过程中的疼痛感。此外,Lee等[60]研究的葡萄果实天然提取物涂覆的新型抗菌和可生物降解PLGA 手术缝合线、Bae 等[61]研究的PLGA/PEO/聚乙烯亚胺(PgP)抗血栓缝合线以及Lee等[62]研究的含有地塞米松(DEX)的抗炎性PLGA 手术缝合线,均成功的将药物掺入到PLGA 可吸收手术缝合线中,进而实现了多重功效的目标。
4.3 骨组织工程支架
骨组织工程支架是一种用于修复和再生受损骨组织的结构。它可以为新生骨细胞提供支撑和生长环境,并在骨愈合过程中逐渐降解,最终被新生的骨组织取代[63]。组织工程支架应具有生物降解性、生物相容性、生物活性、结构连续性和稳定性等特性。如图8所示,PLGA 骨组织工程支架,包括静电纺丝纳米纤维支架、3D 打印支架、微球/纳米粒子、凝胶、多相支架等,因具有良好的生物学特性和工程学特性,被广泛应用于骨组织工程领域。

图8 PLGA基骨再生材料的典型应用形式Fig.8 Typical application forms of PLGA based bone regeneration materials
多孔PLGA/羟基磷灰石(HA)支架近年来引起了人们的广泛关注,它可以从孔状的细胞中转移营养物质和废物,并很好地支持细胞的附着和生长。郑等[64]开发了一种简单而低成本的用聚(γ-苄基-L-谷氨酸酯)和聚-L-赖氨酸修饰多孔PLGA/HA 支架,以促进细胞生长和成骨分化的方法。Wang 等[65]采用静电纺丝法制备了不同HA 含量(0、5 %和10 %)的PLGA/HA 复合支架,并以3种不同方式将DNA掺入支架中,结果表明DNA/壳聚糖纳米颗粒包封的支架具有较高的细胞附着性、较高的细胞存活率和良好的DNA 转染效率,该复合支架在骨再生中具有广阔的应用前景。同时,性能优异的3D 支架也受到了越来越广泛的关注。Dai等[66]利用PLGA 高强度网络和胶原蛋白促进组织形成的特点设计了3 种混合结构的3D 支架,使3 种支架都表现出丰富的软骨细胞外基质沉积性和良好的体内生物降解性。此外,Bazgir等[67]研究的用于血管组织工程的静电纺丝聚已内酯(PCL)和PLGA 支架、Wang等[68]制备的重组负载型PLGA/胶原纳米纤维支架,这些理论研究均为PLGA 在组织工程支架领域的应用提供了更多可能。
5 结语
综述了近年来PLGA 在合成方法、聚集态结构、降解性能等方面的研究进展。PLGA 因其良好的生物相容性、可降解性和力学性能,已成为用途最广泛的可降解医用高分子材料之一。在实际应用中,通过控制合成方法和聚集态结构,可有效调控PLGA 的降解速率,得到满足实际应用需求的PLGA 制品,使其在药物控释、医用手术缝合线、骨组织工程支架等领域具有更广阔的应用前景。但由于PLGA 聚集态结构,尤其是结晶结构的复杂性,及外场(如温度场和外力场)作用下多尺度、非均相的微观结构演变,建立聚集态结构与宏观力学性能和降解行为的内在联系仍是未来需要深入研究的方向。此外,随着高分子材料的广泛应用,不可避免的会带来一些环境污染问题,如“白色污染”、“黑色污染”和“彩色污染”。未来,需要加强对高分子材料的环保监管,推动可降解生物高分子材料的可持续发展,以解决潜在的环境和社会问题。

