一种7.5F自研心腔内超声动物实验
冯文慧,何精才,曹琴,周欣欢
深圳心寰科技有限公司,广东 深圳 518101
引言
微创导管介入是当前临床一线的心脏疾病手术治疗工具。随着心脏介入手术过程的复杂化,精准术中引导对于优化临床手术效果、降低并发症具有重要意义。心腔内超声(Intracardiac Echocardiography,ICE)是当前临床上常用的心脏介入手术引导设备,往往经股静脉穿刺进入右心房,并通过打弯和旋转等操作调整成像视野、选择待观测切面。ICE 通过对多种不同心内手术进行术中引导和监控,能降低并发症、提高手术效率和安全性,显著降低X 射线的使用频次。相比于食道超声,ICE 无食道损伤等并发症,无需全麻,因此可以降低心内科手术对麻醉科的依赖[1]。
当前临床上使用的ICE 产品一般在8F~10F,大多数商业化ICE 导管通过在可调弯导管头端集成微型相控阵超声探头,获得B 模式、多普勒和彩色血流模式图像,实现大成像深度(高达16 cm)、宽视野(90°)的心内结构和功能成像。更细导管尺寸通常具有更显著的临床意义:① 大多数先天性心脏病患者通常在未成年时进行手术,未成年人心脏和血管结构较小,更细导管具有更小的穿刺损伤和更低的并发症可能;② 在左心系统的一些手术如左心耳封堵、二尖瓣手术中,ICE 常常需要通过房间隔穿刺由右心房进入左心系统,从而近距离对左心系统内手术进行导管位置和结构反馈并提供实时引导。当前临床上使用的房间隔穿刺鞘大部分为8.5F,8.5F以内的ICE 导管可借助穿刺鞘进入左房,降低房间隔穿刺难度。
然而,开发更细的ICE 导管具有极高的技术和工艺难度,多容易导致图像质量如灵敏度、分辨率等降低。因此,本文旨在开发一款7.5F 相控阵2D ICE,解决ICE 导管难以进入左心房的临床难题,并进行超声探头回波测试、超声体模和动物实验,验证其回波性能和图像质量。
1 材料与方法
研究开发一款7.5F 相控阵2D ICE 系统,包括便携式彩超主机、连接器和ICE 导管。本项目自研导管介入端长度为90 cm,导管远端具有四向可调弯功能,其单向调弯角度≥160°。同时,手柄采用自锁手柄结构,通过摩擦力进行调弯角度锁定,实现术者单手调弯,便于临床操作。
为验证该系统的声学性能和图像性能,本研究进行3 部分测试:① 搭建声学回波测试系统和平台,进行声学回波测试;② 标准超声体模测试;③ 巴马猪在体动物测试。
2 成像系统和测试系统
2.1 成像系统
本文所开发的64 通道便携式彩超主机能够实现基波成像、二次谐波成像和多普勒血流成像。该便携式超声系统可支持相控阵和线阵探头,在相控阵工作模式下,该系统能以三态电平发射,实现多波束数据采集和高帧频成像。
本研究中的7.5F 使用一次性ICE 介入导管(AgileView,深圳心寰科技有限公司),包含64 通道超声阵元,横向尺寸约为强生10F SoundStar ICE 换能器的50%,中心频率为6.5 MHz。本文使用的导管由多种不同硬度的中空Pebax 多腔管拼接而成,导管硬度从远端到近端逐渐增大,以保证良好的推送性和安全性。导管管壁分布四根牵引丝以90°沿导管平行放置,手柄操作时,通过牵引拉丝实现对导管的调弯操作。Pebax 管的中空腔内容纳相控阵超声换能器和超声线缆,实现到连接器和超声主机的电气连接。
2.2 回波测试系统
为了测试换能器和线缆,本文设计一套换能器脉冲回波测试系统和软件(图1)。其中,脉冲发生器采用JSR DPR300(Imaginant Inc,美国),可在服务器的控制下发出脉冲激励。自研多通道切换板卡能够在64 个换能器通道中依次进行自动选择和通道切换。位于水槽中且浸泡在水环境中的换能器的某一通道在接收到脉冲激励后发出超声波。超声波在水中经历一段距离的传播后,遇到反射板反射回换能器,并产生脉冲回波电压,由MSO34 示波器(Tektronix Inc,美国)采集到该回波电压后,上传到服务器进行在线数据处理,包括傅里叶变换、频域分析等。当示波器采集完64 个通道的回波数据并分别进行数据分析后,计算各个通道的灵敏度、中心频率和带宽的一致性,从而对换能器进行性能分析和检测。

图1 换能器回波测试系统
2.3 超声体模测试
为测试自研7.5F 成像系统的成像性能,将自研超声主机和自研7.5F ICE 导管连接后,采用CIRS 040GSE 标准超声体模进行超声B 模式图像测试。该体模包含两种声衰减系数,分别为0.5 dB/MHz/cm和0.7 dB/MHz/cm。由于ICE 在心内操作,血流的声衰减系数为0.14 dB/MHz/cm,本项目中以低衰减系数(0.5 dB/MHz/cm)作为对比。
为验证成像性能和参数,对自研7.5F ICE 导管系统与强生Soundstar 10F ICE 导管系统进行对比,即通过连接器,将自研7.5F 导管和强生SoundStar 10F ICE 导管分别连接到自研便携式彩超主机上,采用相同的成像参数包括峰峰值电压、机械指数和扫描线密度等,扫描同一个超声体模的同一位置,并采用相同的后处理参数,如动态范围等。扫描结束后,对比两根导管获得的图像最大成像深度、分辨率等。
2.4 动物实验
本文所有动物实验均经本院医学伦理委员会审批通过(批准文号:DY22120424),且在符合标准实验室规范的动物实验中心进行。选取成年巴马猪(体重46 kg)作为实验对象,对其进行气管插管、异氟烷气体全麻后,注射5000 单元肝素,并使用监护仪进行全麻术中实时监护。随后,采用8.5F 短鞘管进行股静脉穿刺,将连接到便携式超声主机的7.5F ICE 导管经穿刺短鞘管内进入右侧股静脉,再沿下腔静脉进入右心房。该过程中无需数字减影血管造影引导,根据导管自身的B 模式图像反馈可判断导管位置。当导管进入右心房后,在右心房内进行调弯、旋转等标准导管操作以调整成像视野和角度,并采集超声图像和视频。超声采集结束后,导管回到原位,沿血管撤出。
为验证在体成像性能和参数,本文将自研7.5F ICE导管系统与强生Soundstar 10F ICE 导管系统进行对比,即通过连接器,将自研7.5F 导管连接到自研主机上进行图像采集。自研导管撤出后,再将强生SoundStar 10F ICE 连接到西门子Acuson P500 主机上,进入到同一成像位置采集同样成像视野下的视频和图像进行对比。
3 结果
3.1 回波测试结果
本研究中的自研ICE 换能器每个通道-6 dB 带宽>70%,64 个通道具有较高一致性,且具有良好的灵敏度(图2)。由于换能器具有较高带宽,基于此,本研究中的换能器进行了二次谐波成像,以进一步提高成像分辨率。

图2 自研64通道ICE换能器某一通道回波信号电压随时间变化(a)和功率增益随频率变化(b)曲线图
3.2 体模测试结果
强生SoundStar 10F ICE 和自研7.5F ICE 在标准体模上的基波成像效果如图3 所示,二者的成像深度无可见区别,均可达到9 cm;分辨率测试在标准CIRS 040GSE 超声体模上进行,自研7.5F ICE 纵向分辨率与强生SoundStar 10F ICE 无肉眼可见区别,均<1 mm;自研7.5F ICE 横向分辨率<1 mm,靶点拉伸更少,边界更清晰,而强生SoundStar 10F ICE 横向分辨率>1 mm,因此自研7.5F ICE 导管系统具有比强生SoundStar 10F ICE 导管系统更优的横向分辨率。
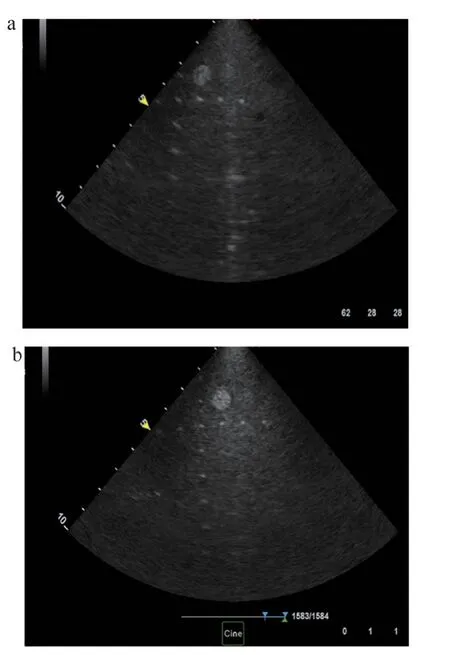
图3 强生SoundStar 10F ICE(a)和自研7.5F ICE(b)图像对比
3.3 动物实验结果
在体巴马猪实验过程中,导管经穿刺鞘顺利到达目标部位,采集到超声图像和视频后,顺利撤出体内,无不良事件及折弯、卡顿等情况发生。手术过程中,导管推送性能良好,调弯手柄操作简单,调弯角度准确,系统运行稳定。动物实验结束后,饲养实验巴马猪1 个月后对其进行检测,肝功、肾功、心功均正常。
在同一头巴马猪上采集到的图像如图4 所示,自研7.5F ICE 导管和强生SoundStar 10F ICE 导管成像视野角度均为90°。就图像分辨率和成像深度进行对比,自研7.5F ICE 系统在体动物实验图像均可达到9 cm 以上,自研7.5F ICE 导管系统分辨率与强生SoundStar 10F ICE无肉眼可见区别(均为1 mm 以内),且自研7.5F ICE导管更细。相比之下,自研7.5F ICE 导管系统能更清晰地识别瓣膜,满足临床诊断需求,而强生SoundStar 10F ICE 导管系统对于瓣膜显影较为模糊。
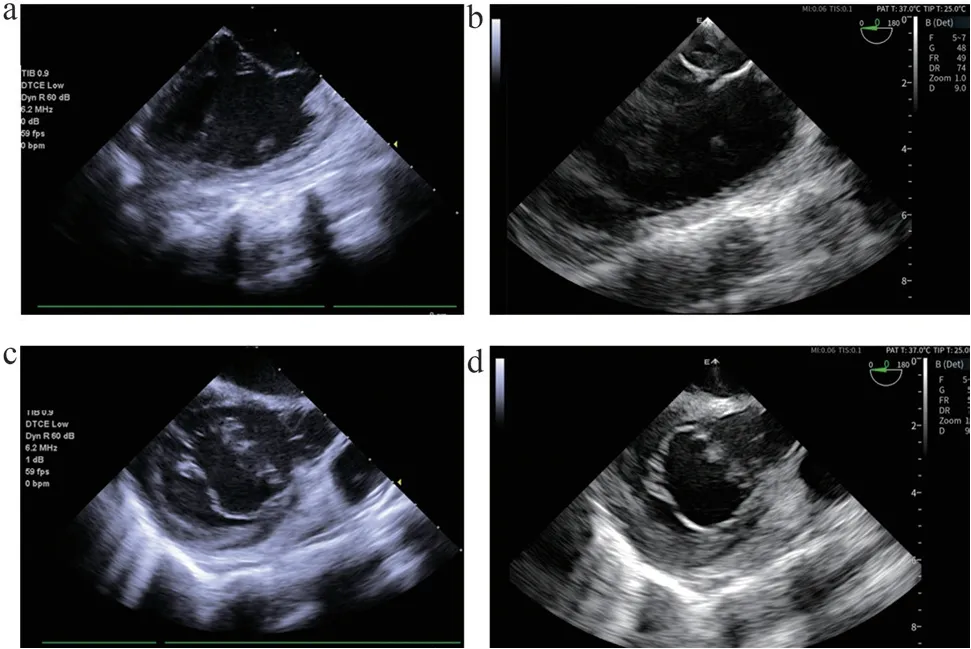
图4 同一头巴马猪ICE成像结果
手术结束后,对巴马猪进行为期1 个月的喂养,巴马猪未有持续出血等术后并发症发生。
4 讨论
本文介绍了一款自研7.5F ICE 导管系统,可降低心脏介入手术对患者的穿刺损伤,且自研7.5F ICE 导管手柄能够实现单手调弯,操作更便捷。然而,该自研器械的安全性和临床可靠性还需继续进行多中心对照临床研究。
回波测试、体模和动物在体实验结果表明,本研究开发的自研7.5F ICE 导管具有良好的操控性,同时具有不劣于强生SoundStar 10F ICE 的图像质量,包括图像分辨率和最大成像深度。因此,自研7.5F ICE 导管系统能够满足多种心内介入手术的临床需求。
随着经皮微创介入心脏手术的普及化,精准的实时图像反馈以监控并发症、识别导管相对心脏结构的位置成为手术中的标配。当前导管室常用X 射线进行手术引导,该方式存在强辐射、无法实时显示心脏解剖结构等缺点。ICE 是当前唯一能够同时提供高质量心脏结构图像和功能信息,同时无需全麻的影像设备,还可提高成像效果[2]。凭借诸多临床优势,ICE 正取代食道超声成为心内科的术中引导首选设备[3-5]。例如,ICE 被用于引导MitraClip 系统进行二尖瓣修复[6]、经静脉电极拔除[7]、心脏活检[8-9]等,结果表明ICE 引导下的手术成功率及效率均得到了进一步提升[10]。
当前临床上ICE 的发展趋势为更优图像质量(如单晶探头ICE 等)、更细导管尺寸,以及由2D 向3D 和4D 的转化,有望实现向更多临床适应证拓展[11]。近年来,推出了西门子Acusion AcuNav V 和Acusion Acunav Volume、飞利浦Verisight Pro 和强生Nuvision 4D 等4D ICE 产品,早期的临床结果也表明,4D 导管在结构性心脏病等方面拥有不可替代的临床优势,可提高更多更复杂的临床适应证如瓣膜、左心耳修复、卵圆孔未闭封堵[12-14]等的安全性。
一方面,结合ICE 的超声斑点追踪等技术能够实时反馈心肌应力和应变等,有望在房颤等电生理心脏病手术中提供实时的消融评估工具[15-17]。ICE 结合超声斑点追踪,可实时评估心肌消融效果,结合消融导管消融指数测量,提供给术者更加精准、快速的消融效果评估,降低复杂房颤复发的可能性。基于ICE 的超声斑点追踪,能够同时进行心内血流矢量成像,从而实时监控术中血流动力学[18-19],用于引导介入瓣膜手术中的瓣膜返流和瓣周漏等。
另一方面,当前基于PZT 陶瓷的相控阵ICE 探头成本较高,因此降低探头成本是该技术进一步下沉的重要方向。目前,使用电容式微机械超声换能器(Capacitive Micromachined Ultrasonic Transducer,CMUT)探头能够显著降低成本,CMUT 包括1 层振动薄膜、真空空间和两个电极,通过电极通电产生振动和超声波。当回波信号传导到薄膜后,电极间电容改变,从而产生电流。相比于传统PZT ICE 探头,CMUT 凭其更小型的特点更容易进行电路集成,且拥有更高带宽和更优分辨率[20-21]等优势。
综上所述,本文介绍了一款目前市面上最细的心腔内超声系统,并通过声学性能测试、体模和动物实验验证其性能,从而论证了该系统的临床前可行性。

