PA28γ在免疫相关疾病中的作用及机制研究进展
苏崇莹 牛嘉璐 古浚杰 李敬 (.四川大学口腔疾病防治全国重点实验室,成都 6004;.四川大学华西口腔医学院临床医学中心,中国医学科学院口腔黏膜癌变与防治创新单元,成都 6004)
在真核生物中,蛋白酶体降解系统(ubiquitinproteasome system,UPS)与溶酶体降解系统对于机体保持正常的生理功能以及维持内环境稳态具有重要作用。其中,UPS在胞内蛋白的分解中通过调节关键蛋白的降解起着重要的作用,参与大多数生化反应过程的控制[1]。UPS发挥功能的主要结构是20S蛋白酶体,此外11S 与19S亚基主要承担激活与调节的作用[2]。PA28γ又称为Ki抗原、11Sγ或PSME3,是11S蛋白酶体激活因子家族(又称PA28家族、REG家族)的成员,能够独立于泛素化和ATP刺激20S蛋白酶体的蛋白水解活性[2-3]。
PA28γ于1981年在1例日本系统性红斑狼疮(systemic lupus erythematosus,SLE)患者血清中被发现,被命名为Ki抗原,而在克隆分析Ki抗原的序列以及成功制备其特异性抗体后,研究者发现Ki抗原能与20S蛋白酶体相互作用,并且发现Ki抗原与蛋白酶体激活因子PA28α和PA28β有着较高的同源性,自此Ki抗原被归入PA28家族中,命名为PA28γ或REGγ。PA28家族中,PA28γ与PA28α和PA28β存在很多异同点[4-7]。在氨基酸序列上,PA28α和PA28β有约50%的同源性,而PA28γ与PA28α和PA28β相比只有25%的同源性;在动物亚门中,PA28α/β只存在于脊椎动物体中。而PA28γ既存在于脊椎动物也存在于非脊椎动物体内,并且呈现高度保守的状态。在细胞内分布情况上,PA28α和PA28β主要分布在细胞质中,两者常形成异源七聚体。而PA28γ主要分布在细胞核内,常形成同源七聚体结合在20S蛋白酶体的两端。PA28α和 PA28β形成异源七聚体(PA28α/β)的表达被γ干扰素(PA28γ和PA28β的mRNA和蛋白水平由γ干扰素诱导协同升高)和某些传染病所诱导,但PA28γ不受这些因素的影响[2-3]。值得注意的是,TANAHASHI等[8]研究发现,γ干扰素在不影响PA28γ蛋白、mRNA表达水平的情况下使人结直肠癌细胞内的PA28γ蛋白几乎完全丢失。
通过对PA28γ基因缺陷小鼠模型和细胞分子生物学的研究,PA28γ对细胞生长和增殖的调节作用机制逐渐清晰。PA28γ表达缺失的小鼠出现体型缩小和细胞特异性有丝分裂缺陷的现象,提示PA28γ在调节细胞生长和增殖中扮演重要角色[9-10]。并且,缺乏PA28γ基因的小鼠胚胎成纤维细胞(mouse embryonic fibroblasts,MEFs)和果蝇细胞从G1期向S期的细胞周期转变较慢,表明PA28γ可调控细胞周期[9-11]。此外,缺乏PA28γ基因的MEFs凋亡显著增加,表明PA28γ参与了细胞凋亡的调控[10]。部分与细胞凋亡的启动或调控相关的PA28γ结合蛋白已经被发现,包括caspase-7、MEKK3、FLASH、Daxx、RanBPM和PIAS[12-14]。值得一提的是,PA28γ可以促进癌细胞的增殖、迁移和侵袭,此功能在肾细胞癌、乳腺癌、结肠癌、肺癌和甲状腺癌的发生发展中均有体现[15-19]。
1 PA28γ-蛋白酶体系统的降解作用
蛋白酶体降解系统发挥功能的主要结构是20S蛋白酶体。20S的核心是由2个外部的α环和2个内部的β环组成的筒形圆柱体。α环对蛋白质底物的入口有调节作用,而β环则产生蛋白质水解的作用。在PA28γ结合到20S蛋白酶体的α环上后,蛋白酶体活性增强、蛋白酶体对底物位点的切割特性发生改变。PA28γ不仅具备降解肽链的能力,还具备降解完整蛋白质的能力,且目前有越来越多的底物被发现并报道[4,7]。PA28γ通过与20S蛋白酶体结合促进肽链和非泛素化蛋白的水解,该过程与染色体稳定性、DNA修复、转录、细胞周期进程、细胞生长、凋亡、炎症、抗原呈递以及癌变密切相关[20]。
PA28γ-蛋白酶体系统途径的底物正在被逐步鉴定出来。LI等[21]首次报道了能够被PA28γ-蛋白酶体系统降解的细胞内完整蛋白,即类固醇受体共激活因子-3(steroid receptor coactivator-3,SRC-3)蛋白。采用RNAi敲减和功能获得实验证明PA28γ促进SRC-3蛋白的降解,首次证明了PA28γ可以泛素和ATP非依赖的方式促进完整蛋白的降解。相似的,NIE等[22]对于泛素连接酶Smad泛素化调节因子1(SMAD ubiquitination regulatory factor 1,Smurf1)的研究中,发现PA28γ可以泛素和ATP非依赖的方式促进Smurf1将其底物转运到PA28γ-蛋白酶体系统中进行降解。另有通过对200例乳腺癌标本的检测分析,发现PA28γ的表达与乳腺癌患者雌激素受体α(Estrogen receptor alpha,ERα)状态和ER阳性乳腺癌患者临床表现差、生存率低的状况呈正相关,进一步机制分析发现PA28γ可通过泛素-蛋白酶体途径间接调节ERα蛋白的降解[23]。除此之外,近年来的一项研究表明,PA28γ-蛋白酶体系统能通过抑制细胞rDNA转录和能量消耗,将rDNA转录激活剂SIRT7靶向于泛素非依赖性的正常条件下降解,并且敲除PA28γ基因后明显提高了能量代谢抑制剂在小鼠体内的抗肿瘤活性,表明抑制PA28γ-蛋白酶体系统具有导致肿瘤“饿死”的潜力[19]。除此之外,PA28γ-蛋白酶体系统还可降解PTTG、p53、p21、MAFA、p16、CK1δ、PKA和丙型肝炎病毒核心蛋白等具有多种功能的重要蛋白,因此PA28γ可能与机体新陈代谢以及多种疾病的发病有关[3-5,7-8,21-25]。
2 PA28γ在免疫相关疾病中的作用及机制
免疫系统在宿主防御及机体内环境稳定等方面发挥重要作用。PA28γ最早在SLE患者的血清中发现,但其是否在免疫系统中发挥作用尚不清楚。随着研究的深入,有学者指出PA28γ通过影响STAT3-免疫蛋白酶体-抗原呈递信号通路在自身免疫疾病中发挥作用[26]。孙锦霞[27]研究了PA28γ在机体抵抗细菌感染中的作用,发现PA28γ基因敲除型小鼠的巨噬细胞杀菌能力更弱,iNOS和NO的表达也低于野生型,进一步研究发现吞噬细胞中PA28γ能够降解转录因子KLF2,从而抑制KLF2调控的细胞核因子-κB(nuclear factor kappa-B,NF-κB)信号通路介导的炎症反应和细胞迁移[28]。前文提及PA28γ在多种恶性肿瘤中发挥着促癌作用,并对癌症的发生发展及预后产生较大的影响。以上证据均提示蛋白酶体激活因子PA28γ在免疫相关疾病发挥重要作用。
2.1 PA28γ在炎症中的作用及机制 PA28γ可通过调节复杂的炎症信号通路而影响炎症的发生发展,NF-κB信号通路发挥着重要的调节作用。有研究发现,NF-κB信号通路可以影响LPS诱导的支气管上皮细胞分泌炎症因子[28]。此外炎症反应损伤上皮细胞的完整性,初步激活了NF-κB,促进NF-κB抑制蛋白ε(NF-κB inhibitor ε,IκBε)和PA28γ表达。PA28γ升高通过泛素依赖性方式增强IκBε的降解,中和其抑制NF-κB的能力,从而导致PA28γ的进一步升高和NF-κB的激活。PA28γ和NF-κB之间通过IκBε的调节形成一个调节回路,具有潜在的正反馈作用。这点在结肠炎和睾丸炎症的相关研究中已经得到证明[29-30]。
PA28γ还可通过抑制IL-6的分泌参与自身免疫性神经炎症。有研究发现PA28γ的缺失可以提高树突状细胞IL-6的分泌[31]。PA28γ缺乏加剧了小鼠的自身免疫性神经炎症并促进了体内Th17细胞的分化,同时可以特异性降解其靶蛋白IRF8,下调树突状细胞整合素蛋白的表达,降解GSK3β,从而抑制IL-6的分泌[31-32]。另一项研究中,PA28γ作为miRNA的靶点调节炎症发展。PA28γ是miR-195-5p的直接靶点,miR-195-5p抑制剂通过调节Wnt/βcatenin和NF-κB信号通路抑制软骨细胞凋亡和炎症反应,而通过敲除PA28γ可以逆转miR-195-5p抑制剂对骨关节炎软骨细胞的所有作用[33]。
2.2 PA28γ在恶性肿瘤中的作用及机制 机体的免疫系统可以通过多种途径消除或抑制肿瘤细胞,但部分肿瘤细胞可以逃过机体的免疫应答,不断增殖最终形成恶性肿瘤。研究人员发现PA28γ在许多肿瘤组织中较正常组织表达水平存在较大差异,PA28γ在肿瘤的发生、发展和预后等一系列过程中起着非常重要的作用,其异常表达往往与肿瘤发生发展、免疫功能、预后不良等密切相关(图1、图2)[34]。
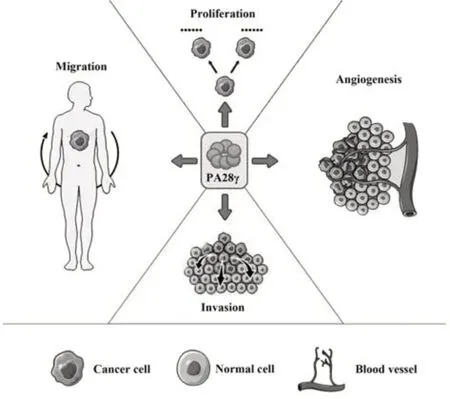
图1 PA28γ在肿瘤中的作用Fig.1 Role of PA28γ in tumors
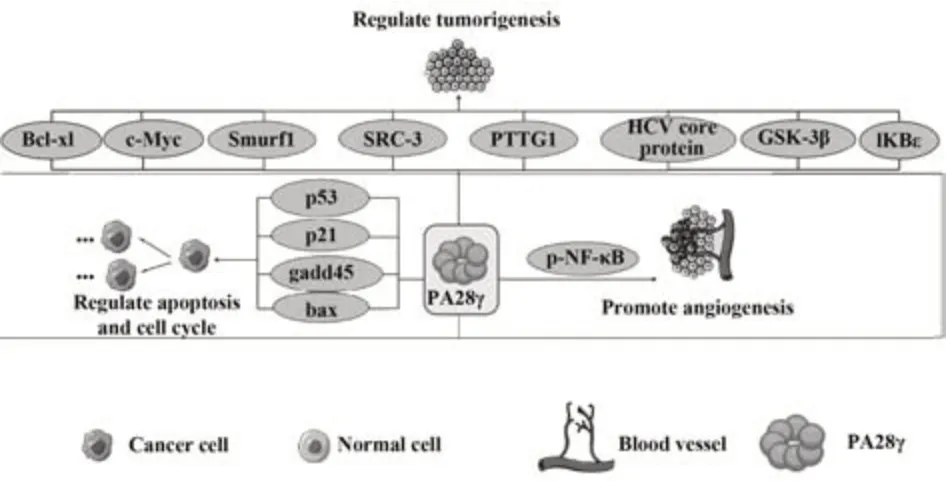
图2 PA28γ在肿瘤进展中的作用机制Fig.2 Mechanism of PA28γ in tumor progression
本部分主要分类概括PA28γ与上皮组织来源、非上皮组织来源的肿瘤以及其他肿瘤中的关系及其可能发挥的作用,并进一步探讨PA28γ调控肿瘤生物学行为可能的机制。
2.2.1 PA28γ与上皮组织来源的肿瘤 肿瘤是世界各国面临的最重要疾病之一,对人类的健康和生存构成了重大威胁。而人体上皮又被称为肿瘤的“发源地”,90%以上的肿瘤都源于此。其发病率约为肉瘤的9倍,多经淋巴道转移至所属淋巴结,有关上皮组织来源的肿瘤研究一直属于热点问题。近年来,越来越多的研究表明PA28γ在多种上皮组织来源的肿瘤中过度表达,发挥促癌作用,对癌症的发生、发展和预后等一系列过程产生重要影响,被视为潜在的癌症标志物与治疗靶点。
PA28γ在多种上皮组织来源的肿瘤中高表达,且与预后不良密切相关。免疫组织化学结果显示肾细胞癌组织中的PA28γ蛋白表达较正常肾脏组织显著上调,且PA28γ高表达的患者生存时间相对较短[15]。另有研究采用免疫组织化学和qRT-PCR检测35例胃癌和癌旁组织中PA28γ表达,发现胃癌组织中PA28γ的蛋白和mRNA表达水平明显升高。大量文献也报告了类似结果:PA28γ蛋白在乳腺癌、肝细胞癌、子宫内膜癌、肺癌、胰腺癌、甲状腺癌、口腔鳞癌等细胞和组织中表达上调,并提示预后不良[35-40]。
PA28γ在上皮组织来源肿瘤进展中的作用机制主要为以下几点:首先PA28γ通过调节细胞周期影响癌细胞增殖,研究者分析PA28γ基因缺陷和未缺陷的两种乳腺癌细胞系发现,PA28γ基因缺陷的乳腺癌细胞生长显著抑制,运动性显著减弱[23]。相似地,在CHEN等[15]关于肾细胞癌的研究中,发现PA28γ缺陷组肾癌细胞的增殖明显缓于对照组,流式细胞术结果显示肾癌细胞在G1/S期受到阻滞,Transwell检测结果表明肾癌细胞的侵袭能力受到抑制,提示了PA28γ/CK1ε轴与河马通路在肾癌细胞发展过程中相互作用,表明PA28γ在肾癌的发生发展中起关键作用,可能有助于寻找新的治疗策略。其次PA28γ可通过调节复杂的肿瘤相关重要分子和信号通路而影响肿瘤的发生发展,有研究者对于PA28γ相关基因进行生物信息学分析,筛选出U2小核RNA辅助因子1(U2 small nuclear RNA auxiliary factor 1,U2AF1),临床队列研究表明。PA28γ和U2AF1在口腔鳞状细胞癌组织中的表达水平由正常至口腔恶性疾病逐渐升高,且呈显著正相关。U2AF1高表达患者的总生存期明显缩短,联合应用U2AF1和PA28γ可明显提高预后预测的准确性[41]。无独有偶,酪蛋白激酶CK1ε参与调控细胞分裂、分化和凋亡等多种细胞过程,有研究显示,PA28γ可与CK1ε相互作用并破坏其稳定性而发挥致癌作用,而PA28γ缺失则可激活CK1ε介导的Hippo信号通路抑制肾细胞癌的发展[15]。c-Myc基因与细胞增殖有关,是多种癌症发生发展的关键转录因子[42]。有研究显示,PA28γ可通过抑制c-Myc降解来促进糖酵解,从而促进胰腺癌的发生发展[38]。Wnt/β-catenin通路在癌细胞增殖、迁移和侵袭等过程中都具有重要的作用。除此之外PA28γ通过促进血管生成影响肿瘤发生发展,PA28γ还参与口腔鳞癌的发生发展过程。有实验证明PA28γ在体外和体内均能促进口腔鳞癌细胞的增殖、迁移和侵袭[43]。沉默PA28γ抑制了HSC-3和HN31细胞诱导HUVEC迁移、侵袭和管状形成的能力,而过表达PA28γ则强烈地刺激了这两种细胞的能力。本课题组前期研究发现异常表达的PA28γ可通过上调p-NF-κB水平,促进肿瘤细胞分泌IL-6和CCL-2,激活内皮细胞IL-6和CCR-2下游的信号通路,刺激肿瘤微环境中的血管生成[3]。
综上,PA28γ在上皮组织来源肿瘤的发生、发展过程中起着非常重要的作用,通过降解多种肿瘤相关的功能蛋白而调控下游信号通路,从而影响癌细胞的增殖、凋亡、迁移和侵袭能力。以上研究表明PA28γ在作为癌症标志物和治疗靶点方面具有很大潜力,其异常表达往往与肿瘤发生发展、免疫功能、预后不良等密切相关。
2.2.2 PA28γ与非上皮来源肿瘤 非上皮来源肿瘤主要指起源于间叶组织的肿瘤,常见于结缔组织、脂肪组织、脉管组织、骨及软骨组织等。研究表明,PA28γ表达量与非上皮来源肿瘤的正向发展呈正相关,但目前的相关研究表明非上皮来源肿瘤相比上皮来源肿瘤而言十分有限[44-45]。接下来将讨论PA28γ与非上皮来源肿瘤之间的研究现状并进一步分析潜在的研究方向。
PA28γ与非上皮来源肿瘤细胞的生长、增殖、凋亡和迁移等表型息息相关。LIU等[44]通过构建shRNA-PA28γ下调了RPMI8226细胞中PA28γ的表达,发现多发性骨髓瘤细胞的增殖和迁移受到抑制,细胞凋亡受到促进。CHEN等[45]发现敲除PA28γ抑制了黑色素瘤细胞的生长,并将黑色素瘤细胞阻滞在G1期。
PA28γ可通过调节复杂的肿瘤相关信号通路而影响非上皮来源肿瘤的发生发展。在各类肉瘤的发展中,NF-κB信号通路扮演着重要的调节角色。上文提到的LIU等[44]的研究中,研究人员发现虽然IκBε的新增表达量在实验组中显著降低,但其降解速率也同时显著降低。从最终表型结果来看,PA28γ的表达量下降显著降低了IκBε降解速率,从而抑制了NF-κB二聚入核,抑制了肿瘤细胞的增殖与迁移,促进了细胞凋亡。除此以外,大量实验证据表明了NF-κB信号在肿瘤治疗中的应用潜力。RIVERA-REYES等[46]发现YAP1增强了肉瘤中NF-κB依赖和独立的时钟介导的未折叠蛋白反应和自噬效应并且其相关基因可以作为潜在的治疗效果和分化的生物标志物,LIU等[47]发现野生型p53可抑制NF-κB诱导的MMP-9启动子激活进而降低软组织肉瘤的侵袭力,JACOBS等[48]发现半合成类黄酮单氢叶酸通过抑制NF-κB使软组织肉瘤细胞对阿霉素诱导的凋亡敏感,LI等[49]发现人参皂苷Rh2通过调节NF-κB信号通路抑制骨肉瘤细胞的增殖和迁移,诱导细胞凋亡。虽然尚未发现PA28γ与这些肉瘤之间的直接联系,但是PA28γ可通过特异性降解IκBε调节NF-κB活性,因此以NF-κB信号通路为切入点进行相关研究。除此以外,蛋白酶体抑制剂也可用于治疗部分肉瘤,如JEITANY等[50]发现脂肪肉瘤对蛋白酶体抑制很敏感,因此卡菲佐米等抑制剂可作为潜在的脂肪肉瘤治疗策略。
PA28γ参与Wnt/β-catenin通路在非上皮来源肿瘤中的调节,如CHEN等[46]发现PA28γ通过参与降解GSK-3β调节Wnt/β-catenin信号通路加速了黑色素瘤的形成,但目前相关研究仍然十分有限。由于PA28γ可通过调节Wnt/β-catenin信号通路进而调节肿瘤细胞增殖、迁移能力,因此以Wnt/β-catenin为切入点进行相关研究。如CHEN等[51]发现Wnt/βcatenin信号的异常激活推动了骨肉瘤细胞的增殖。PEREIRA等[52]发现Wnt/β-catenin通路在牙骨质骨化纤维瘤中被解除调节,JILONG等[53]发现在韧带样型纤维瘤病中存在APC和β-catenin的基因突变,使Wnt信号通路异常从而导致细胞的异常增殖和凋亡,或许是硬纤维瘤发生发展的重要因素之一。以上发现均可从PA28γ与Wnt/β-catenin的角度出发进行蛋白酶体相关研究。
Bcl-xl与Bcl-2是目前治疗淋巴瘤的重要抑制靶点[54]。在内源性研究方面,SUN等[55]开发了新型Bcl-2/Bcl-xl双抑制剂通过内源途径诱导了淋巴瘤细胞凋亡,PAWLAK等[56]发现反式β-芳基-δ-碘-γ-内酯通过下调Bcl-xl和Bcl-2诱导犬淋巴瘤细胞凋亡并致力于将其开发为具有抗肿瘤活性的靶向药物。在外源性研究方面,VARDAKI等[57]发现在血液恶性肿瘤细胞摄取基质外泌体时,Bcl-xl的Caspase-3依赖性裂解是必需的,即需要Caspase-3在外泌体中将Bcl-xl切割定位至膜上后受体细胞才能识别并摄入外泌体的内容物。在前文提到的对多发性骨髓瘤的研究中,LIU等[44]还在信号下游发现shRNA-PA28γ-1/shRNA-PA28γ-2可显著抑制Bcl-xl表达,提示PA28γ与淋巴瘤之间通过Bcl-xl建立起潜在联系。
除多发性骨髓瘤、淋巴瘤及肉瘤等目前PA28γ相关研究成果较多的非上皮来源肿瘤外,成人T细胞白血病(adult T-cell leukemia,ATL)也存在PA28γ靶点治疗的可能性。ATL是一种与人嗜T-淋巴病毒1型(HTLV-1)感染相关的侵袭性T淋巴细胞肿瘤[58],而KO等[59]发现PA28γ可以作为HTLV-1 p30的共阻遏物以抑制病毒复制进而维持潜伏期。这一结果表明PA28γ间接影响了ATL的发病进程,为ATL的治疗提供了新思路。
2.2.3 PA28γ与其他肿瘤 PA28γ不仅在上述提及的肿瘤中高表达,还在黑色素瘤、非小细胞肺癌等癌症中发挥着促癌作用。CHEN等[45]发现黑色素瘤中的PA28γ表达水平显著高于正常组织,而PA28γ的过量表达可促进黑色素瘤细胞中糖原合成酶激酶-3(GSK-3β)降解和激活Wnt/β-catenin通路,进而增强黑色素瘤细胞的增殖、迁移和侵袭能力,加速黑色素瘤的生成。在非小细胞肺癌中,miRNA-7可通过下调PA28γ表达抑制细胞周期蛋白D1表达,进而诱导非小细胞肺癌细胞的生长停滞,抑制非小细胞癌的发生发展[13]。
2.2.4 PA28γ调控肿瘤生物学行为可能的机制关于PA28γ影响癌症进展的机制,有报道显示PA28γ可促进20S蛋白酶体以ATP和泛素独立的方式降解类固醇受体辅助活化因子-3(steroid receptor coactivator-3,SRC-3)蛋白和细胞周期蛋白依赖性激酶抑制剂p21[6,21,60]。SRC-3是一种在乳腺癌中被扩增的癌基因,在细胞生长中起重要作用;细胞周期依赖性激酶抑制剂p21是阻止G1/S转换的重要调节因子[5]。除了促进20S蛋白酶体降解这两者之外,PA28γ还有很多效应通道。WANG等[61]发现PA28γ可通过降解大肿瘤抑制激酶1(large tumor suppressor kinase 1,Lats1)从而激活Hippo信号通路的主要效应因子YAP,最终促进小鼠结肠炎相关大肠癌细胞增殖;PA28γ还可与NF-κB形成正反馈环路,推动结肠炎及其相关结肠癌的发展[2]。GUO等[38]发现PA28γ能抑制c-Myc蛋白降解从而促进糖酵解,在胰腺癌中发挥致癌作用。PA28γ能降解糖原合成酶激酶3β (glycogen synthetase kinase, GSK-3β),激活Wnt/β-catenin信号通路,对皮肤癌的发生起着重要作用,敲除PA28γ能在G1期抑制黑色素瘤细胞生长[45,62]。PA28γ被证实通过泛素-蛋白酶体途径间接调节ERα的降解,促进乳腺癌的进展[23]。
对于PA28γ独立于蛋白酶体的功能也有报道。例如,抑癌蛋白p53是一种重要的转录因子,通过激活bax、p21和gadd45等靶基因在细胞周期阻滞和凋亡中起着重要作用[63];PA28γ可促进泛素连接酶Mdm2与p53互相作用,使p53降解,从而解除p53对肿瘤的抑制作用[62,64];同时PA28γ通过促进p53的多次单倍基化以及随后的核输出和降解来调节p53的细胞分布,抑制p53四聚体化从而进一步增强p53的细胞质定位,降低p53在细胞核中的活性,PA28γ介导的p53失活是参与癌症进展的机制之一[65]。p53水平降低使细胞在细胞周期进程中能够通过G1/S检查点。其他研究表明,PA28γ可能在有丝分裂过程中的染色体稳定性以及核斑点的组织中起关键作用[66-67]。
2.3 PA28γ在病毒感染过程中的作用 新型冠状病毒肺炎由SARS-CoV-2病毒引起,而核衣壳蛋白(该病毒结构蛋白中占比最大的一类蛋白)在其RNA的形成中起着重要作用[68]。ZHANG等[69]通过免疫共沉淀、体外降解、基因敲除等一系列实验首次报道了PA28γ通过激活20S核心蛋白酶体水解新型冠状病毒核衣壳蛋白,以此调节其细胞内丰度。对于其他病毒而言,PA28γ也扮演着类似的角色。CHA等[12,70]所在研究团队针对HBx(乙型肝炎病毒X蛋白)与PA28γ的关系进行了研究,发现HBx蛋白通过上调p53水平激活人肝细胞PA28γ表达,以及通过PA28γ介导的蛋白酶体降解下调p16水平,从而刺激细胞生长。JEONG等[71]发现含有Ser-101的HBx天然变异体可诱导激活人肝癌细胞中依赖p53的PA28γ表达来避免泛素依赖的蛋白酶体降解,而PA28γ水平升高通过抑制E3泛素连接酶Sial-1依赖型的蛋白酶体降解而上调HBx水平,这两个现象为HBx变异体刺激乙型肝炎病毒复制提供了证据。KWAK等[72]发现丙型肝炎病毒核心蛋白通过p53和PA28γ负反馈环调节自身蛋白水平,控制p53阳性肝细胞中丙型肝炎病毒的复制,从而帮助丙型肝炎病毒逃避免疫应答,建立慢性感染。另有研究表明,虽然丙型肝炎病毒核心蛋白N端1-71(Core71)片段与PA28γ之间的相互作用能促进PA28γ-20S蛋白酶体复合物的形成,但20S蛋白酶体也会被Core71吸附导致其活性显著降低,且呈剂量依赖关系。两者效果综合,即在PA28γ存在的情况下N端丙型肝炎病毒核心蛋白片段降低了20S蛋白酶体的活性。除新冠病毒、乙型与丙型肝炎病毒以外,PA28γ也与多种病毒存在联系,比如能通过促进p53降解来增强柯萨奇病毒感染;与HTLV-1(人类T淋巴细胞病毒1型)编码的一种核定位蛋白P30相互作用并调节共济失调毛细血管扩张突变以促进细胞存活;作为HTLV-1的复制辅阻遏子控制病毒潜伏时间等。综上所述,PA28γ在多种病毒的细胞入侵活动中发挥着降解或与关键蛋白相互作用进而促进感染进程的作用[59,74]。
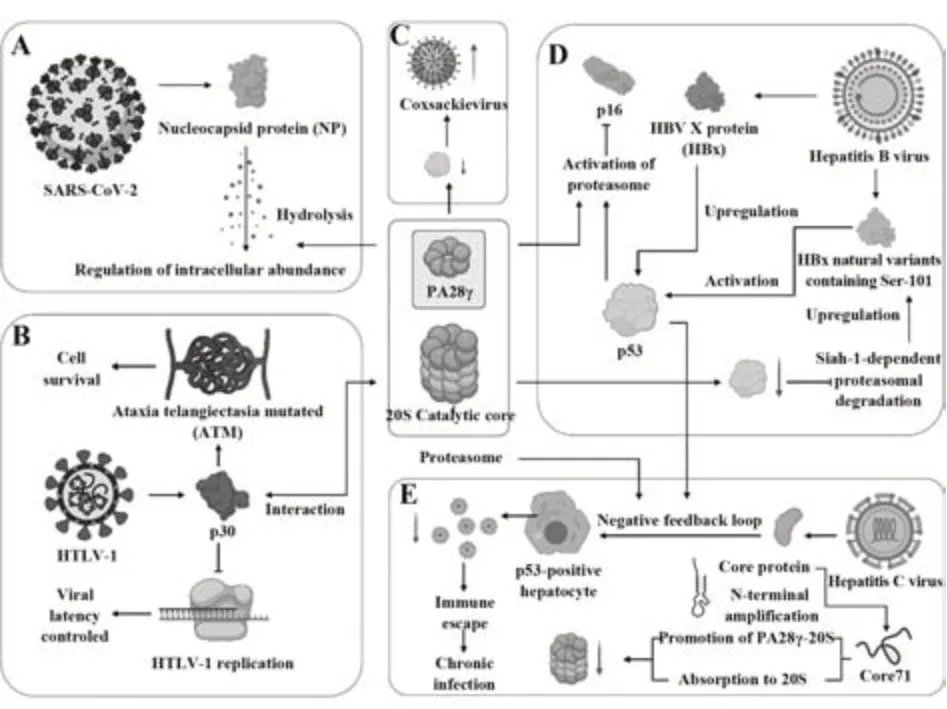
图3 PA28γ在多种病毒的感染中的作用机制(素材引用网站https://biorender.com/)Fig.3 Mechanisms of PA28γ in infection of multiple viruses (https://biorender.com/)
3 PA28γ在其他疾病中的作用
PA28γ通过与20S蛋白酶体结合促进肽链和非泛素化蛋白的水解,参与多种病理过程。近年来,PA28γ在不同疾病中的作用及其分子机制逐渐被阐明。研究发现,8月龄以上的PA28γ缺乏小鼠表现出了迟发性感动运动控制和认知缺失;进一步研究发现PA28γ缺失可导致小鼠体内GSK3β水平显著升高,抑制了PA28γ缺陷小鼠的PPI表型从而降低小鼠的工作记忆[75]。PA28γ在生物体的衰老过程中也发挥重要作用:PA28γ缺失可通过CK1δ-Mdm2-p53信号通路促进机体早衰[76]。此外,PA28γ可以通过调控自噬和代谢的去乙酰化酶SirT1水平的升高,阻止脂肪变的发生,从而避免了高脂饮食诱导的肝脂肪病变[77]。心肌肥厚是对各种生理或病理刺激的代偿性反应。然而,持续的肥厚反应可能最终导致心力衰竭、心律失常和猝死[78]。研究发现免疫炎症反应导致的心肌纤维化是造成心力衰竭的重要原因。前文提及PA28γ可能会影响炎症细胞因子的产生和释放等,炎症细胞因子可介导多种免疫反应,影响心肌细胞的收缩功能,诱导心肌纤维化,导致心力衰竭[79]。蛋白酶体活性的下调已被证明可以阻止甚至逆转心脏肥厚[80]。有学者使用大鼠心肌梗死模型后发现在梗死区,PA28γ表达显著增加。其次,已确定的PA28γ底物包括SRC-3、p21和p53,被证明在心脏病的发病机制中发挥作用[81-82]。这些发现均表明PA28γ与蛋白酶体在心脏重塑中的关键作用。
4 PA28γ在免疫相关疾病中的应用潜力
PA28γ与免疫相关疾病的发生、发展、预后等方面存在一定的联系,在作为早期诊断的生物标志物、疾病治疗靶点等方面具有巨大潜力,同时与疾病的预后密切相关。
PA28γ作为一种生物志记物,在早期诊断方面具有很大的潜力。PA28γ在乳腺癌、口腔鳞癌、类风湿关节炎等自身免疫病、多种炎症与病毒感染中均被观察到表达水平升高[12,23,29-30,71,83-85]。临床上可将PA28γ的异常表达水平作为诊断相关疾病的一个新指标。但在临床使用之前,仍需对PA28γ的准确性、稳定性等临床表现进行综合考量。
目前,已有大量研究证明PA28γ可调节多条与包括口腔鳞癌、肾细胞癌、胰腺癌、黑色素瘤在内的多种肿瘤活动密切相关的信号通路,提示PA28γ可成为临床上治疗多种肿瘤的新靶点,针对PA28γ的相关药物可通过影响相关信号通路干预肿瘤的发生发展[3,15,37,45,62]。YAO等[86]证明PA28γ可作为免疫蛋白酶体和自身免疫病的抑制剂同时在多种病毒的细胞入侵活动中发挥着降解或与关键蛋白相互作用进而促进感染进程的作用,因此PA28γ靶点药物也具有治疗自身免疫病和病毒性感染疾病的应用潜力。目前在除病毒以外的微生物感染中,尚未发现PA28γ参与的明显证据。但是近来在人类金黄色葡萄球菌感染中,YAN等[87]发现siRNA介导的Dusp3和Psme3基因敲除通过增强NF-κB信号活性诱导金黄色葡萄球菌攻击的RAW264.7巨噬细胞和骨髓源性巨噬细胞因子产生显著增加,从NF-κB信号通路出发寻找PA28γ与人类金黄色葡萄球菌感染疾病之间的关系能为该病的临床治疗提供新思路。
PA28γ被发现在恶性肿瘤中高表达,且与预后不良密切相关。YIN等[41]借助生物信息学分析建立Cox模型对OSCC的预后进行分析,表明U2AF1或PA28γ的表达水平对口腔鳞癌预后有一定的预测作用,两者联合应用可显著提高预测的准确性。大量文献也表明乳腺癌、肝细胞癌、子宫内膜癌、肺癌、甲状腺癌、结直肠癌等多种癌症的癌细胞和组织存在PA28γ表达过高的现象,且往往预后较差[23,35-36,38,76]。此外,YAMANAKA等[83]建立了重组PA28γ抗原检测抗PA28γ抗体的ELISA,发现SLE女性患者的抗PA28γ抗体滴度在心包炎和胸膜炎发作之前升高。因此,应用重组PA28γ抗原进行ELISA检测对SLE的病情发展评估有一定价值。此外,GRUNER等[84]在采用阿巴西普(一种T细胞抑制剂)治疗的类风湿关节炎患者中发现PA28γ血清水平与疾病活动相关,具有潜在的预后价值。
5 总结与展望
PA28γ作为一种蛋白酶体激活因子,可以通过调节重要功能蛋白降解的方式参与不同疾病的生理和病理过程,可能在癌症、炎症、病毒性疾病和神经退行性疾病等多种病理发展过程相关。随着研究的深入,研究人员发现PA28γ降解靶蛋白,激活Wnt、YAP和NF-κB等信号通路促进了炎症、肿瘤、病毒性疾病在机体的发生发展,提示PA28γ在免疫相关疾病的发生发展中发挥重要作用,有望为人类免疫相关疾病的治疗和诊断提供新的思路和治疗靶点。目前研究已经表明PA28γ作为人类免疫相关疾病的诊断标志物和治疗表达具有很大潜力,但尚无有效的临床应用研究。同时该领域还存在一些问题亟待解决,例如PA28γ目前还没有翻译后经修饰的商业化特异性抗体,比如磷酸化抗体和乙酰化抗体等。此外PA28γ如何特异性识别其靶蛋白,以及其在免疫相关疾病中是否发挥一定作用仍存疑。

