艾蒿花粉诱导小鼠过敏性哮喘及其内在型研究
周玲慧 李林梅 谢焕城 宋仕杰 何颖 陶爱林
(广州医科大学附属第二医院,广东省过敏反应与免疫重点实验室,呼吸疾病国家重点实验室,广州 510260)
哮喘是一种慢性炎症性气道疾病,主要特征为气道高反应性、可逆性气流阻塞和气道重塑[1]。大规模哮喘相关流行病学结果表明我国有4 500万以上成人患有哮喘,其中过敏性哮喘占比较高,但诊断率和治愈率均极低[2]。
艾蒿是一种菊科植物,生长于欧洲北部和中部、美国以及亚洲很多地区。作为亚洲最常见的吸入性过敏原之一,艾蒿也是我国引起季节性过敏性哮喘重要的花粉过敏原[3-4]。一项横断面研究表明,中国约28.6%呼吸系统过敏患者对蒿类花粉敏感,而这一数值在中国北方更高(>50%)[5]。但其临床重视程度与桦树和草花粉相比非常有限[3]。因此,需要建立实验动物模型深入研究其致病机制,挖掘新的治疗靶点和方案。目前研究者已构建了对艾蒿花粉过敏的豚鼠过敏反应模型[6]。相较于豚鼠,小鼠具有操作简便、资源丰富、可在体内准确评估气流阻塞和高反应性等优点,是研究过敏性气道炎症简单生理过程的理想模式生物[7]。本研究拟采用艾蒿花粉粗提物(mugwort pollen extract,MPE)腹腔致敏和滴鼻激发的方式诱导小鼠过敏性哮喘模型,为进一步研究艾蒿花粉过敏性哮喘的发病机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级野生型雌性BALB/c品系小鼠,6~8周龄,体质量(20±2) g,购自广东药康实验动物有限公司。所有动物均在广州医科大学动物研究委员会批准规程下进行(批号:A2020-009)。
1.1.2 主要试剂与仪器 MPE(英国Stallergenes Greer);乙酰甲胆碱(美国Sigma);氢氧化铝佐剂、BCA Protein Assay Kit、小鼠总IgE、IFN-γ、IL-4、IL-5、IL-13、IL-17A ELISA试剂盒(美国Thermo Fisher Scientific);小鼠IgE、IgG1、IgG2a抗体(英国Abcam);小鼠CD45、CD11b、CD11c、Siglec-F、Ly6G流式抗体(美国BD);小动物全身体积描记检测系统(美国Bμxco®FinePointeTM);多功能酶标仪(美国Thermo Fisher Scientific);BD Verse流式细胞仪(美国BD);样品冷冻研磨仪(中国露卡测序仪器有限公司)。
1.2 方法
1.2.1 动物分组与模型构建 所有小鼠检疫1周后随机分为3组:PBS致敏PBS激发组(P-P组,n=5)、MPE致敏PBS激发组(M-P组,n=5)、MPE致敏MPE激发组(M-M组,n=6)。第0、7、14天,小鼠按照分组分别接受200 μl PBS或等体积含300 μg MPE与Al(OH)3的混悬液进行腹腔致敏,第21~25天用30 μl PBS或等体积含300 μg MPE的溶液进行滴鼻激发。第26天进行小动物气道阻力检测。
1.2.2 小动物气道阻力检测 采用小动物全身体积描记检测系统评估气道反应性。检测前用PBS配制系列梯度乙酰甲胆碱溶液(0、3.125、6.25、12.5、25、50 mg/ml)。按仪器操作规程清洁雾化头和雾化室,连接仪器后用去离子水进行基线校准。将小鼠放入雾化室后先适应1 min,以乙酰甲胆碱溶液浓度从低到高检测,程序为雾化1 min、记录3 min、恢复1 min,记录呼吸间歇收缩指数(Penh)。
1.2.3 小鼠BALF计数和分类计数 将麻醉并采血的小鼠固定于操作台,暴露气管,留置针行气管插管,医用缝合线固定。1 ml注射器抽取800 μl预冷含2%胎牛血清的PBS(2%FBS)缓慢匀速灌洗双肺2次,每次来回抽吸3次。将BALF收集于1.5 ml EP管,500 g、4 ℃离心5 min,细胞沉淀用1 ml 2%FBS重悬,取10 μl用牛鲍计数板在显微镜下进行细胞计数。
1.2.4 流式细胞术分析BALF中炎症细胞分类及数量 收集BALF,500 g、4 ℃离心5 min后进行流式染色,流式抗体4 ℃避光染色30 min。染色完毕后加入1 ml PBS洗涤1次,200 μl 2%FBS重悬细胞上机检测。FlowJo软件进行数据分析。
1.2.5 肺组织匀浆中细胞因子检测 提前预冷组织匀浆仪至-65 ℃,小鼠肺组织中加入1 ml含蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解液,70 Hz匀浆30 s,重复2次。冰上静置30 min,12 000 g、4 ℃离心10 min,上清为肺组织匀浆,BCA法测量肺组织裂解液蛋白含量。ELISA检测肺组织匀浆中IFN-γ、IL-4、IL-5、IL-13、IL-17A水平,按说明书操作。肺组织匀浆中细胞因子水平均用蛋白含量归一化。
1.2.6 血清中各类免疫球蛋白和细胞因子检测异氟烷麻醉小鼠,眼球采血,收集血液于1.5 ml EP管。全血室温静置3 h,3 000 g、4 ℃离心20 min,收集上清。ELISA检测血清总IgE,按试剂盒说明书操作。MPE特异性IgE、IgG1、IgG2a用自包被板法进行检测,具体步骤参考文献[8]。血清中细胞因子检测同1.2.5。
1.2.7 小鼠肺组织病理切片检查 获取BALF后迅速取出左肺浸泡于4%多聚甲醛进行固定,脱水、包埋、切片、展片、捞片,进行HE染色、PAS染色、Masson染色、α-SMA免疫组化染色。HE染色评分标准为0分:小鼠肺组织气道周围无炎症细胞浸润;1分:小鼠肺组织气道周围偶见炎症细胞浸润;2分:小鼠肺组织气道周围可见单层炎症细胞浸润;3分:小鼠肺组织气道周围可见双层炎症细胞浸润;4分:小鼠肺组织气道周围可见多层炎症细胞浸润。用PAS染色阳性细胞占上皮细胞总数百分比对病理变化进行量化,0分:无阳性细胞;1分:<25%;2分:25%~50%;3分:51%~75%;4分:>75%。Masson染色评分标准:Image J软件计算胶原纤维蓝色着染面积。α-SMA染色评分标准:Image J软件统计多个位置气道平滑肌厚度。
1.3 统计学处理 采用GraphPad prism 9.0软件进行统计学分析,均以表示。数据采用两样本t检验进行分析,P<0.05为差异有统计学意义。
2 结果
2.1 MPE诱导气道高反应性 气道高反应性是哮喘主要特征之一。MPE第5次滴鼻激发24 h后,用系列梯度浓度乙酰甲胆碱激发,无创肺功能仪记录小鼠Penh评估气道反应性,从3.125 mg/ml开始,M-M造模组气道反应性均显著高于M-P组(P<0.001,图1)。

图1 MPE构建过敏性哮喘模型Fig.1 Generation of allergic asthma mouse model by MPE
2.2 MPE诱导肺组织病理学改变 HE染色评判肺部整体病理学改变(图2),M-M组小鼠肺组织支气管和血管周围均出现明显炎症细胞浸润,P-P组和M-P组无明显病理改变。气道周围炎症半定量评分差异显著(P<0.001),提示MPE哮喘模型组小鼠肺组织发生明显炎症改变。
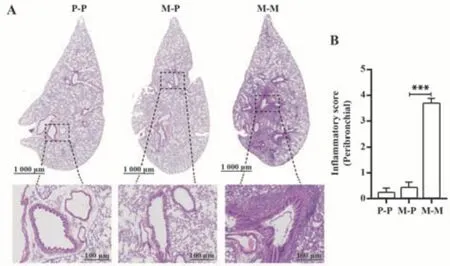
图2 MPE致敏激发加重小鼠肺组织炎症浸润Fig.2 Enhanced effect of MPE on inflammatory cell infiltration in lung tissues of mice
2.3 MPE诱导小鼠发生气道重塑 PAS染色评估杯状细胞化生,M-M组小鼠肺组织切片PAS染色结果评分显著升高。Masson染色显示M-M组肺组织胶原沉积水平显著上升。α-SMA免疫组化结果显示,M-M组肺组织支气管平滑肌明显增厚(图3)。提示MPE通过肺部支气管杯状细胞化生、气道平滑肌增厚及胶原纤维沉积导致支气管壁变硬和收缩,引起过敏性哮喘的发生发展。

图3 MPE致敏激发导致杯状上皮细胞化生增多、气道平滑肌增厚及胶原纤维沉积(100 μm)Fig.3 Enhanced effect of MPE on obvious goblet metaplasia, thickening of airway smooth muscles, and dramatical fibrin deposition around airway (100 μm)
2.4 MPE诱导小鼠血清总IgE及MPE特异性IgE、IgG1、IgG2a水平升高 IgE是过敏性疾病发展的关键因素,可促进肥大细胞中炎症介质组胺、前列腺素和细胞因子产生。检测模型中MPE特异性抗体水平,包括IgE(图4),MPE激发后,小鼠血清总IgE和MPE特异性IgE水平显著高于两个对照组,MPE特异性IgG1和IgG2a水平也显著提高。表明MPE可诱导小鼠产生IgE介导的过敏性哮喘。
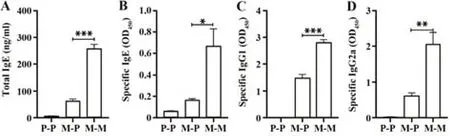
图4 MPE促进小鼠血清抗体水平升高Fig.4 MPE increases levels of serum immunoglobulin of mice
2.5 MPE哮喘小鼠BALF中嗜酸性粒细胞比例明显升高 过敏性哮喘涉及多种炎症细胞浸润,嗜酸性粒细胞和中性粒细胞是过敏性哮喘中重要的效应细胞[9]。流式细胞术分析BALF细胞中嗜酸性粒细胞和中性粒细胞,圈门分析策略如图5A。M-M组BALF细胞总数明显上升(P<0.001),CD45+细胞数增多(P<0.001),嗜酸性粒细胞比例显著升高(P<0.001),但中性粒细胞比例无明显变化(图5B~E),说明MPE诱发以嗜酸性粒细胞浸润为主的过敏性哮喘。

图5 M-M组小鼠BALF中嗜酸性粒细胞浸润为主Fig.5 Eosinophil infiltration dominant in BALF of mice in M-M group
2.6 MPE可诱导产生2型和17型细胞因子 ELISA检测肺组织匀浆和血清细胞因子表达,发现肺组织匀浆和血清2型、17型细胞因子均有增加,其中肺组织匀浆中IL-5和血清中IL-4均有升高趋势,但差异无统计学意义(P>0.05,图6)。
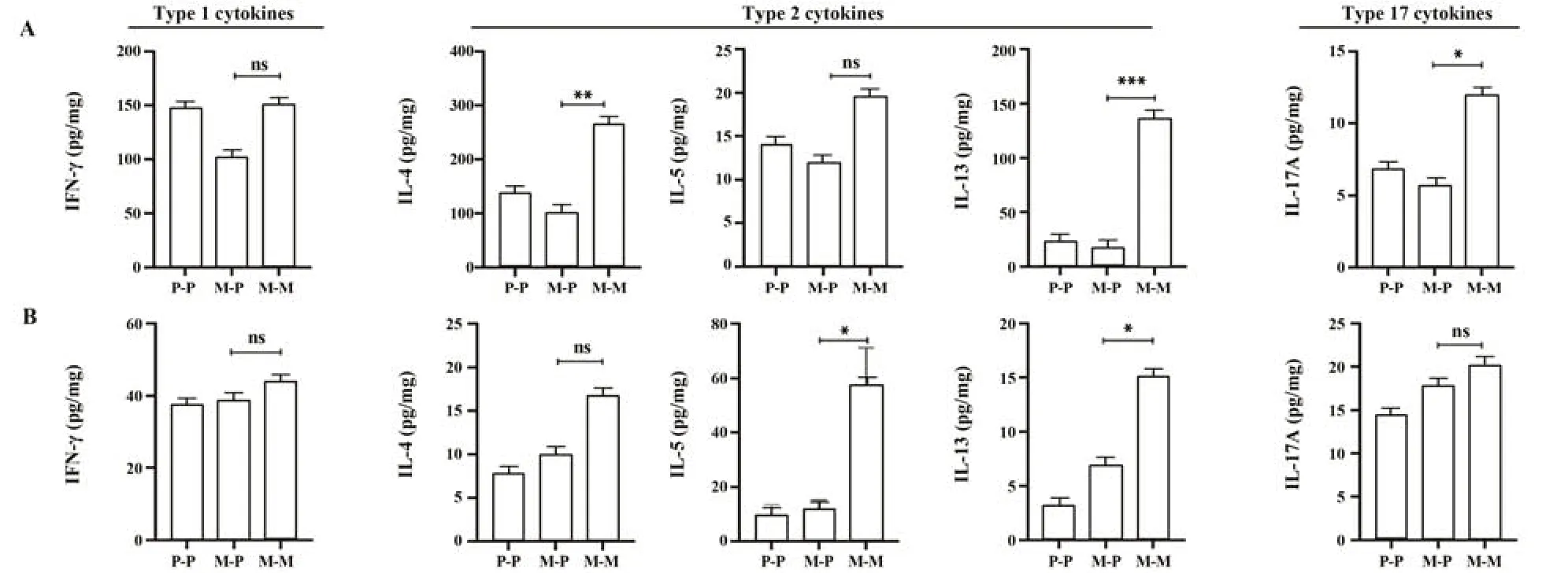
图6 小鼠肺组织匀浆和血清中细胞因子水平Fig.6 Cytokine levels in lung tissue homogenization and serum of mice
3 讨论
艾蒿是中国常见的吸入性过敏原之一。本研究显示,MPE致敏和激发后,M-M组出现气道高反应性、炎症细胞浸润增多、气道重塑等过敏性哮喘症状,包括杯状细胞化生、气道平滑肌细胞增殖及上皮下大量胶原蛋白沉积等。过敏性哮喘根据炎症表型可分为4种:嗜酸性粒细胞型、中性粒细胞型、寡粒细胞型、混合粒细胞型[10]。本研究中BALF流式结果显示,M-M组肺组织浸润炎症细胞主要由嗜酸性粒细胞组成。因此,MPE诱导以嗜酸性粒细胞浸润主的过敏性哮喘。
研究发现,艾蒿花粉过敏哮喘患者在花粉季节时,外周血ILC2细胞增多[11]。ILC2不仅通过产生IL-5、IL-9、IL-13直接影响嗜酸性粒细胞数量、杯状细胞化生和支气管高反应性,还允许树突状细胞重新刺激记忆性Th2细胞反应[12]。本研究进一步探讨了MPE诱导哮喘表型的作用机制,流式结果显示,M-M组BALF细胞分类以嗜酸性粒细胞升高为主。嗜酸性粒细胞是一种参与多种炎症反应的粒细胞,常在抗寄生虫感染和2型炎症中发挥作用[13]。ELISA显示肺组织匀浆中,M-M组细胞因子IL-4、IL-13及IL-17A水平较两个对照组明显升高。血清中M-M组细胞因子IL-5、IL-13水平也升高。IL-4和IL-13通路激活可促进气道高反应性[14]。过敏性哮喘气道重塑中,IL-13诱导杯状细胞化生、黏液分泌过多、支气管成纤维细胞、肌成纤维细胞和气道平滑肌细胞增殖,而IL-4可促进上皮下细胞胶原纤维产生和纤维连接蛋白合成,并促进重症哮喘患者长期气道重塑[15]。IL-4还是驱动B细胞合成IgE和IgG1的主要细胞因子,促进黏附分子(细胞间黏附分子ICAM-1和血管细胞黏附分子VCAM-1)表达,使嗜酸性粒细胞向气道炎症部位浸润[12]。各种过敏性疾病中,循环血液中的嗜酸性粒细胞一般处于静息状态,被趋化至目的地才会脱颗粒。IL-5是嗜酸性粒细胞分化、激活和存活的关键诱导因子,对嗜酸性粒细胞凋亡有抑制作用且有助于哮喘气道内嗜酸性粒细胞招募[16]。哮喘患者气道中的IL-17A通过上调集落刺激因子3和趋化因子配体促进气道中性粒细胞增多,介导气道高反应性和皮质类固醇耐药[17]。研究表明,IL-17A和IL-17F通过从支气管上皮细胞释放CXC趋化因子将嗜中性粒细胞募集至气道,肺部IL-17A和IL-17F水平升高与疾病严重程度直接相关[18]。本研究中,M-M组肺组织匀浆IL-17A水平升高,但BALF中的中性粒细胞增加不明显,可能因为并未检测到BALF中IL-17A表达。有研究者在小鼠和人类肺中发现嗜酸性粒细胞还可以独特方式,如细胞外诱捕网,参与嗜酸性粒细胞相关疾病发病机制[19]。细胞外诱捕网细胞死亡(extracellular trap cell death,Etosis)是不同于凋亡和坏死的细胞死亡机制,是一种由DNA、组蛋白和颗粒蛋白组成的三维网状结构[20]。哮喘中常见的Etosis包括中性粒细胞胞外诱捕网(neutrophil extracellular traps,NETs)和嗜酸性粒细胞胞外诱捕网(eosinophil extracellular traps,EETs)[21]。研究发现EETs可能通过激活气道上皮和ILC2细胞在嗜酸性粒细胞型哮喘发生发展中发挥关键作用[22]。EETs也被证实与杯状细胞化生、黏液产生、炎症细胞浸润和2型细胞因子表达密切相关,还可通过神经免疫信号驱动哮喘发展[23]。因此,Etosis在MPE诱导的过敏性哮喘中是否起关键作用仍需进一步探究。
血液或痰中的嗜酸性粒细胞增加与频繁的哮喘发作和疾病严重程度有关。目前抗IL-5单克隆抗体已被批准用于治疗嗜酸性粒细胞型哮喘和外周嗜酸性粒细胞增多症[24]。贝那利珠单抗(Benralizumab)作为减少嗜酸性炎症的免疫调节疗法之一,可以与IL-5受体α亚基结合,但仅有不到63%哮喘患者能减少口服激素[25]。此外,度普利尤单抗(Dupilumab)是一种针对IL-4α亚基的单克隆抗体,作为IL-4和IL-13介导的信号通路的双重抑制剂,也被批准用于嗜酸性粒细胞型哮喘,但仅有41%患者症状能得到良好控制[26-27]。说明控制单一类型的炎症因子无法完全控制过敏性哮喘。
综上,本研究表明艾蒿作为常见的吸入性过敏原可成功诱导小鼠以嗜酸性粒细胞浸润为主的过敏性哮喘,但肺部浸润不同类型炎症因子,且IgE和IgG亚型水平均升高,说明单纯检测某一类型细胞因子不能全面指导临床治疗。因此,临床上要对炎症进行全面检测才能精准控制症状。而针对此类有确定诱因的过敏性哮喘,采用脱敏治疗方案才是根本处理措施。

