基于体外瘤胃发酵技术评价粗饲料对牦牛的营养价值
■ 刘乐乐 孙锋博* 格桑卓玛 商振达 罗红英 刘锁珠 谭占坤**
(1.西藏农牧学院动物科学学院,西藏高原饲料加工工程研究中心,西藏高原生态草牧业协同创新中心,西藏林芝 860000;2.西藏自治区畜牧总站,西藏拉萨 850000)
牦牛(Yak)是生活在青藏高原的特有畜种,距今4 500年前,青藏高原就建立了牦牛游牧社会,为生活在高海拔、高寒地区的人民提供了生活所需的肉、奶、皮和其他必需品[1]。牦牛具有适应高海拔生活的许多解剖和生理特征,包括较大的肺脏和心脏、较强的觅食能力、较好的环境感知能力和极佳的能量代谢能力,从而使牦牛进化出了抗低温、耐缺氧、耐粗饲等特性,并在高海拔地区的生物链中具有十分重要的作用[2-3]。
牦牛的生存环境恶劣,饲草料资源缺乏,因此高效、准确掌握常用饲料对牦牛的营养价值十分必要。传统的消化代谢试验周期长,试验条件要求高,不利于快速高效评价饲料养分的利用率。采用体外瘤胃发酵技术具有速度快、成本低、数量大等方面的特点,得到广泛应用。本试验通过体外瘤胃发酵技术,评价了4 种西藏常用粗饲料对牦牛的降解规律及发酵特性,为在牦牛的饲养过程中精准配制饲粮提供了基础数据。
1 材料与方法
1.1 饲料原料采集与制备
本试验采集的4 种粗饲料分别为青稞秸秆、小麦秸秆、燕麦秸秆、黑麦草,均采集自西藏农牧学院教学实习农场,秸秆均为作物籽实收获后刈割,晾干后采样。将样品剪短至1~2 cm,使用万能粉碎机粉碎后过1 mm 孔径筛网,制作成风干样品保存于自封袋中,用于测定饲料原料常规营养成分含量;样品粉碎后过2 mm孔径筛网,用于体外瘤胃模拟发酵试验[4]。
1.2 牦牛瘤胃液采集
试验当天清晨前往屠宰场采集所需牦牛瘤胃液,采集3~5 头成年健康、体重大致相近的公牦牛混合均匀瘤胃液3 L,试验牦牛屠宰前饲喂干草,自由饮水。采集时,先将瘤胃内容物倒入塑料盆中,使用500 mL的塑料烧杯迅速舀取,通过4 层纱布经漏斗过滤,倒入充满CO2,提前39 ℃预热好的保温瓶(3 L)中,迅速带回实验室开展试验[5]。
1.3 瘤胃缓冲溶液的配制
如表1 所示,A、B 缓冲溶液的配制依照ANKOM DAISY II 型(美国,ANKOM 公司)体外模拟培养箱附带技术材料进行,遵循现用现配的原则,根据试验需求量进行配制。A、B 缓冲溶液的配制须在瘤胃液采集前配制完成,装入2 500 mL 体外消化瓶中,试验开始前通入CO2气体,置于体外模拟培养箱中并打开旋转和加热开关,39.5 ℃维持旋转预热2 h 以上。单批试验A、B缓冲液用量比例为5∶1,牦牛瘤胃液与A、B缓冲液用量比例为1∶3。
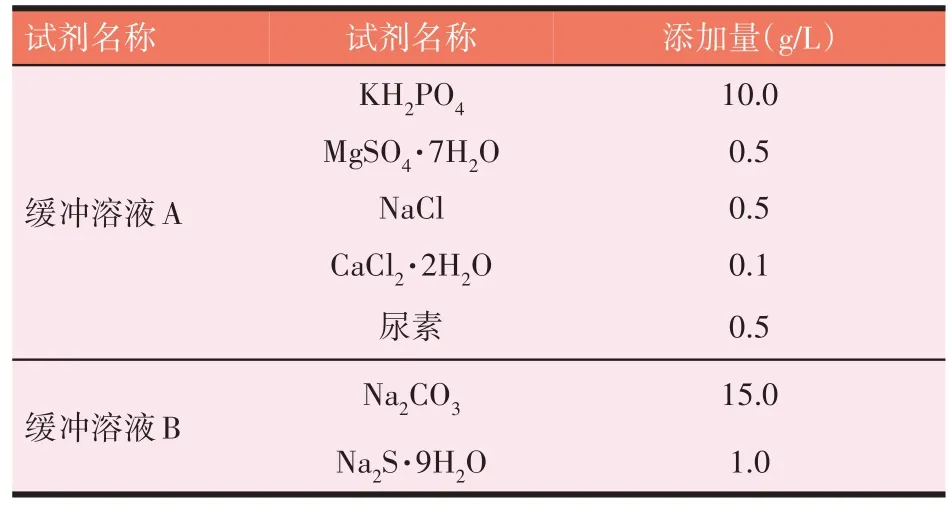
表1 缓冲溶液的配制
1.4 缓冲溶液与牦牛瘤胃液的混合
在72 h体外模拟消化试验中,使用烧杯配制A、B缓冲溶液1 200 mL,使用39 ℃预热好的量筒(1 000 mL)量取瘤胃液400 mL,两者进行充分混合后,快速加到2 500 mL体外消化瓶中开展体外模拟消化试验。
在72 h体外产气试验中,使用烧杯配制A、B缓冲溶液120 mL,39 ℃预热好的量筒(100 mL)量取瘤胃液40 mL,两者进行充分混合后,快速加到250 mL 体外产气玻璃瓶中开展体外产气试验。试验过程中体外模拟培养箱(ANKOM DAISY Ⅱ型)、A/B缓冲溶液、体外消化瓶、量筒、烧杯等试剂和仪器均维持在39 ℃。
1.5 常规营养成分测定
干物质(DM)、粗脂肪(EE)、粗灰分(Ash)、粗蛋白(CP)含量测定参考张丽英[6]《饲料分析及饲料质量检测技术》;中性洗涤纤维(NDF)及酸性洗涤纤维(ADF)的含量测定参考Van Soest 等[7]的方法,所有饲料原料常规营养水平的测定均以风干饲料为基础。
1.6 体外瘤胃降解率测定与降解速度计算
每种饲料样品4 个时间点各设置6 个重复,按照“同时投入、分批取出”的原则,将滤袋等分投入体外模拟消化瓶两侧,放入2 个空白滤袋(不加饲料样品)作为空白对照,以进行试验误差校正。当体外消化试验到达设置的4 个培养时间点,将滤袋拿出至烧杯中用清水多次洗净,可使用玻璃棒轻轻搅拌,再在丙酮中脱水5 min,平整铺开在瓷盘上,放置在通风橱中使丙酮自然挥发,105 ℃烘箱中烘干4 h 以上,干燥器中冷却30 min 进行称重测定DM、NDF、ADF 含量,按照公示(1)计算养分体外瘤胃降解速度。
体外瘤胃降解率测定指标包括:12、24、48、72 h 4 个时间点体外干物质降解率(IVDMD)、中性洗涤纤维降解率(NDFD)及酸性洗涤纤维降解率(ADFD),计算公式见公式(2)。
1.7 体外产气量(GP)测定
采用ANKOM RFS 产气测量系统(美国,ANKOM公司)对GP进行测定,配套GMS软件对累积压力进行记录。体外产气试验时间设置为72 h,每隔1 h 电脑软件自动记录1 次累计压力,试验结束后通过累计压力(Psi)与气体体积(mL)换算公式得到产气量。
在39 ℃时,将产气压力换算为体积,压力换算公式见公式(3)。
式中:Vx——39 ℃产气体积(mL);
Vj——模块瓶内液面上部空间的体积(mL),本研究中为90 mL;
P——GMS软件记录累积压力(Psi)。
1.8 瘤胃发酵特性测定
72 h 体外产气试验结束后,采集2 管50 mL 瘤胃发酵液。其中1 管立即使用pH 仪(HANNA-211 型)测定发酵液中pH,另外1 管离心(4 ℃、4 000 r/min,15 min)后取上清液分装至5 mL 离心管中,-20 ℃保存用于氨态氮(NH3-N)浓度测定(苯酚-次氯酸钠比色法);再分装至1.5 mL 离心管中,-80 ℃条件冻存用于挥发性脂肪酸的测定。测定时,解冻过0.45 μm 滤膜进棕色进样瓶,使用日立高效液相色谱仪(Agilent 1100)测定VFA,包括乙酸、丙酸、异丁酸、丁酸、戊酸、异戊酸。测定前,配制含有乙酸、丙酸、异丁酸、丁酸、戊酸、异戊酸的混合标品作为标样,稀释为5 个浓度梯度,建立标准曲线。将发酵液和偏磷酸(25%,W/V)以4∶1比例混合,加入树脂-20 ℃冷冻过夜,13 000 r/min 离心15 min 两次,过0.45 μm 滤膜,注入棕色进样瓶。测定条件为:液相色谱柱:Carbomix®H-NP5:8%(5 μm,7.8 mm×300 mm);流动 相:2.5 mmol/L H2SO4溶液,将0.135 mL 硫酸稀释至1 L超纯水;流速:0.5 mL/min;视差显示器:30 ℃;柱温:55 ℃;进样量:60 μL。
1.9 数据处理与分析
使用Excel 软件对试验原始数据进行整理,采用IBM SPSS Statistics 21.0 软件对试验数据进行单因素ANOVA 分析,使用Duncan’s 法进行多重比较,以“平均值±标准差”表示。显著性水平为0.05,若P<0.05,表示差异显著;若P>0.05,表示差异不显著。
2 结果与分析
2.1 饲料样品中常规营养成分分析
由表2 可知,青稞秸秆中性洗涤纤维、酸性洗涤纤维含量显著高于其他3 种粗饲料(P<0.05),小麦秸秆中性洗涤纤维和酸性洗涤纤维含量显著高于燕麦秸秆和黑麦草(P<0.05),黑麦草粗蛋白含量显著高于其他3种粗饲料(P<0.05)。

表2 饲料样品常规营养成分分析(风干基础,%)
2.2 IVDMD、NDFD及ADFD的测定
如表3 所示,4 个时间段,4 种粗饲料间IVDMD 均有显著性差异(P<0.05)。4个时间段,黑麦草的IVDMD均显著高于青稞秸秆、小麦秸秆和燕麦秸秆(P<0.05);秸秆类饲料中,燕麦秸秆显著高于青稞和小麦秸秆(P<0.05),青稞与小麦秸秆间IVDMD 无显著差异(P>0.05)。
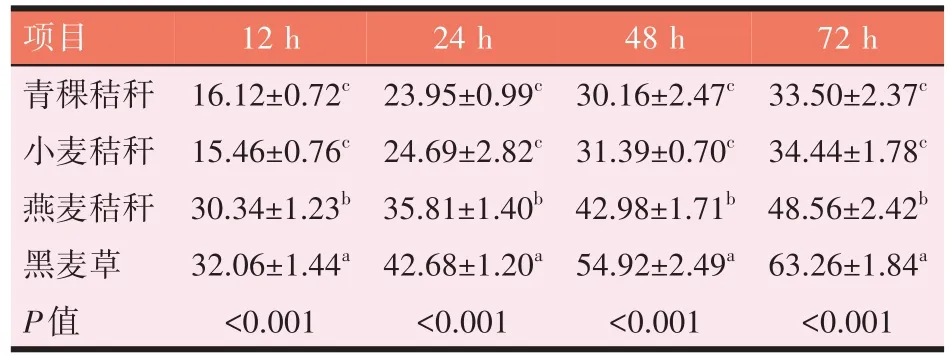
表3 IVDM的降解率(%)
如表4 所示,发酵12 h 与24 h 时,4 种粗饲料间NDFD 无显著差异(P>0.05);48 h 和72 h 时,黑麦草NDFD 显著高于秸秆类饲料(P<0.05),秸秆类粗饲料间无显著差异(P>0.05)。

表4 NDF的降解率(%)
如 表5 所 示,发 酵12 h 和24 h,4 种 粗 饲 料 间ADFD 无显著性差异(P>0.05);发酵48 h,黑麦草ADFD 显著高于秸秆类饲料(P<0.05),秸秆类饲料间无显著差异(P>0.05);发酵72 h,小麦秸秆ADFD显著低于其他3种饲料(P<0.05)。

表5 ADF的降解率(%)
2.3 DM、NDF、ADF降解速度测定
如表6 所示,4 个发酵时间段,4 种粗饲料的DM降解速度不同且有显著性差异(P<0.05),但降解速度整体规律均为由大变小。0~12 h 及25~48 h 时间段,黑麦草DM 降解速度显著高于青稞秸秆、小麦秸秆及燕麦秸秆(P<0.05)。

表6 DM的降解速度(%/h)
如表7 所示,4 个发酵时间段,4 种粗饲料的NDF降解速度不同,但降解速度的整体规律均为先升高后降低。其中,0~12 h 和49~72 h,4 种粗饲料的NDF 降解速度无显著差异(P>0.05);25~48 h,黑麦草NDF 降解速度显著高于青稞秸秆、小麦秸秆及燕麦秸秆(P<0.05)。

表7 NDF的降解速度(%/h)
如表8 所示,4 个发酵时间段,4 种粗饲料的ADF降解速度不同,但降解速度的整体规律均为先升高后降低,与NDF 降解速度规律保持一致。其中0~12 h、13~24 h 和49~72 h 三个时间段,4 种粗饲料间ADF 降解速度无显著差异(P>0.05);25~48 h,黑麦草ADF 降解速度显著高于青稞秸秆、小麦秸秆及燕麦秸秆(P<0.05)。

表8 ADF的降解速度(%/h)
2.4 体外产气量
如图1 所示,4 种粗饲料产气速率各不相同,总体规律是体外产气量随着发酵时间的延长不断增加,到达一定时间后GP 缓慢增加最终趋于稳定。0~16 h时间段,4 种粗饲料产气速率由大到小排序:燕麦秸秆>黑麦草>青稞秸秆>小麦秸秆;16~72 h时间段,产气量由大到小排序:燕麦秸秆>青稞秸秆>黑麦草>小麦秸秆;4 种粗饲料72 h 体外产气量大小排序:燕麦秸秆>青稞秸秆>黑麦草>小麦秸秆。
2.5 体外产气量与体外干物质降解率相关性
由表9 所示,以4 种粗饲料IVDMD 作为x 轴,GP作为y 轴,对两者之间的关系建立回归方程进行拟合。经拟合,4 种粗饲料IVDMD 与GP 呈高度非线性相关关系,相关性(R2)均在0.95以上。

表9 4种粗饲料体外产气量与体外干物质降解率的相关性
2.6 体外发酵pH与NH3-N的测定
如表10 所示,不同粗饲料72 h 体外发酵pH 差异显著(P<0.05),分布在6.20~6.50 范围内。其中,青稞秸秆、燕麦秸秆发酵液pH 显著低于黑麦草(P<0.05),小麦秸秆与其他3 种粗饲料间pH 无显著差异(P>0.05)。4 种粗饲料72 h 体外发酵结束NH3-N 浓度间无显著性差异(P>0.05)。
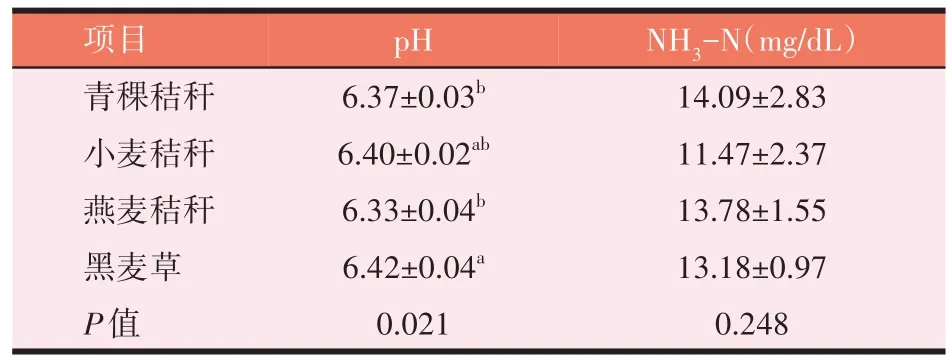
表10 4种粗饲料体外发酵结束pH及NH3-N浓度
2.7 VFA浓度测定
如表11 所示,小麦秸秆乙酸、丙酸浓度显著低于青稞秸秆、燕麦秸秆和黑麦草(P<0.05),小麦秸秆丁酸浓度显著低于青稞秸秆和燕麦秸秆(P<0.05),黑麦草乙酸/丙酸值显著低于青稞秸秆、小麦秸秆和燕麦秸秆(P<0.05);4 种粗饲料总挥发性脂肪酸间无显著差异(P>0.05)。
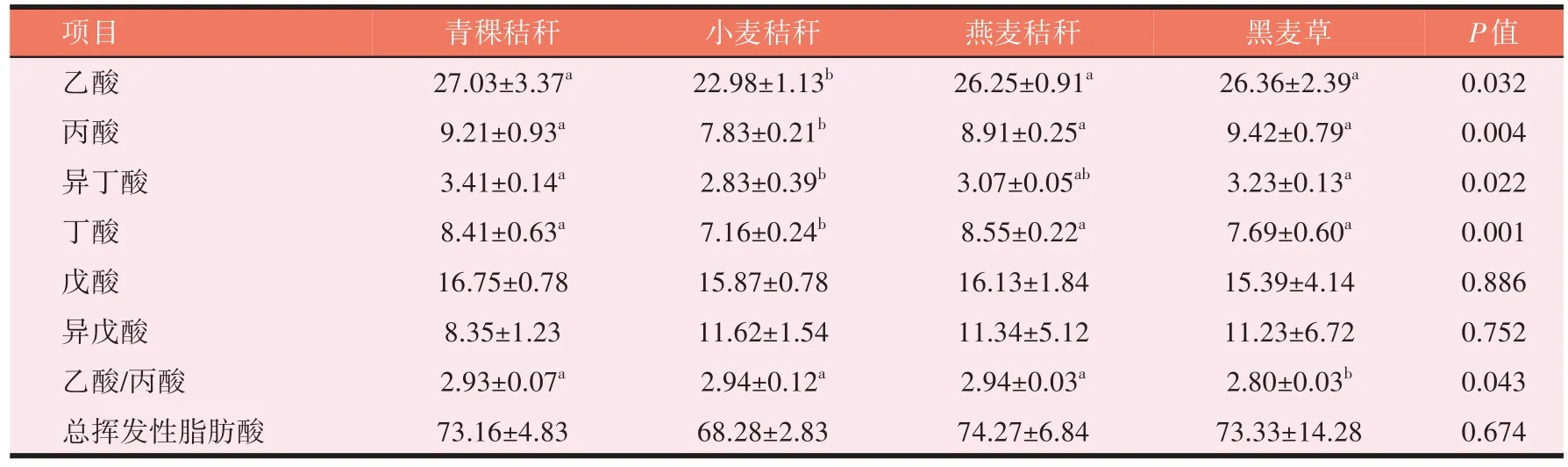
表11 4种粗饲料体外发酵VFA浓度(mg/L)
3 讨论
3.1 不同粗饲料体外瘤胃降解规律的研究
反刍动物对饲料的降解,主要依靠生活在瘤胃内的大量微生物(包括细菌、真菌、原虫等)及其所分泌纤维素酶、半纤维酶等的催化作用。瘤胃微生物对饲料营养物质降解受多种因素的影响,包括饲料表面的物理结构,瘤胃微生物附着在饲料表面的能力,瘤胃微生物本身所分泌酶的催化能力,饲料的种类、组成及营养水平等[9]。反刍动物的饲料通常是由粗料和精料共同组成的,饲料组成不同,瘤胃降解率也不同。粗饲料对促进反刍动物咀嚼、肠道蠕动及维持动物瘤胃正常生理功能起着重要作用;精饲料纤维含量较低,淀粉及碳水化合物含量较高,发酵产生的VFA 能为动物机体提供大量的能量和碳源。因此,测定不同饲料原料在反刍动物瘤胃内的降解率对合理高效地利用现有的饲料资源、节约养殖成本有重要意义。
IVDMD 是评价饲料营养价值的重要指标之一,是反映饲料DM 被瘤胃微生物降解的程度以及瘤胃微生物的活性强弱,影响反刍动物的饲料干物质采食量。IVDMD 越高,代表动物DM 采食量越高,体外瘤胃发酵效果更好。曾钰等[10]指出IVDMD 与饲料中精料占比呈正相关关系,精料占比越高,纤维含量越低,IVDMD 越高。同时,不同类型的饲料IVDMD 存在显著性差异,但总体规律均为随着体外发酵时间的延长,IVDMD 先快速增加,后缓慢增加直至趋于稳定,不同类型的饲料DM 降解速度有所不同。NDFD 和ADFD 也是评价饲料营养价值的重要指标,能够反映饲料营养物质被瘤胃微生物降解的难易程度。因饲料种类的不同,NDF 和ADF 含量差异较大,在瘤胃内被降解的程度和快慢同样差别较大[9]。相关研究表明,饲料NDF及ADF含量与瘤胃NDFD、ADFD呈负相关关系[11]。适中的NDF含量,有助于增强反刍动物肠胃蠕动,增加DM 采食量,但NDF 含量过高将会增加动物瘤胃的物理充实度,不利于动物的消化吸收,采食量也会下降[12]。此外,IVDMD 与NDFD、ADFD 之间,也存在着一定的相关性。在本试验条件下,4种秸秆类粗饲料中,黑麦草、燕麦秸秆的72 h 瘤胃IVDMD显著高于青稞秸秆及小麦秸秆,可能原因是燕麦秸秆、黑麦草NDF、ADF 含量显著低于青稞秸秆和小麦秸秆。饲料中NDF、ADF 的含量与IVDMD 呈负相关,青稞秸秆和小麦秸秆中的硅酸盐、蜡质等含量较高,不利于瘤胃微生物的附着和生长,影响饲料的IVDMD,这与宋钰等[12]的研究结果一致。4 种秸秆类粗饲料中,黑麦草、燕麦秸秆的72 h 瘤胃NDFD 和ADFD 高于青稞秸秆和小麦秸秆,这与4 种粗饲料的IVDMD 规律一致,与王丽娟等[11]、李袁飞等[13]的研究结果一致。
3.2 不同粗饲料体外产气量的研究
体外产气量(GP)是饲料在瘤胃内经瘤胃微生物厌氧发酵的重要指标,同样能够用于估测饲料的瘤胃降解率。体外产气法的原理是将饲料样品与瘤胃发酵液共同置于体外模拟产气装置中一段时间,饲料中的可降解碳水化合物发酵会产生气体,导致体外产气模拟装置内部的体积或者压力发生变化,压力传感模块装置与计算机连接,此时GP 大小及产气速度被定量,从而实现对饲料营养价值的评价。体外产气气体的主要成分有CO2、CH4及H2等,体外产气量的大小能够客观反映饲料被降解的程度及瘤胃微生物活性的强弱,饲料中可发酵有机化合物的含量越高,GP 越大,饲料瘤胃降解程度就越高,瘤胃微生物的活性也越强[9]。不同类型的饲料,最大产气量(GPmax)不同,结构性碳水化合物含量较多的饲料(如粗饲料),GPmax一般在48 h 以后出现;CP 含量和易发酵碳水化合物含量较高的饲料,GPmax一般在48 h 以内出现(如蛋白质饲料);能量饲料的GPmax在24 h 以内即可到达[13]。不同类型的饲料,GP 速率也不同,与饲料中CP 含量呈正相关关系[14]。使用单一的IVDMD 或GP 指标,均无法对饲料的瘤胃降解程度作出科学全面的评价,两者间通常需要结合起来,其相关系数R2值常被作为衡量两者相关性强弱的指标[15-16]。
体外发酵前期,GP 速度较快,48 h 以后,GP 缓慢增加直至趋于稳定,可能是因为发酵前期能够被瘤胃微生物降解的碳水化合物含量较多,瘤胃微生物活性较强,瘤胃降解作用较强,48 h 后能被降解的碳水化合物含量变得越来越少,GP 增加幅度也越来越小[13]。秸秆类饲料在瘤胃发酵过程中,产生的气体主要来自于秸秆中碳水化合物和蛋白质含碳部分的降解,GP的大小可以反映出秸秆在瘤胃内的发酵程度及秸秆降解率。本试验中,燕麦秸秆和青稞秸秆与黑麦草和小麦秸秆GP 相比较高,意味着燕麦秸秆和青稞秸秆中易被瘤胃微生物发酵利用的碳水化合物含量可能更多。此结果与4种粗饲料IVDMD大小排序不一致,可能是因为黑麦草属于快速发酵型的粗饲料,发酵延滞期短,发酵初期产气速度较快,但发酵潜力并不高,发酵后期由于瘤胃微生物能量供应不足,导致GPmax较低;青稞秸秆则属于慢速发酵型粗饲料,不易发酵的结构性碳水化合物含量较高,发酵的延滞期长,发酵初期产气速度较慢,但发酵潜力较高,发酵后期产气速度逐渐加快,GPmax超过黑麦草。4 种秸秆类粗饲料中,IVDMD 与GP 呈高度正相关关系,相关系数R2值达0.95以上,与樊庆山等[15]结论一致。
3.3 体外瘤胃发酵特性的研究
pH 是瘤胃发酵试验的重要指标之一,能够从总体、客观的角度反映瘤胃发酵整体情况,判别反刍动物瘤胃是否处于酸中毒状态。pH 的相对稳定对反刍动物机体健康和瘤胃正常发酵具有重要指示意义[17],饲粮的类型、加工方式和动物口腔唾液分泌等都能造成瘤胃液pH 浮动变化,饲料类型是主要的影响因素[18],当瘤胃内pH 发生变化时,影响瘤胃微生物对纤维类物质的消化降解和微生物蛋白(MCP)的合成[19]。有研究表明,反刍动物瘤胃液pH最适范围为6.0~7.0,pH 超过6.0 时,瘤胃微生物的生长繁殖速度较快,对纤维物质的降解作用较强;当pH 低于6.0 时,瘤胃纤维分解菌的活性会受到抑制,纤维降解能力下降,消化降解需要更长时间[20]。因此,相对稳定的pH,能够为瘤胃微生物提供一个适宜的生长环境,更加有利于对饲料原料的降解利用。4种秸秆类粗饲料体外发酵试验中,青稞秸秆的pH 低于小麦秸秆,是因为青稞秸秆的IVDMD略高,这与鲍宇红等[21]和巴桑珠扎等[22]对青稞秸秆和小麦秸秆的研究结果是一致的。
NH3-N是体外瘤胃发酵的重要指标之一,作为瘤胃发酵的中间产物,瘤胃中来自饲料的蛋白质分解代谢形成氨基酸,氨基酸脱氨基生成NH3-N,是瘤胃微生物用于合成MCP 的重要原料,瘤胃微生物利用NH3-N 合成MCP 的量占到反刍动物蛋白质需要量的一半以上[23]。NH3-N 浓度过高或过低都会对瘤胃微生物的生长繁殖不利,影响瘤胃微生物对饲料的降解及利用,因此,瘤胃微生物的生长繁殖需要适宜的NH3-N浓度[24-25]。相关研究表明,瘤胃发酵液中NH3-N 的最适浓度为6.30~27.50 mg/dL,若NH3-N 浓度过高,代表瘤胃微生物对日粮含氮物质的降解速度超过MCP 的合成速度,超出部分的NH3-N 无法被瘤胃微生物及时有效地利用,造成氮资源浪费[26];NH3-N 浓度过低,会影响到瘤胃MCP 后续的合成,只有维持在最适浓度范围内才能保证饲料中含氮物质的降解和MCP 的合成不受影响。4 种秸秆类粗饲料体外瘤胃发酵试验中,NH3-N 浓度间无显著差异,这与鲍宇红等[21]、巴桑珠扎等[22]对西藏青稞秸秆、小麦秸秆等的研究结论一致。
饲料中碳水化合物被瘤胃微生物降解会生成VFA,作为反刍动物瘤胃微生物生长所需能量的主要来源,占到70%~80%,并且是合成反刍动物体脂和乳脂的原料[27]。当饲料种类不同时,碳水化合物的含量不同,VFA 浓度及其组成也就不同,VFA 的高低反映了瘤胃微生物对碳水化合物的降解程度和瘤胃发酵程度,VFA 各酸的含量及比值是瘤胃发酵的重要指标之一[28]。瘤胃发酵过程中产生的VFA 可为瘤胃微生物营造理想的酸性环境,有利于微生物生长和繁殖,从而瘤胃微生物才能对饲料进行更加充分的降解[29]。组成VFA 的各种酸,作用各不相同。其中,乙酸参与三羧酸循环释放出ATP,作为动物机体代谢的主要能量来源,能够提高动物的体脂率,乙酸产生的通路主要有乳酸异化和异型乳酸发酵两种,饲料中纤维类物质含量越高,产生的乙酸越多,瘤胃发酵就以乙酸发酵类型为主[30];丙酸是糖异生的前体物质,在内源葡萄糖的转化和储存上发挥着重要作用,丙酸在瘤胃发酵时可有效利用H2,从而减少CH4的产生,提高能量转化效率,丙酸在反刍动物体内的利用率要高于乙酸,饲料中精料含量越高,产生的丙酸含量越高,瘤胃发酵就以丙酸发酵类型为主[31-32];丁酸可为机体的各组织器官供能,特别是在幼龄动物体内能提高肠道的蠕动性,促进消化;乙酸/丙酸(A/P)值能够反映反刍动物对能量的利用效率,也可反映瘤胃发酵类型,丙酸占比越高,A/P 值越小,能量利用效率也越高,A/P值大小一般为2.0~3.6,主要受到饲料类型、试验动物等因素的影响,A/P值降低,瘤胃微生物的活性会受到抑制,可造成饲料的瘤胃发酵与降解速率变缓[33]。本试验中,不同种秸秆类粗饲料对瘤胃发酵液中乙酸、丙酸浓度及A/P 值影响显著,表明不同种秸秆类粗饲料显著影响到瘤胃发酵。青稞秸秆的乙酸浓度最高,黑麦草的丙酸浓度最高,A/P值也最低,燕麦秸秆、黑麦草总挥发性脂肪酸(TVFA)浓度高于青稞秸秆和小麦秸秆,这可能是因为青稞秸秆与小麦秸秆中NDF、ADF含量较高导致生成的乙酸较多,黑麦草NDF、ADF含量较低生成丙酸较多,燕麦秸秆、黑麦草相比青稞秸秆、小麦秸秆非结构性碳水化合物较多导致的。黑麦草的A/P值较低,表明黑麦草体外瘤胃发酵时,能量利用效率在4种秸秆类粗饲料中更高,利用价值也较高。
4 结论
本试验通过体外瘤胃发酵技术评价了4 种西藏常见粗饲料对牦牛的降解率及发酵特性,黑麦草具有更佳的营养价值在秸秆类粗饲料中,燕麦秸秆效果较好。

