miR-3917通过调控Wnt/β-catenin信号通路抑制结肠癌细胞的增殖和迁移
吴 坤,姜 洋
(吉林大学中日联谊医院 胃肠结直肠肛门外科,吉林 长春130033)
结肠癌(Colorectal cancer,CRC)是常见的消化道恶性肿瘤,其发病率在男性和女性中分别排名第三和第二,而在年轻人中该病的发生率也在逐年递增[1]。CRC发病的分子机制尚不清楚,既往的研究发现,CRC细胞高度的增殖和迁移能力与肿瘤的发生和发展密切相关[2]。如何有效抑制这些肿瘤细胞恶性表型是治疗CRC的关键。miRNA(微小RNA)是一种单链非编码RNA,长度约为22个核苷酸[3]。研究发现miRNA在肿瘤的发生和发展中发挥重要作用,这使其成为相关诊断和治疗的指标和靶点[4]。Wnt/β-catenin信号通路与肿瘤细胞的生物学表型密切相关,该信号通路的激活促进了CRC细胞的增殖和迁移[5]。Wnt/β-catenin信号通路的激活是通过关键蛋白β-catenin在细胞核内的聚集,β-catenin可以作为转录因子启动下游基因的转录[6]。本研究旨在结合生物信息学分析和实验验证,探究miR-3917在CRC中的表达情况和生物学功能,并进一步阐明相关信号通路机制。
1 材料与方法
1.1 生物信息学分析应用GEO2R工具(https://www.ncbi.nlm.nih.gov/geo/geo2r/)对GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)中GSE101502数据集的miRNA表达数据进行比较分析[7]。该数据集中包含3例CRC组织及其癌旁正常组织。设定条件为Log2│Fold Change│>1、P<0.05的分子为差异表达miRNA,结果用火山图展示。应用UALCAN数据库(https://ualcan.path.uab.edu/)对TCGA数据库中miR-3917相关表达数据(CRC组织251例,正常组织7例)进行比较分析[8]。应用TargetScan数据库(https://www.targetscan.org/vert_72/)对miR-3917的靶基因进行预测[9]。应用DAVID数据库对预测得到的靶基因(Total context++ score>-0.1)进行基因功能的GO和KEGG富集分析[10]。火山图与富集分析结果展示图应用数据可视化工具进行绘制(https://www.bioinformatics.com.cn)。
1.2 材料人正常结肠细胞(CCD841 CoN)和人CRC细胞(HCT 116)购于北纳创联生物科技有限公司;DMEM培养基、胎牛血清、青链霉素双抗和胰酶购于Gibco公司;MiPure Cell/Tissue miRNA Kit试剂盒、miRNA 1st Strand cDNA Synthesis Kit(by stem-loop)试剂盒和miRNA Universal SYBR qPCR Master Mix试剂购于南京诺唯赞生物科技公司;miR-3917的miRNA 模拟物(miR-mimic)和相应的阴性对照序列(miR-control)、Lipofectamine 3000转染试剂购于赛默飞世尔科技(中国)有限公司;CCK-8试剂购于上海翌圣生物科技公司;4%多蒙甲醛固定液和0.5%结晶紫染色液购于北京索莱宝科技公司;Transwell小室(24孔,8 μm)购于康宁公司;Nuclear and Cytoplasmic Protein Extraction核蛋白提取试剂盒购于碧云天生物技术公司;PVDF膜和BSA购于默克生命科学技术公司;β-catenin和Histone H3蛋白一抗购于abcam公司,二抗购于Proteintech公司;ECL显影试剂购于上海天能生命科学有限公司。
1.3 细胞培养CCD841 CoN细胞和HCT 116细胞用含10%胎牛血清和1%青链霉素双抗的DMEM完全培养基于37℃、5%CO2的细胞培养箱中培养,细胞融合度达到90%后用胰酶消化法进行细胞传代。
1.4 qPCR实验qPCR实验用于检测miR-3917的表达水平。应用MiPure Cell/Tissue miRNA Kit试剂盒提取细胞样本的总miRNA。用miRNA 1st Strand cDNA Synthesis Kit(by stem-loop)试剂盒进行逆转录合成cDNA,用miRNA Universal SYBR qPCR Master Mix试剂检测miR-3917和U6的表达。qPCR实验使用的引物序列如下:miR-3917,上游5’-GCGGCTCGGACTGAGCA-3’,下游5’-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACTCCACA-3’;U6上游5’-CTCGCTTCGGCAGCACA-3’,下游5’-AACG-CTTCACGAATTTGCGT-3’。U6作为内参对照,每个样本设3个复孔。采用2-ΔΔCt法计算miR-3917的相对表达水平。
1.5 细胞转染在HCT 116细胞中转染miR-mimic以上调miR-3917的表达。根据基因序列将细胞分为miR-control组(对照组)和miR-mimic组(表达上调组)。Lipofectamine 3000转染试剂用于转染这些基因。转染后6 h更换新鲜的完全培养基,转染后24 h细胞用于后续相应实验。
1.6 CCK-8实验CCK-8实验用于检测HCT 116细胞的增殖能力。细胞接种于96孔细胞培养板中(2×103个/孔)。待细胞贴壁后,开始计时,分别于24、48、72 h时间点进行细胞活性检测,每孔加入10 μL CCK-8试剂,于细胞培养箱中37℃条件下孵育2 h后,用酶标仪检测450 nm波长处的吸光度(OD值),实验结果用OD值表示。
1.7 平板克隆形成实验平板克隆形成实验用于检测HCT 116细胞的增殖能力。细胞接种于12孔细胞培养板(150个/孔)。在细胞培养箱中培养10 d后,用4%多聚甲醛固定液常温固定20 min,用0.5%结晶紫染色液进行染色10 min,实验结果用克隆形成的数量表示。
1.8 划痕实验划痕实验用于检测HCT 116细胞的迁移能力。将细胞接种于6孔细胞培养板中(2×106个/孔)。用200 μL规格的移液管尖端在孔底造“一”字型划痕,更换无血清培养基。分别于0和24 h时间点,用倒置光学显微镜进行拍照(40×),每个孔随机选取4个视野。划痕区域用ImageJ软件(1.53e版)计算面积,实验结果用细胞迁移率表示,细胞迁移率(%)=(初始划痕面积-24 h划痕面积)/初始划痕面积×100。
1.9 Transwell迁移实验Transwell迁移实验用于检测HCT 116细胞的迁移能力。Transwell小室中接种准备好的细胞(3×104个/孔),上室加入无血清培养基,下室加入含10%血清培养基,于细胞培养箱中孵育24 h后,用无菌棉签轻柔擦去小室上面的未穿膜细胞,用4%多聚甲醛固定液常温固定20 min,用0.5%结晶紫染色液染色10 min。用倒置光学显微镜拍照(200×),每个孔随机选取4个视野,实验结果用迁移细胞的个数表示。
1.10 Western blot实验Western blot实验用于检测核内β-catenin蛋白的表达水平。细胞样品用Nuclear and Cytoplasmic Protein Extraction试剂盒提取核蛋白。蛋白样本在SDS-PAGE胶中进行电泳分离,之后应用湿转法电转至PVDF膜上。PVDF膜用5%BSA进行封闭后,先后用相应的一抗和二抗进行孵育。用ECL试剂进行显色,用ImageJ软件计算蛋白条带的灰度值,Histone H3蛋白作为内参对照。
2 结果
2.1 miR-3917在CRC中的表达比较分析GSE101502数据集中3例CRC组织和癌旁正常组织的miRNA表达数据,结果显示与正常组织相比,CRC组织中共有21个存在差异表达的miRNA(Log2│Fold Change│>1、P<0.05),其中差异上调的有2个,差异下调的有19个(图1A)。结合文献报道,选择miR-3917(Log2Fold Change=-1.827278,P<0.05)进行进一步的验证和探究。如图1B所示,来自TCGA数据库收录的样本数据的对比分析结果也显示,与正常组织相比,miR-3917在CRC组织中的表达显著下降(P<0.05)。qPCR实验结果(图1C)证明,结肠癌细胞系HCT 116中miR-3917的表达水平显著低于正常结肠细胞系CCD841 CoN(P<0.05)。为了进一步探究miR-3917在CRC中发挥的作用,本研究在HCT 116细胞中上调其表达,观察对细胞增殖和迁移的影响。如图1D所示,转染miR-mimic可以显著提高HCT 116细胞中miR-3917的表达水平(P<0.05)。
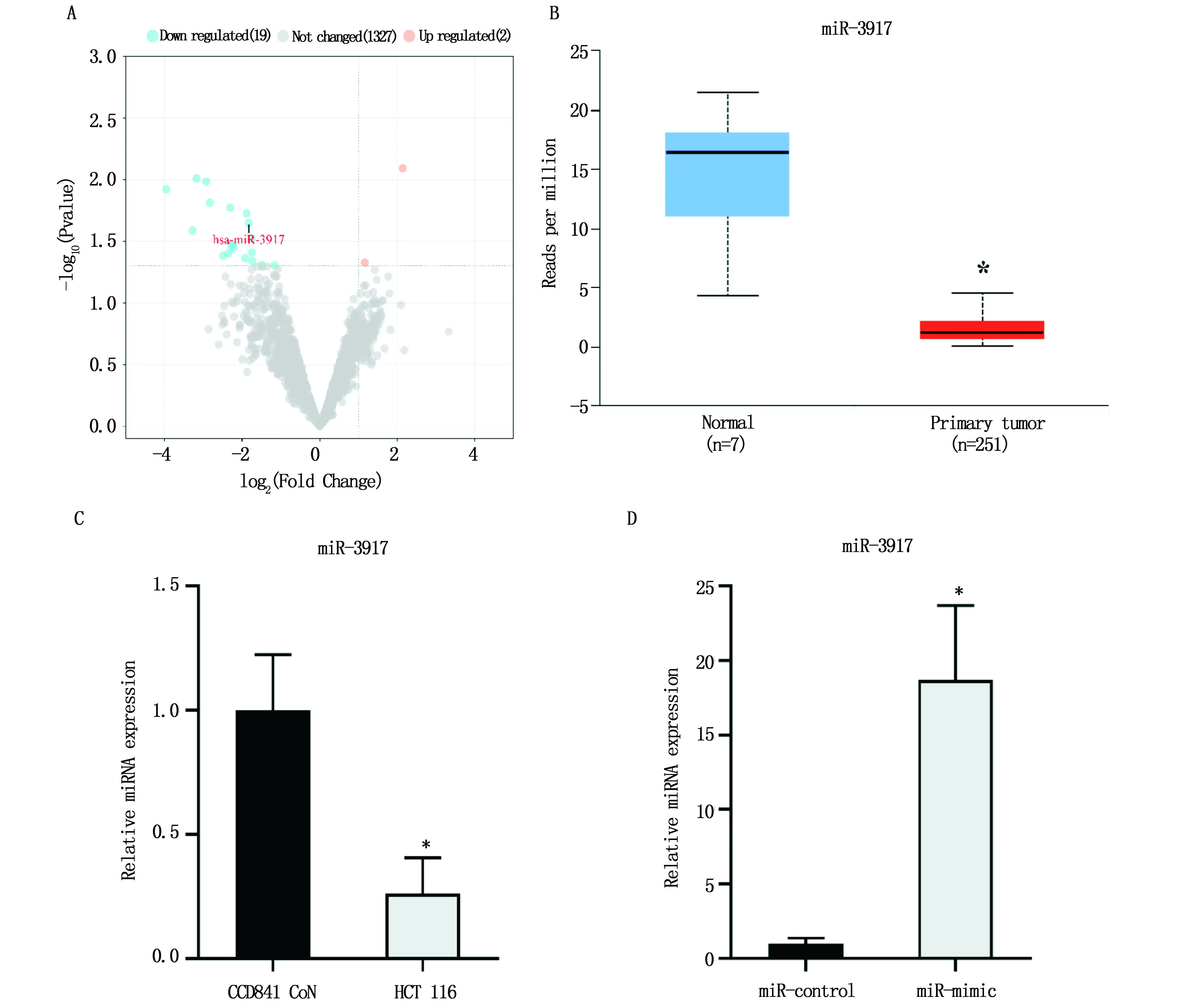
图1 miR-3917在CRC中的表达
2.2 上调miR-3917的表达对CRC细胞增殖的影响CCK-8实验结果显示,在24、48、72 h时间点,miR-mimic组中细胞的OD值显著低于miR-control组(图2A,P<0.05)。平板克隆形成实验结果显示,miR-mimic组的克隆形成数显著低于miR-control组(图2B,P<0.05)。

图2 上调miR-3917的表达对CRC细胞增殖的影响
2.3 上调miR-3917的表达对CRC细胞迁移的影响划痕实验结果显示,miR-mimic组中细胞的迁移率显著低于miR-control组(图3A,P<0.05)。Transwell迁移实验结果显示,miR-mimic组中迁移细胞数显著少于miR-control组(图3B,P<0.05)。
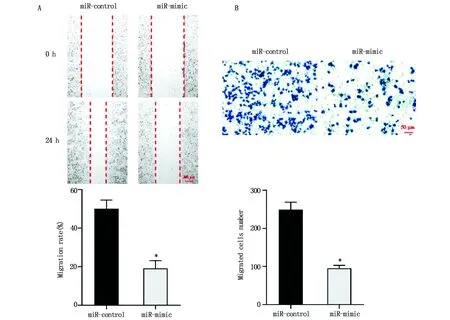
图3 上调miR-3917的表达对CRC细胞迁移的影响
2.4 miR-3917的潜在生物学功能和相关信号通路通过TargetScan数据库对miR-3917下游靶基因进行预测,将得到的靶基因进行GO和KEGG富集分析并展示结果中排序前10的注释条目(图4)。如图4A所示,RNA聚合酶Ⅱ相关转录调控、核苷酸切除修复、转录正调控等生物学过程(Biological Process)被显著富集(P<0.05)。细胞成分(Cellu-lar Component)富集结果显示,细胞核相关成分包括核质、细胞质核周区等被显著富集(图4B,P<0.05)。分子功能(Molecular Function)富集分析结果显示,DNA结合相关功能被显著富集(P<0.05)。此外,如图4D所示,KEGG通路富集分析结果显示,与CRC细胞恶性表型密切相关的Wnt/β-catenin信号通路被显著富集(P<0.05)。

图4 miR-3917的潜在生物学功能和相关信号通路
2.5 上调miR-3917的表达对CRC细胞中Wnt/β-catenin信号通路的影响Western blot实验结果显示,miR-mimic组细胞中β-catenin核蛋白的表达水平显著低于miR-control组(图5)。

图5 上调miR-3917的表达对CRC细胞中Wnt/β-catenin信号通路的影响
3 讨论
CRC是全球范围内癌症相关死亡的主要原因之一,这种疾病是对人类健康的严重威胁[11]。目前CRC的主要治疗方法包括手术、化学药物治疗、放射治疗、免疫治疗等,此外正处于研发阶段的新型治疗方法还包括基因治疗、靶向治疗等。但这些治疗手段都存在局限性,如耐药性、副作用、肿瘤复发等问题[12]。因此,亟需进一步探究CRC的发病机制,寻找潜在治疗靶点,发展新的治疗方法。
目前有多种miRNA被发现在CRC中存在差异性表达并与疾病的发生和发展过程密切相关。贾二娜等[13]通过对GEO和TCGA数据库的CRC相关表达数据进行分析发现,miRNA-23a在CRC组织中显著高表达,miRNA-23a高表达组患者的总生存时间显著低于低表达组,确定miRNA-23a是CRC预后重要的独立危险因素。CHEN等[14]发现miR-215在CRC组织和细胞系中显著低表达,上调其表达可以抑制CRC细胞的增殖和迁移能力。LIU等[15]通过研究发现,miR-937在CRC组织和细胞系中的表达显著上升,其表达与CRC的临床分期相关,下调miR-937的表达抑制了CRC细胞的增殖和迁移能力。ZHAO等[16]通过研究发现miR-1236-3p在CRC组织中的表达显著下降,其表达与CRC的临床分期和转移相关,上调miR-1236-3p的表达可以抑制CRC细胞的增殖和迁移。本研究结合生物信息学分析和实验验证发现,miR-3917在CRC组织和细胞系中显著低表达,上调其表达可以显著抑制CRC细胞的增殖和迁移。这些结果说明miRNA在CRC中发挥重要调控作用,其差异性表达和疾病的发生和发展之间具有相关性。此外,miRNA可以通过结合靶基因的mRNA以抑制其蛋白翻译,这是miRNA发挥生物学功能的重要调控机制。CHEN等[14]发现miR-215可以通过靶向调控Yin Yang 1蛋白的表达发挥抑制CRC的作用。ZHAO等[16]发现miR-1236-3p可以通过靶向调控DCLK3蛋白的表达发挥抑癌作用。但miR-3917在CRC中发挥抑癌作用的下游靶基因尚不清楚。
Wnt/β-catenin信号通路的激活促进了CRC细胞的增殖和迁移,参与了多种功能性miRNA在CRC中发挥的调控作用。YE等[17]通过研究发现miR-34b可以通过抑制Wnt/β-catenin信号通路抑制CRC细胞的增殖。LUAN等[18]通过研究发现miR-28-5p可以通过调控Wnt/β-catenin信号通路抑制CRC细胞的增殖和迁移。本研究通过实验验证miR-3917可以通过抑制Wnt/β-catenin信号通路来抑制CRC细胞的增殖和迁移能力。但本研究存在一定局限性,相关研究局限于体外细胞实验,进一步的动物实验验证将在后续研究中完成。
综上,本研究发现miR-3917的表达水平在CRC组织和细胞系中发生差异性下调,并证明miR-3917可以通过调控Wnt/β-catenin信号通路抑制CRC细胞的增殖和迁移。这些发现不仅为CRC发病的分子机制提供了新的认识,也为CRC的治疗提供了新的潜在分子靶点。

