从定性到定量:基于pKa进行大学有机化学教学
翁锦程,孙瑞,李炎坤,徐政虎
山东大学化学与化工学院,济南 250100
酸碱理论,包括1887年瑞典科学家阿伦尼乌斯首次提出的酸碱电离理论,Bronsted酸碱质子理论、路易斯酸碱电子理论等都是化学原理中最基本、最重要的理论之一。其不仅是无机化学,也是有机化学、分析化学、物理化学的基本原理,是现代化学发展和进步的基本逻辑基础和指导性理论。因此掌握好酸碱理论是化学专业本科生学好四大化学的前提,如何讲授好酸碱理论也是现代化学教育的重点。
在当今社会,随着云时代的来临,大数据(Big data)也吸引了越来越多的关注,大数据的应用越来越彰显出他的优势。在酸碱理论中,pKa就是一个极其重要的数据,可以用来衡量共轭酸碱对的酸碱强度。然而这样一个数据工具除了在无机化学教学中经常提及外,在其他化学学科的教学科研中的应用还非常少见。2016年,清华大学程津培院士团队通过对卷帙浩繁的文献进行整理归纳,创建了涵盖全面、数据可靠、使用快捷方便的网络版数据库ibondD,该数据库包含了各类物质在不同溶剂中的pKa参数2.25万条,可以方便查询[1]。由此可见,pKa数据在现代化学的教学和科研中具有举足轻重的地位。
本文介绍了我们结合pKa数据进行有机化学教学的几个实例,包括理解有机化合物酸性强弱、共轭碱碱性强弱,判断酸碱反应的方向,理解亲核性强弱,判断离去基团离去能力,帮助理解有机化学中的电子效应等,使学生做到能够知其然,并知其所以然。因此在教学中能够实现从对理论定性的理解,升华到定量的分析,帮助学生形成清晰图像,也有助于培养他们发现问题、分析问题和解决问题的能力。
1 pKa总述
在有机化学中,pKa一般在酸碱质子理论的背景下被提及,反映的是一个物质解离质子的能力。笔者以pKa作为桥梁,向有机化学初学者引入了一系列有机化学中的重要概念与问题,深化了学生对有机化学的理解,开拓了学生在有机化学领域的学习思路。pKa又名酸离解常数,是酸解离平衡常数Ka的常用对数的相反数,其定义式为pKa= -lgKa,因此pKa值越小,Ka越大,共轭酸的酸性就会越强,进一步代表着其共轭碱的碱性越弱;反之,pKa值越大,共轭酸的酸性就会越弱,其共轭碱的碱性越强,这是依托pKa进行教学的基本原理。我们将有机化学中常见的酸碱的pKa进行了归纳总结,如表1所示,由pKa数据表学生可以很清晰地了解各类化合物的pKa值:烃类化合物的酸性很弱,pKa都在50左右;炔基氢端炔氢pKa在23左右,酸性强于烯基氢、强于烷基氢;杂原子上的氢酸性一般强于碳原子上的氢酸性;水和醇的pKa在16左右,乙酸的pKa为4.76,常见无机强酸的pKa均为负值。学生必须对常见化合物的pKa大小有基本了解,最好能够记住一些关键数据。大部分有机官能团的pKa数据都可以从Evans pKa数据表格中查到[2]。
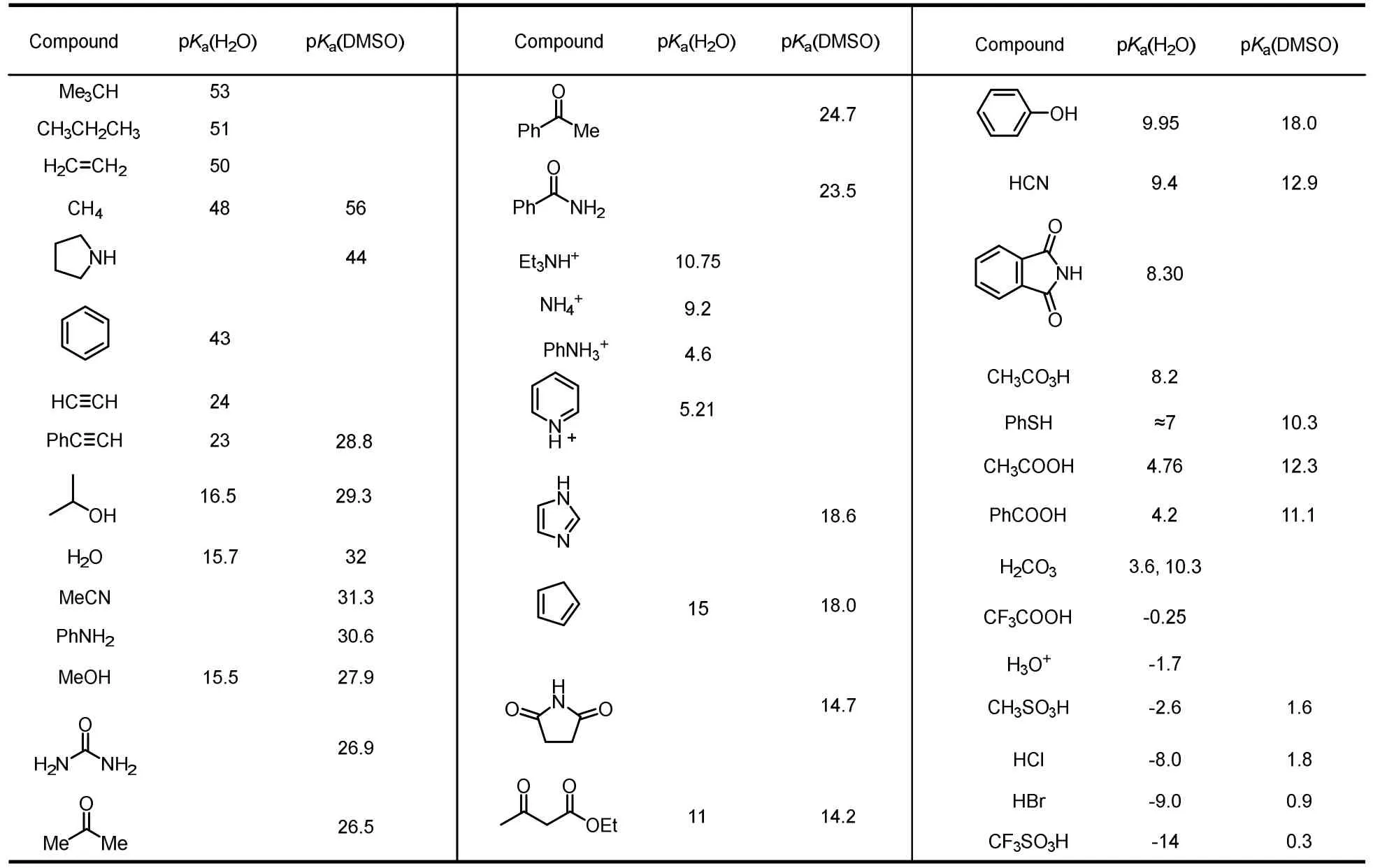
表1 常见化合物pKa数据表
2 基于pKa的共轭酸碱教学
有机化学中的pKa指的是在酸碱质子理论下的参数,其核心观念就在于“酸中才有碱,碱中才有酸,酸可变碱,碱可变酸”[3]。酸和碱是通过给出和接受质子的共轭关系相互依存,相互转化的:酸失去质子,就变成了其共轭碱;其共轭碱得到质子,又变成了酸。Ka越大,代表酸性越强,而pKa与之是负对数关系,因此pKa越小,酸性越强。而一个酸的酸性越强,其对应共轭碱的碱性也就越弱。在教学中,须向学生强调pKa表反映信息的一体两面性,它在反映物质酸性强弱的同时,也反映其共轭碱的碱性强弱。如表1中给出了Et3N+H和NH4+的pKa大小,分别为10.75和9.24。可以以此为例子向学生说明pKa越大,对应的共轭碱碱性也越强,说明Et3N碱性强于NH3,源于三个乙基的推电子性质。
2.1 pKa与酸性以及诱导电子效应
有机化学中比较酸性的强弱并利用电子效应进行解释是教学的难点。pKa是一个热力学的参数,它的大小是由酸和酸根的稳定性(或者说能量高低)来决定的。学生初学有机化学时常常陷入误区,即在判断一个物质的酸性强弱时,倾向于从“键更加容易断裂,更容易电离出质子”的角度比较物质的酸性或者pKa大小。在热力学上,平衡常数K体现的是反应的程度,而非体现反应是否容易发生,这种误区需要在教学中去纠正。在教学实践中我们也发现,有的学生通过比较不同物质的某根键的“键能大小”去比较不同物质的pKa大小,这也是错误的。键能的定义是从中性原子到生成化学键所释放出来的能量,其逆过程是键的均裂,而酸电离产生质子这个过程,是键的异裂并生成一个质子和对应的酸根离子的过程。两者的起点和终点都不相同,则自然没有任何关联性。如图1所示,比较不同有机羧酸的酸性,从pKa大小可以看出从乙酸到氯乙酸、氟乙酸酸性逐渐增强,其原因在于Cl、F原子有非常强的电负性,产生了吸电子的诱导效应,导致其共轭负离子的稳定性增强,平衡向右移动,酸性增强。F原子越多,吸电子能力越强,导致三氟乙酸的pKa成为负值,达到强酸的水准。
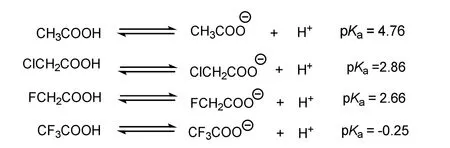
图1 pKa与酸性以及诱导电子效应
2.2 pKa与碱性
碱是有机化学反应中不可缺少的组分,在很多反应中往往需要用碱去质子,生成相应的负离子参与反应,如何选取强度匹配的碱至关重要。分析pKa数据表可以看出碱性的强弱,如常用的丁基锂、甲基锂等,对应共轭酸的pKa在50左右,碱性非常强;NaOH、KOBut等对应共轭酸的pKa分别是15.7和17.0,碱性中等;有机碱如三乙胺、吡啶等对应共轭酸的pKa分别为10.75、5.21,碱性非常弱。纵向比较可以看出丁基锂的碱性比NaOH强30个数量级,NaOH碱性比三乙胺强5个数量级,通过这些数据的定量分析,能够让学生对不同物质的碱性有非常清晰的理解和认识,进一步可以指导实际的应用。如图2所示,邻苯二甲酰亚胺的pKa为8.3,低于KOH的15.7,遵循强碱制备弱碱的原则,使用KOH即可以去除邻苯二甲酰亚胺的质子,生成稳定钾盐,进一步与卤代烃发生取代反应,即为知名的Gabriel伯胺合成法。在Wittig反应中,从碘甲烷出发生成的三苯基膦碘盐上的甲基酸性很小,必须使用pKa很大的强碱如丁基锂才能够脱质子反应,生成不稳定的叶立德中间体(图2,式(2)),强碱的使用对反应条件要求很严格,底物的适用范围也受限制;溴乙酸乙酯与三苯基膦反应得到的磷盐中,其活泼亚甲基受到酯基以及三苯基膦阳离子的双重拉电子作用,酸性大大增强,采用碱性较弱并且易得的NaOH水溶液即可以发生脱质子反应,生成稳定的磷叶立德。该叶立德中间体能够在水和空气中稳定存在,被广泛应用于有机合成中。两种叶立德的制备,使用不同强度的碱,彰显了pKa在有机合成反应中的重要指导作用。
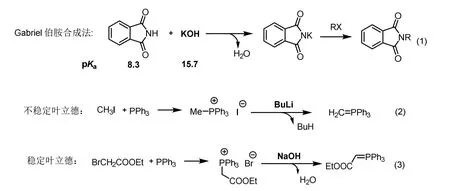
图2 pKa与碱性及其在合成中的应用
2.3 pKa与有机反应方向
pKa定量地反映酸碱强弱,可以通过pKa去判断酸碱反应的方向。比如LDA (二异丙基胺锂)的合成是个很好的教学例子。LDA是一个碱性非常强但亲核性非常弱的碱(大的立体位阻导致),在有机合成中被广泛应用。其制备方法是采用正丁基锂与二异丙基胺反应,二异丙基胺的pKa为36 (in THF),而烷烃的pKa一般在50左右,两者相差超过10个数量级,因此这个反应可以进行得很彻底(图3)。苯酚和碳酸钠的反应是另一个很好的教学例子。将碳酸和苯酚的pKa进行比较,就能发现苯酚的pKa为9.95,而碳酸的pKa1为3.6、pKa2为10.3,9.95介于两者之间,比碳酸的pKa1大了6个数量级,故即使苯酚过量,反应也只能停留在NaHCO3这一产物,无法生成酸性更强的碳酸,释放出二氧化碳,而它的逆反应,二氧化碳可以方便地中和苯酚钠生成苯酚(强酸制备弱酸)。
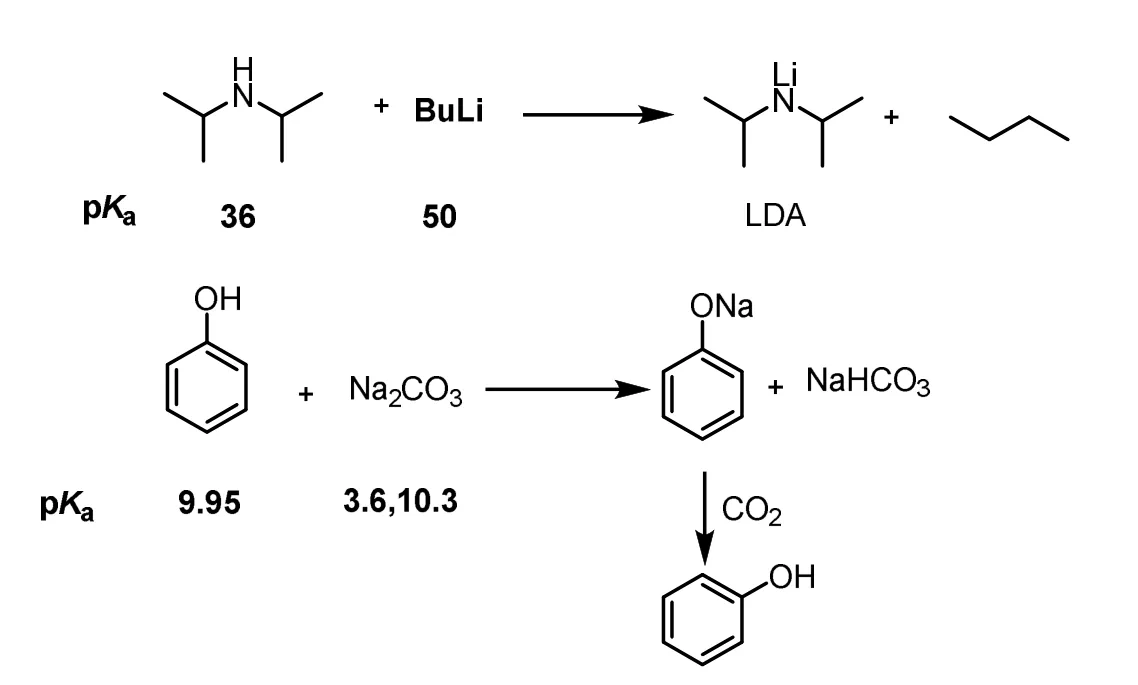
图3 pKa与有机反应方向
2.4 pKa与亲核性
一个物质的亲核性往往由它的碱性、可极化性和空间因素等综合决定[4]。pKa表只反应物质的碱性,一般来说,碱性强会导致亲核性强,但还需综合考虑另外两个因素。一个物质在不同的溶剂中的pKa是不同的,pKa表中给出了卤化氢分子的pKa,在水溶液中和DMSO中的pKa大小。不难发现水中的pKa数值比DMSO中的小,即卤离子在水这种质子溶剂中的碱性是小于在偶极溶剂中的碱性的。这是因为在质子溶剂中,卤离子可以与质子形成氢键,使得它们的溶剂化作用较大,在接受质子时需要克服比较大的溶剂化能,故碱性较弱,相对应的,亲核性也就会较弱。而在偶极溶剂中,卤离子处于一个相对“裸露”的状态,因此碱性就会更强,亲核性也就会更强。在教学中可以进一步向学生引出通过改变溶剂的极性来改变亲核试剂的亲核性强弱的思想,并阐明溶剂对反应的重要意义:SN2反应中,亲核试剂参与决速步,其活性高低就决定了反应的快慢,偶极溶剂相比于质子溶剂对于SN2更有利。通过调整溶剂的类型,可以改变其碱性和可极化性对亲核性贡献的主次地位,从而逆转不同亲核试剂的亲核性强弱关系。以卤离子为例进行说明:在偶极溶剂中,亲核试剂的碱性占主导地位,从F-到I-,随着碱性的减弱,亲核性是依次减弱的;而在质子溶剂中,亲核试剂的可极化性占主导地位,从F-到I-,尽管碱性减弱,但是随着可极化性的增加,亲核性反而是依次增强的[4]。这是因为影响亲核性的因素不只有碱性强弱,当定量考察对象的pKa在某些情况下相差不大时,其他因素便会上升为主要矛盾。
2.5 pKa与离去倾向
基团的离去性能主要取决于C—L键的键长与离去基团L-的碱性,其中,离去基团碱性越弱,基团离去能力越强。比如从F-到I-,碱性减弱,离去能力增强,这是碘代物在亲核取代反应中比较活泼,氟底物比较惰性的主要原因之一[5]。可见pKa大小与离去能力密切相关,这能够帮助理解现代有机反应,在科研中也有重要的应用。比如烷基亚胺不稳定,难以制备,科研工作者在制备烷基亚胺的同时加入苯亚磺酸钠,生成稳定的三组分加合物。进一步使用时仅需要加一点弱碱即可现场消除苯亚磺酸得到烷基亚胺,该反应能发生的根本原因在于苯亚磺酸的pKa为2.1,导致苯亚磺酸负离子是非常好的离去基团。如果和醋酸进行横向比较,醋酸的pKa为4.76,因此苯亚磺酸是比醋酸根还要好得多的离去基团(图4)。基于此,近年来我们课题组采用PhSO2SCH3作为硫亲电试剂,发展了一例崭新的三组分的点击化学反应[6]。该反应能够像搭积木一样,将端炔、叠氮与PhSO2SCH3硫亲电试剂三组分快速组装,得到多取代含硫三氮唑产物,该类产物无法通过常规点击化学反应得到。反应的机理是Click反应催化循环中,炔铜中间体与叠氮发生环加成反应得到三唑铜中间体M2,在其质子化反应之前,被带有离去基团的硫亲电试剂捕获,生成目标产物。这里M2发生质子化反应(即常规点击化学反应),还是与硫亲电试剂发生反应的竞争是三组分点击化学反应成功与否的关键。硫亲电试剂PhSO2SCH3中,苯亚磺酸负离子良好的离去能力决定了该试剂的良好反应活性,保障了三组分Click反应的成功[6]。Click反应在2022年被授予诺贝尔化学奖[7,8],该案例的不仅证明了pKa能从教学创新走入科研实践,同时也拓展了学生的视野,激发了学生的学习兴趣。
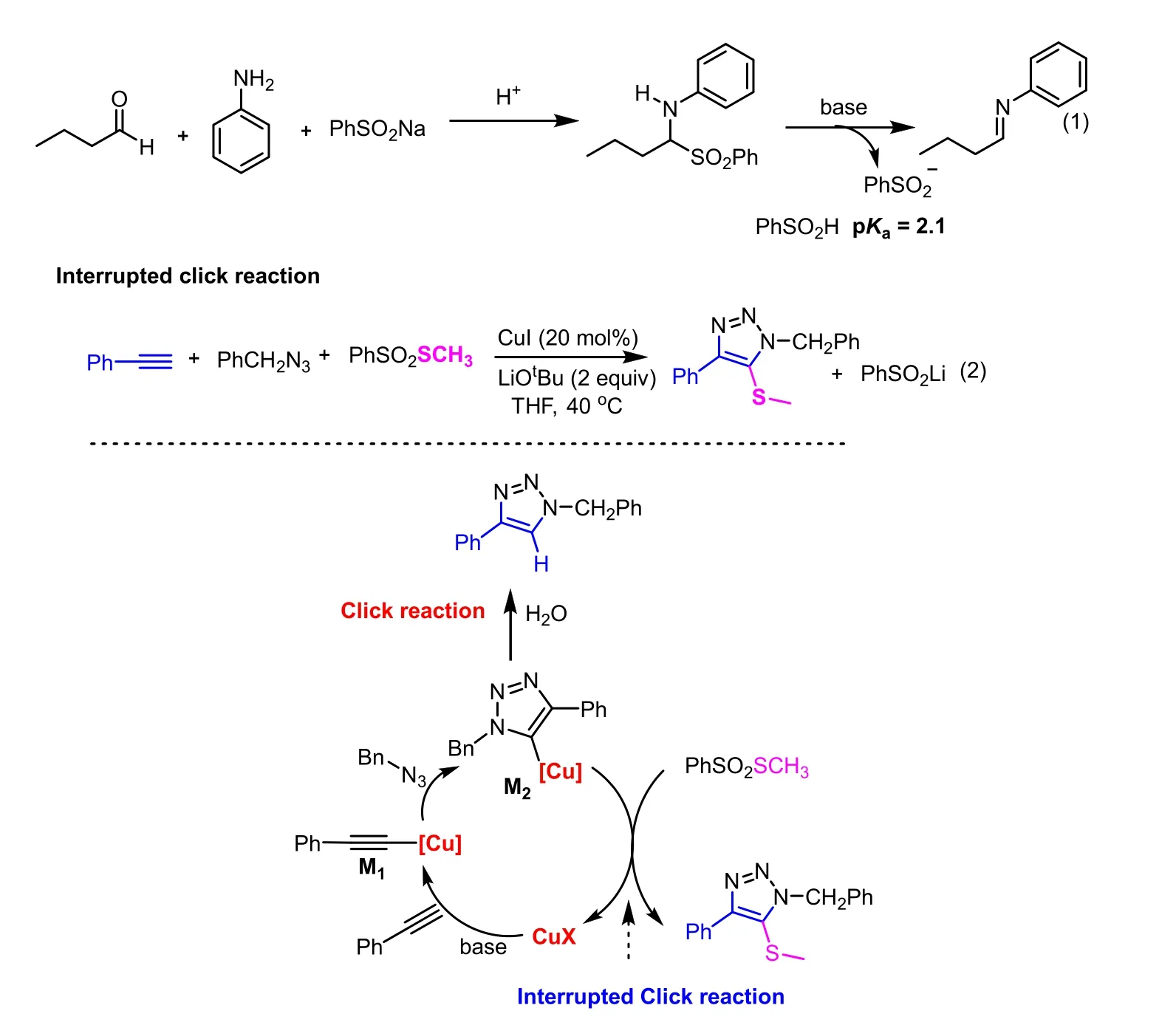
图4 基于苯亚磺酸负离子离去基团的有机合成反应
3 结语
pKa数据内涵丰富,可以从物理化学、酸碱性、电子效应、亲核性、离去倾向等多个维度进行定性和定量的分析,拓宽学生在有机化学上的视野,并且深化他们对有机化学基本理论的理解。该教学模式注重数据分析,与传统的有机化学理论教学模式不同,更有助于学生对有机酸碱形成清晰的认知影像,这对于后续其他化学课程的学习也大有帮助。近年来,笔者在山东大学泰山学堂拔尖班一直实践这种教学模式,培养了学生基于数据分析问题、解决问题的能力,并调动学生积极主动的学习热情,取得了良好的成效,达到了预期的目标。

