Cu(I)/TEMPO体系催化空气氧化苄醇
——一个有机化学综合实验设计
奉强,王思宇,李倩意,王晓月,何冰
成都师范学院化学与生命科学学院,化学基础与创新四川省实验教学示范中心,成都 611130
苯甲醛是结构最为简单的芳香醛,也是一种重要的有机化工原料,广泛用作染料、香料及药物的重要中间体。苯甲醛的合成方法有很多[1],其中苄醇氧化法合成苯甲醛是最为便捷的制备路线,但目前大学有机化学基础实验教学课堂很少涉及这一重要工业产品的制备实验[2-4]。目前用于氧化苄醇得到芳香醛的氧化体系较多,不仅有次氯酸钠-醋酸氧化体系[5]、活性二氧化锰试剂,还有多类重金属氧化剂如重铬酸吡啶盐(PDC)、氯铬酸吡啶盐(PCC)、三氧化铬硫酸溶液(Jones试剂)等。虽然这些试剂在传统上常常用于有机合成实验来完成醇的氧化制备醛、酮,尽管它们也很实用且应用也较为广泛,但它们有一些自身缺陷,如部分药品保存过程中易失效将导致化学计量不准确、实验稳定性不佳,含铬试剂不仅自身毒性较大,而且实验所排放废水中铬含量超标造成水体污染。综合上述原因,现有苯甲醇氧化制备苯甲醛合成方法使之难以编入基础实验教材。
为了推动苯甲醇氧化制备苯甲醛实验进入有机化学基础实验课堂,需综合考虑实验多方因素,择优选择。① 安全环保,故需慎用重金属氧化试剂;② 高效经济,这不仅体现实验节约意识,同时也是绿色化学思想的具体体现;③ 实验操作简单,结果稳定,重现性好,课堂适应度高;④ 通过开放式教学锻炼学生在多任务操作时的统筹与协调能力,全面提升学生的动手能力[6]。
在文献调研基础上[7,8],本实验采用廉价的空气作为氧化剂,以丙酮做溶剂,催化体系由氯化亚铜(CuCl)、2,2’-联吡啶(bpy)、N-甲基咪唑(NMI)和稳定的有机自由基2,2,6,6-四甲基哌啶氧化物(TEMPO)组成,将苄醇类化合物催化氧化为相应的苯甲醛类化合物,实验装置如图1所示。通过溶剂、金属盐、含氮配体、配体与盐的比例、反应体系与空气接触程度等条件系统探究,优化出实验最优条件。利用该条件,对苄醇底物进行拓展,考察带吸电子取代基和给电子取代基的苯甲醇类化合物反应情况,证实该反应体系对苄醇氧化的普适性。
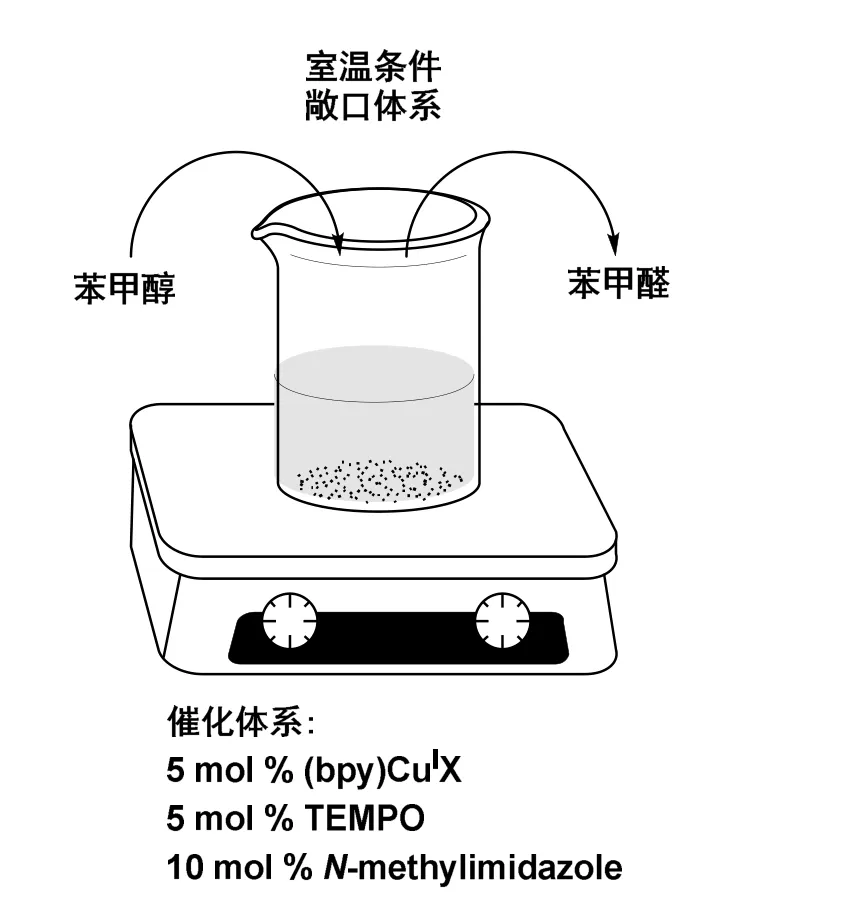
图1 实验装置示意图
1 实验目的
(1) 巩固反应进程监测手段,进一步熟悉萃取、分液、蒸馏等基本操作技能;
(2) 了解金属配合物催化反应原理和方法;
(3) 掌握运用有机波谱技术推断和鉴定分子结构的方法;
(4) 认识到绿色化学和环境保护的重要性,提升社会责任感。
2 仪器与试剂
仪器:铁架台,85-II型磁力搅拌器,敞口锥形瓶(100 mL),分液漏斗,普通漏斗,搅拌子,薄层色谱展开缸,点样毛细管,SHB-III型循环水式多用真空泵,旋转蒸发仪。ESJ120-4型1/10000电子天平(上海菁海仪器有限公司);ZF-6型三用紫外分析仪(巩义市予华仪器有限责任公司),Agilent1200型高效液相色谱仪(美国Agilent公司),Bruker AVANCEш 400核磁共振仪(瑞士Bruker公司),CDCl3为溶剂、TMS为内标,质谱仪(EI源,日本岛津公司),B603近红外光谱仪(博尔仪器仪表(天津)有限公司)。
试剂:苯甲醇、4-甲氧基苯甲醇、4-甲基苯甲醇、4-溴苯甲醇、4-硝基苯甲醇、2,2’-联吡啶、1-甲基-1H-咪唑、2,2,6,6-四甲基哌啶-N-氧化物、丙酮,所用试剂均为分析纯。
3 实验部分
3.1 实验条件的优化
3.1.1 溶剂对反应的影响
以CuBr、bpy、TEMPO和NMI为催化体系,空气为氧化剂,苄醇为反应底物,考察不同溶剂对反应收率和反应速度的影响,结果见表1。
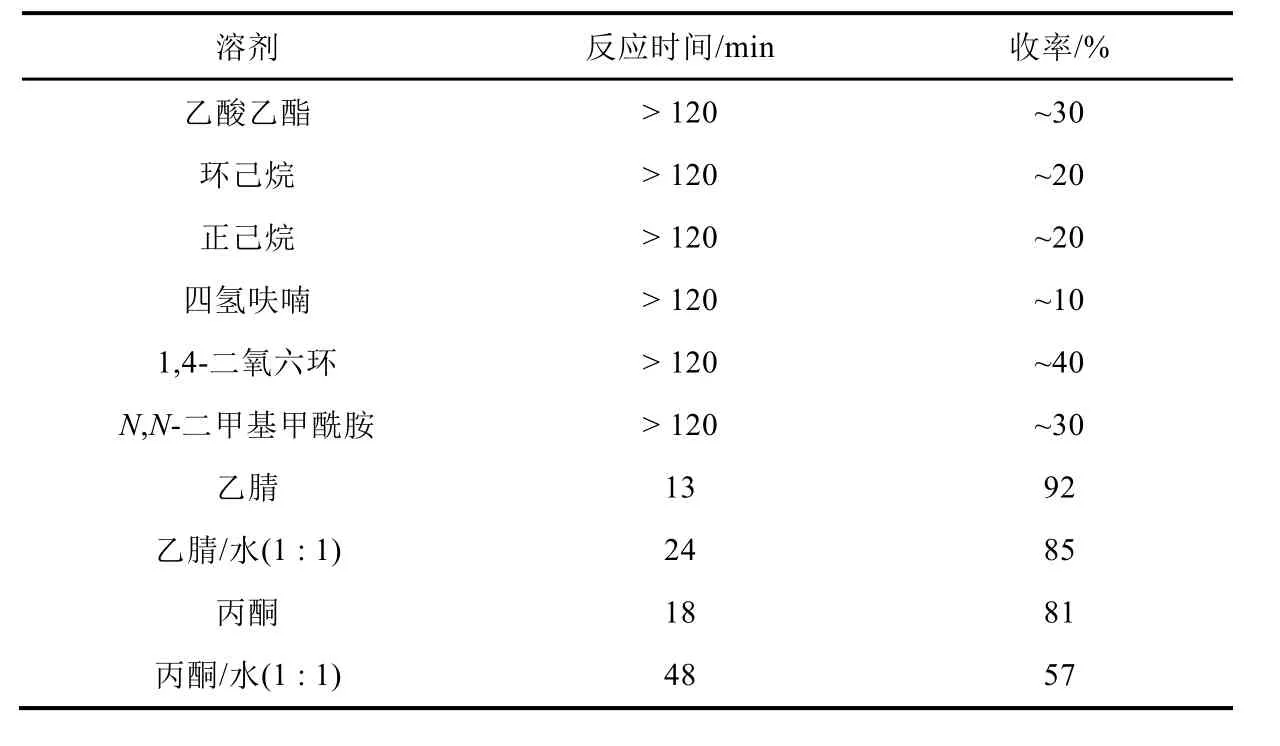
表1 溶剂对反应的影响
由表1可知,使用实验室常用溶剂乙酸乙酯、环己烷、正己烷、四氢呋喃、1,4-二氧六环或N,N-二甲基甲酰胺,反应虽能进行,但速度较慢,反应进行2 h,薄层色谱(TLC)监测仍有较多原料苄醇未反应(收率< 40%)。以乙腈作溶剂,反应给出最高的反应收率(92%)和最快的反应速度(13 min),即使换用乙腈和水的混合溶剂(体积比1 : 1),反应速率仍然较快(24 min)。换用丙酮或丙酮与水的混合溶剂(体积比1 : 1)作溶剂,虽然反应都能转化完全,但丙酮反应收率(81%)远高于丙酮与水的混合溶剂所得收率(57%)。考虑到乙腈的高毒性而难以在大学实验课堂上广泛使用,故选用毒性较小的丙酮作该反应溶剂。
3.1.2 金属盐对反应的影响
以丙酮作溶剂,在实验室常见金属盐范围内继续考察不同金属盐对反应的影响,结果见表2。

表2 金属盐对反应的影响
由表2可知,所考察的七种金属盐都能催化苄醇氧化为芳醛,但整体反应速度都较慢,2 h后TLC监测反应发现仍有大量原料未转化,收率较低(< 30%)。实验发现,卤化亚铜作该催化体系的金属盐时,它们的催化活性都较高,都能在20 min左右时间内催化反应使之完全,尤其是氯化亚铜反应速率最佳,能在极短的时间(10 min)内使反应完成。由于三种亚铜盐催化反应收率相差不大(80%-83%),加之氯化亚铜更好的催化速率和更为便宜的价格,故选择氯化亚铜作该催化反应体系的金属盐试剂。
3.1.3 含氮配体对反应的影响
以丙酮作溶剂、氯化亚铜作金属盐催化剂,在TEMPO协同催化下考察了不同含氮配体及其用量对该催化反应的影响,结果见表3。
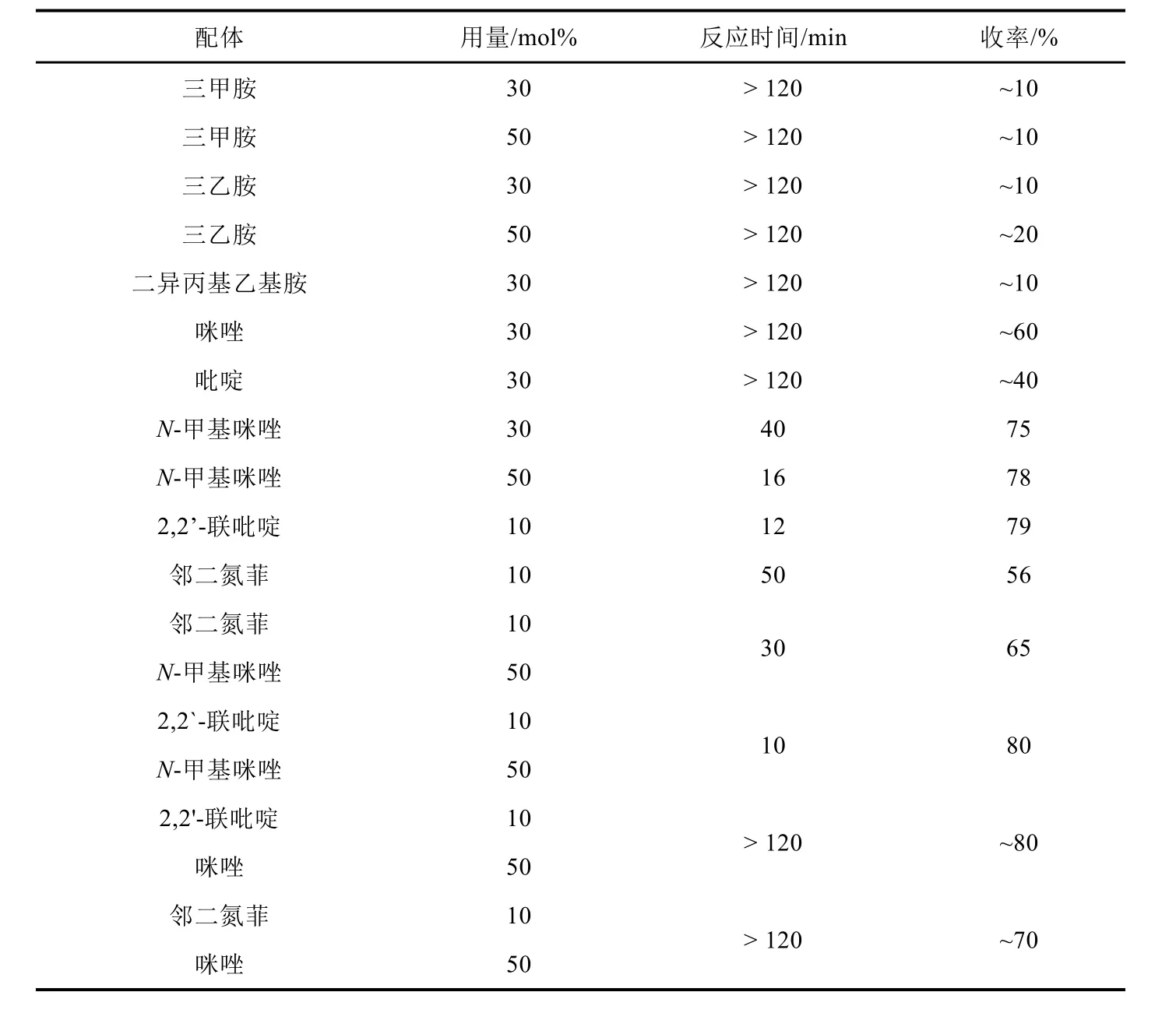
表3 配体对反应的影响
由表3可知,实验室常用叔胺只能缓慢催化该氧化反应,即使将三乙胺用量增加到底物的50 mol% (mol%为摩尔分数),反应2 h后也只有20%的产物生成。考虑到时间因素,未再增大用量进一步考察其对该反应的影响。换用芳香含氮杂环化合物作为催化配体,实验发现催化效果都较好,尤其是NMI和bpy。特别值得注意的是bpy作配体时,催化剂用量即使低到底物的10 mol%时,反应在12 min时间内也可完成,收率达到79%,催化效果很好。
进一步考察不同配体组合对催化反应的影响。实验发现,虽然组合配体对反应的速率与收率没有很大提高,但却给出一个奇特的实验现象。当选用bpy与NMI组合作配体时,反应溶液呈红棕色(图2a),当反应结束瞬间,溶液突变为青绿色(图2b)。反应完成瞬间溶液颜色变化见图2。明显的颜色突变使得反应进程易于观察,简化了监测过程。

图2 反应完成瞬间溶液变色现象
3.1.4 催化剂不同用量对反应的影响
以丙酮作溶剂,碘化亚铜为金属催化剂,考察改变催化剂含氮配体不同用量对反应速度和收率的影响,结果见表4。
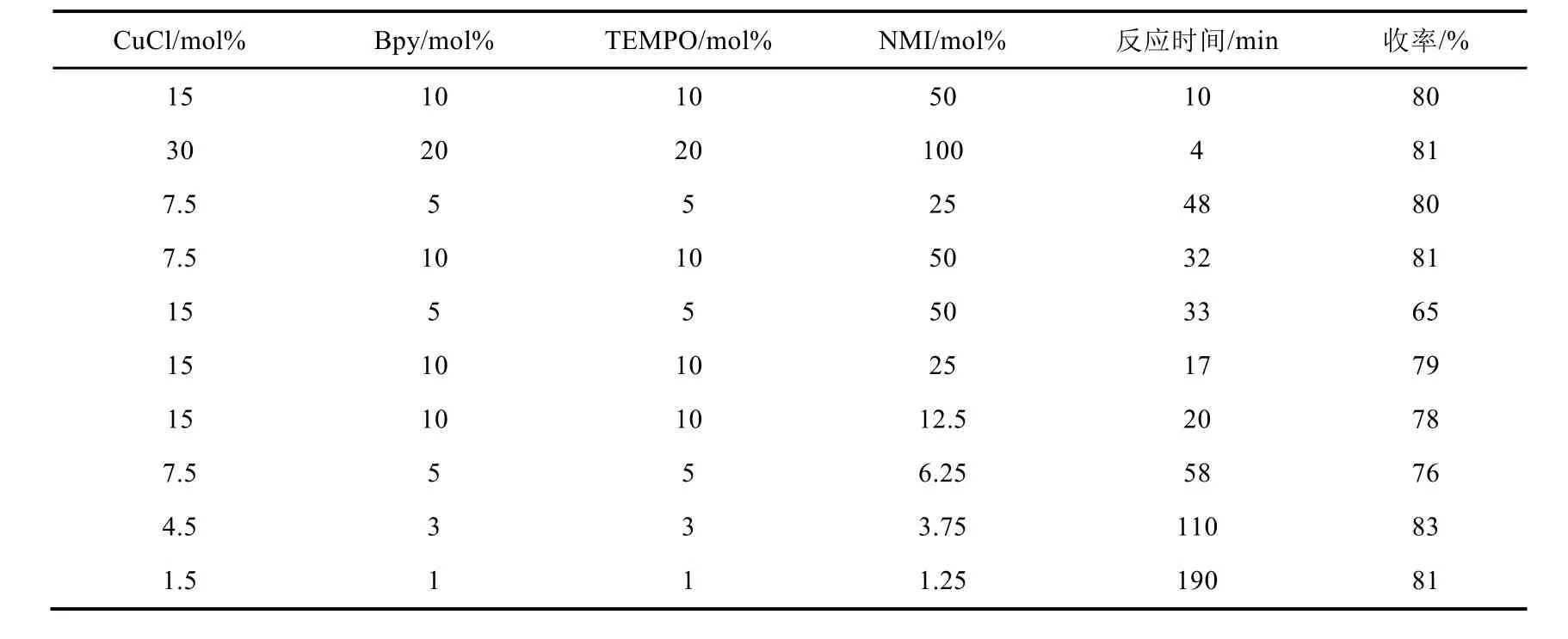
表4 配体用量对反应的影响
由表4可知,催化剂的用量对反应的速度有很大影响。当催化剂用量达到苄醇的20 mol%时,反应能在极短的时间(4 min)内完成。催化剂用量减少到苄醇的5 mol%时,反应时间也需要相应延长至48 min才能使反应完成。保持其他催化剂用量10 mol%不变,单独减少氯化亚铜用量至7.5 mol%,反应时间也需要相应延长到32 min才能完成。保持氯化亚铜用量,减少其他催化剂用量至5 mol%,反应时间相应延长至33 min才能让反应完全。单独减少NMI用量,反应时间延长不是太明显。将催化剂用量都减少至苄醇底物的5 mol%、3 mol%和1 mol%,延长反应时间,底物都能完全氧化,以约80%收率得到目标产物苯甲醛。综合考虑反应的速率和收率,我们将NMI用量确定为底物用量的12.5 mol%。
3.1.5 空气接触对反应的影响
考察反应体系与空气接触情况对反应速度与收率的影响。分别选用25 mL 19#磨口圆底烧瓶、50 mL 19#磨口圆底烧瓶、50 mL 19#锥形瓶、100 mL 19#锥形瓶、100 mL广口锥形瓶以及100 mL烧杯,实验结果见表5。

表5 空气接触程度对反应的影响
由表5可知,反应体系与空气接触程度直接影响着反应速度。反应体系与空气接触越不充分,反应速率越慢。当溶液与空气接触程度逐渐增大时,反应速度急速加快。选用100 mL烧杯时甚至7 min就能使底物反应完全。考虑到烧杯做反应容器时,溶剂挥发较大,不适宜在基础实验课堂上使用,为此,我们选用100 mL广口锥形瓶做该催化氧化反应的容器。
3.1.6 拓展反应底物,考察反应适应性
利用上述优化条件,考察其对苄醇类化合物氧化反应的普适性。选用不同电性底物包括对甲氧基苄醇、对硝基苄醇、对氯苯甲醇和对甲基苯甲醇,实验投料为取代苄醇2.5 mmol,CuCl 35 mg(0.35 mmol)、bpy 40 mg (0.25 mmol)、TEMPO 40 mg (0.25 mmol)、NMI 25.6 mg (0.3 mmol)和丙酮20 mL加入一个带有搅拌子的敞口100 mL广口锥形瓶中,实验结果见表6。

表6 反应底物扩展
由表6可知,催化体系对缺电子芳基苄醇和富电子芳基苄醇都有较快的催化速率和较高的反应收率。虽未进行更多的底物拓展,一定程度上仍可看出该催化体系对苄醇氧化的适应性。
3.2 实验步骤
本实验开设对象为化学专业学生(以班级人数50人为例)。将班级分为17个小组,每组3人。每个小组按下述实验参考用量设计实验,独立考察不同溶剂(丙酮、丙酮/水(1 : 1))、金属盐(氯化亚铁、溴化亚铜、碘化亚铜)、含氮配体(2,2’-联吡啶、2,2’-联吡啶/1-甲基-1H-咪唑)、不同口径反应容器和反应底物的实验结果后,再独立完成下述实验。
以苄醇反应为例:将苄醇270 mg (2.5 mmol)和15 mL丙酮加入带有搅拌子的100 mL广口锥形瓶中,向快速搅拌的苄醇溶液中按顺序加入氯化亚铜35 mg (0.35 mmol)、2,2’-联吡啶 40 mg (0.25 mmol)和2,2,6,6-四甲基哌啶氧化物40 mg (0.25 mmol)、1-甲基-1H-咪唑102.5 mg (1.25 mmol)。快速搅拌混合物,约反应20 min溶液颜色突变为绿色,此时TLC监测显示反应完成(展开剂V石油醚:V乙酸乙酯= 5 : 1)。将反应混合物于旋转蒸发仪上室温减压除去大部分溶剂,剩余物转移至250 mL烧杯中,加入水(50 mL)和石油醚(50 mL),充分搅拌后转移到250 mL分液漏斗中静置分液。水相再用石油醚萃取(50 mL × 2),水相中再无产品。合并有机相,混合有机相经水洗、饱和食盐水洗、无水硫酸钠干燥,过滤,滤液旋干即得产品220 mg,收率83%。
3.3 监测、表征方法
(1) 反应监测:TLC监测反应程度;开始反应时每间隔3 min用TLC监测反应,颜色突变后再间隔1 min监测反应体系两次。
(2) 产物表征:反应产物自制样品,由红外光谱仪测试其红外谱图(IR),学生根据样品官能团吸收峰变化情况分析产品结构;学生自己制样,由质谱仪(MS)检测原料和目标产物分子量,确证产物正确与否;任选两组样品做核磁共振谱(NMR)检测,包括1H NMR、13C NMR,次日数据返回,自行解析产品结构。
4 结构与讨论
4.1 红外谱图确证
为了定性确定化合物的转化,我们对所用原料和生成的化合物都经红外谱图测试。实验发现原料苄位羟基吸收尖锐,吸收强度大,产物醛基C=O双键也是吸收强烈。对硝基苯甲醇和对硝基苯甲醛的红外谱图见图3。
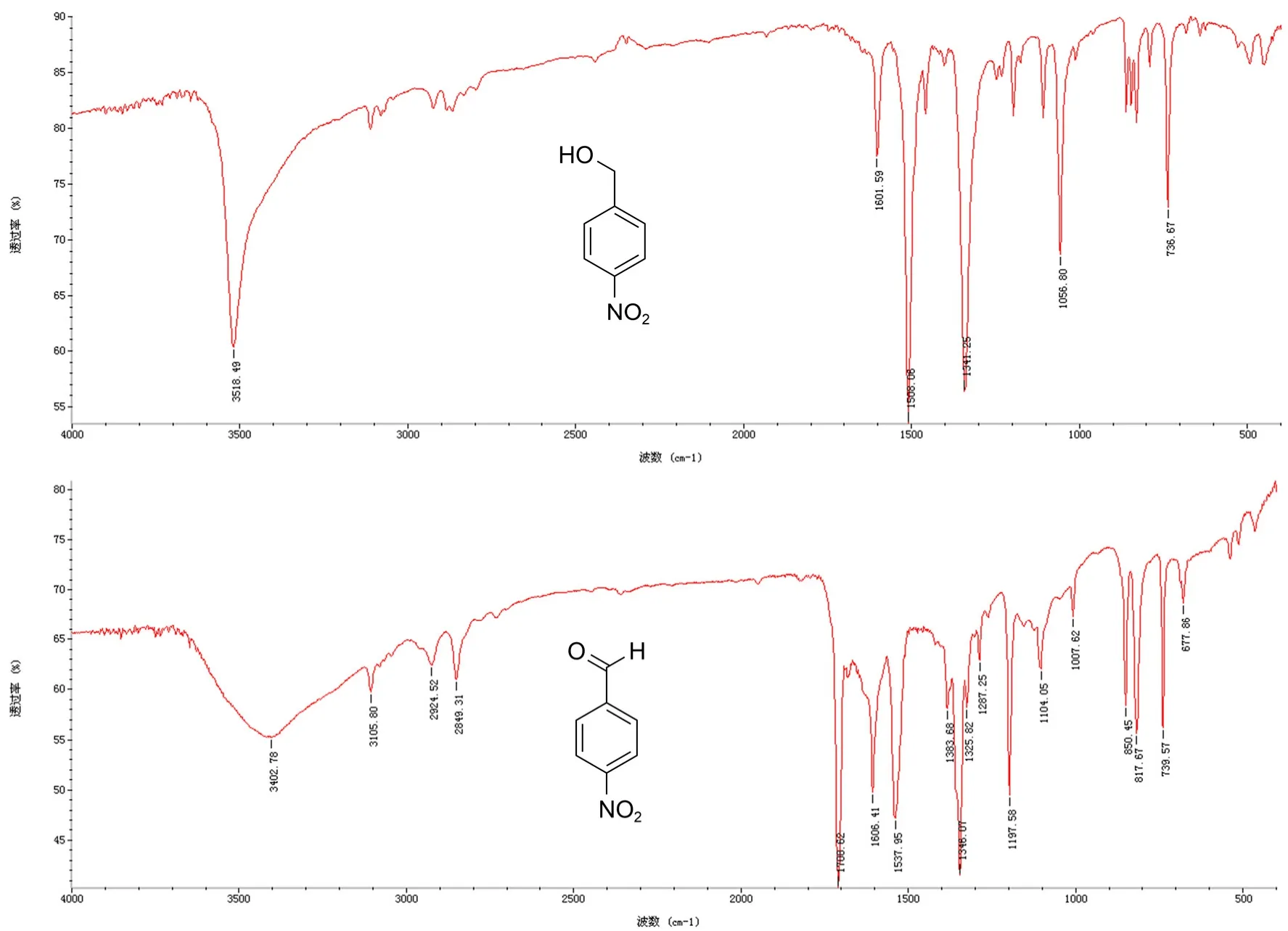
图3 4-硝基苯甲醇(上)与4-硝基苯甲醛(下)红外光谱谱图比较
由图3可以看出,对硝基苯甲醇的醇羟基在3518.5 cm-1吸收强烈,而对硝基苯甲醛在1700.6 cm-1吸收强烈,由此可确认反应由苄醇顺利氧化为芳醛。
4.2 核磁表征、质谱检测与HPLC谱图
苯甲醛核磁表征(核磁谱图见图4)和质谱检测数据为:1H NMR (400 MHz, Chloroform-d)δ: 9.96(s, 1H), 7.87-7.76 (m, 2H), 7.59-7.52(m, 1H), 7.46 (dd,J= 8.5, 6.9 Hz, 2H);13C NMR (100 MHz, DMSOd6)δ: 193.1, 136.7, 134.7, 129.8, 129.4;MS(EI)m/z: 107.05{[M+H]+}。
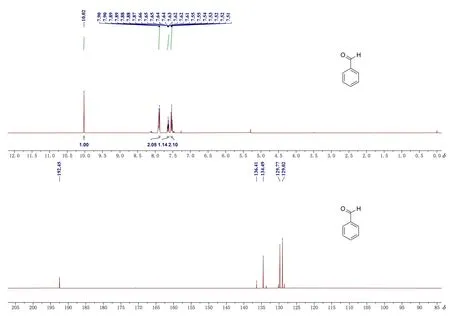
图4 苯甲醛的1H NMR (上)和13C NMR (下)谱图
对硝基苯甲醛核磁表征和质谱检测数据为:1H NMR (400 MHz, Chloroform-d)δ: 10.09 (s, 1H),8.44-8.19 (m, 2H), 8.11-7.86 (m, 2H);13C NMR (100 MHz, Chloroform-d)δ: 190.29, 151.14, 140.05,130.49, 124.32;MS(EI)m/z: 152.03{[M+H]+}。
对甲氧基苯甲醛核磁表征和质谱检测数据为:1H NMR (400 MHz, Chloroform-d)δ: 9.86 (s, 1H),7.82 (d,J= 7.6 Hz, 2H), 6.98 (d,J= 7.7 Hz, 2H), 3.86 (s, 3H);13C NMR (100 MHz, Chloroform-d)δ191.21, 164.85, 132.35, 130.19, 114.73, 54.42;MS(EI)m/z: 137.06{[M+H]+}。
通过高效液相色谱可以看出,通过该体系氧化所得的苯甲醛纯度较高,见图5。
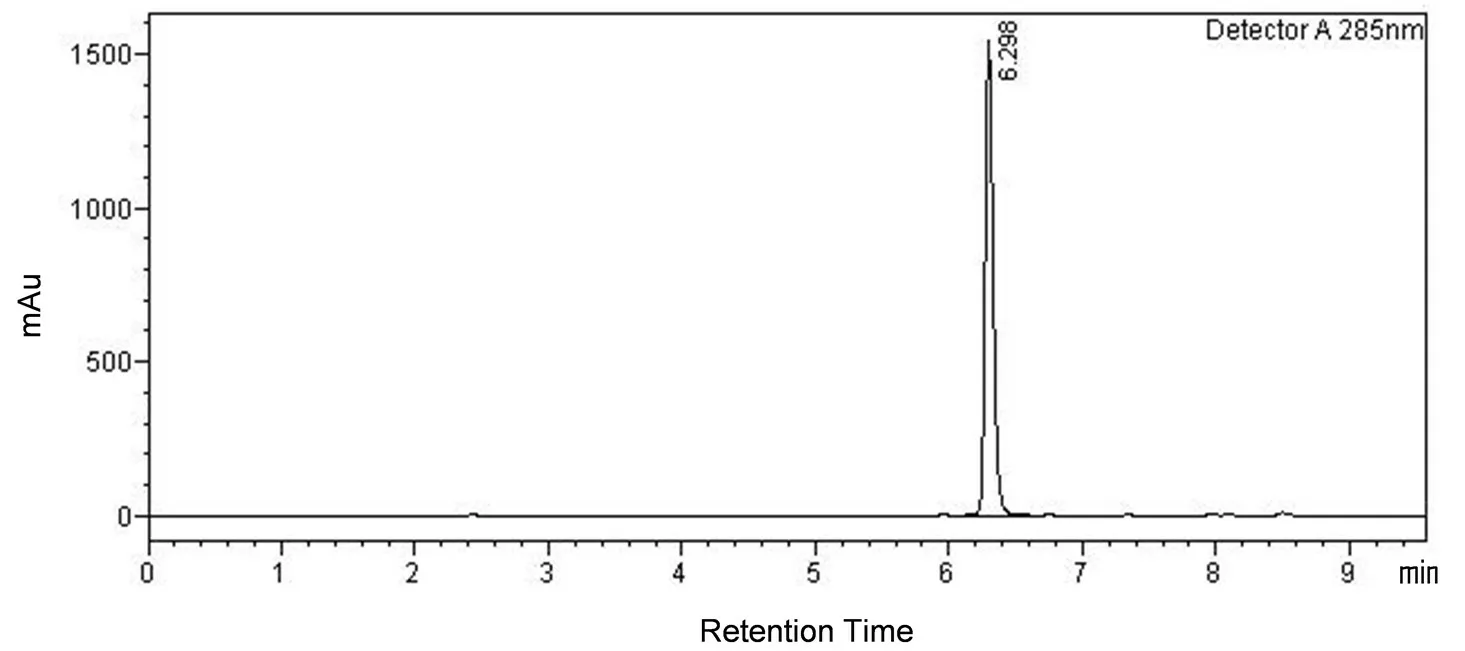
图5 苯甲醛HPLC谱图数据
4.3 反应机理讨论
以苯甲醇为例,反应催化循环如图6所示[9]。
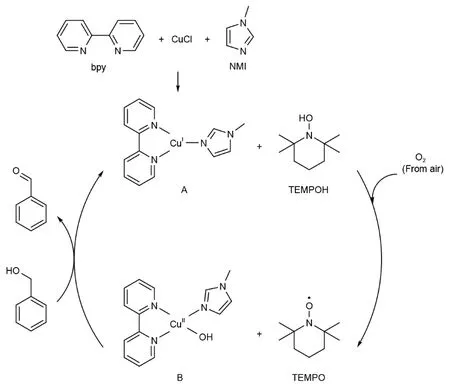
图6 反应催化循环图
由图6可知,反应分为两个阶段:三配位Cu(I)配合物A被空气氧化阶段和四配位Cu(II)配合物B与TEMPO协同氧化芳醛阶段。首先,CuCl与bpy和NMI结合,生成红棕色Cu(I)配合物[Cu(bpy)(NMI)]+Cl-(A),随即开启催化循环反应。在循环的第一阶段,A中Cu(I)被空气中的氧气氧化成Cu(II),同时TEMPOH 被氧气氧化生成TEMPO 自由基和氢氧根OH-,两者结合生成绿色的四配位[Cu(bpy)(OH)(NMI)]+Cl-(B)。在第二阶段,B和TEMPO协同将苄醇快速氧化得到芳醛,自己被还原得到红棕色的A和TEMPOH,完成催化循环。A与TEMPOH在氧气作用下继续催化循环反应,直至苄醇被消耗完全,反应完成,A被完全转化为四配位配合物B,溶液变为绿色。
在第二阶段中,苄醇底物PhCH2OH与四配位Cu(II)配合物B发生配体交换反应,苄氧负离子取代氢氧根,生成中间体C,同时释放出一分子水。该反应涉及苄位醇与铜中心体的配体交换,TEMPO自由基氧原子进攻中间体C中的苄位氢原子,生成TEMPOH和配合物C中苄位碳自由基,同时C中的Cu—OBn键发生均裂,得到催化物种A和氧自由基,此时原反应底物苄醇中碳-氧上双自由基两成单电子形成π键,生成芳醛。A完成该催化循环后在氧气氧化下进行下一次催化过程,直至底物芳基苄醇被消耗完全,催化剂A完全被氧化停留到B状态,反应完成(如图7所示)。
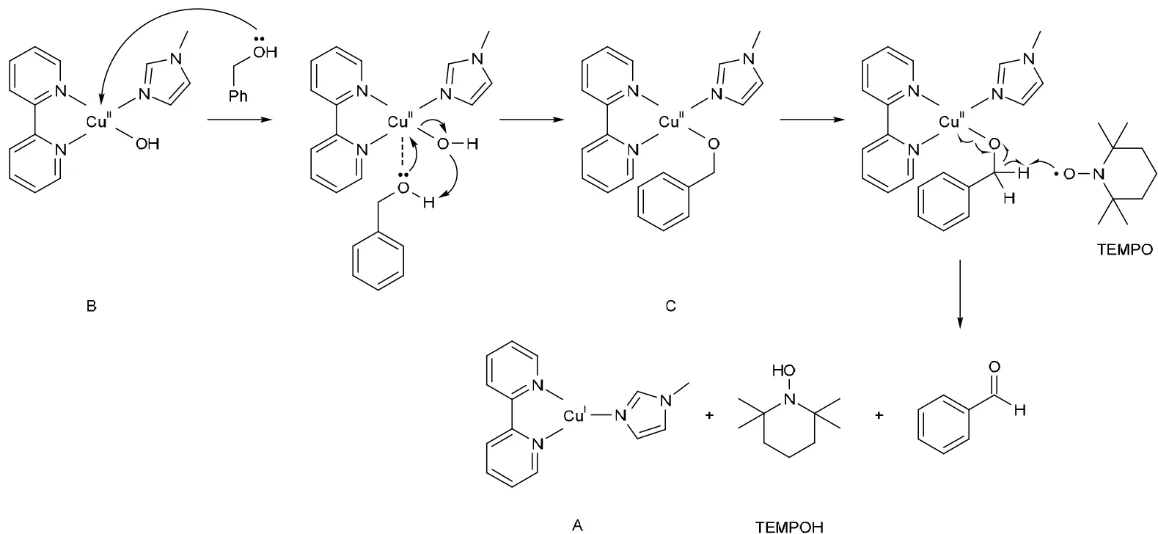
图7 Cu(I)/TEMPO催化氧化苯甲醇机理
5 结语
本文结合金属有机催化化学新方法,创立了金属催化空气氧化苄醇合成芳醛的新综合化学实验。通过实验条件优化,找到了催化体系配体-金属最优比例以及催化剂用量。应用催化反应循化图讨论催化机理,理解实验可通过反应体系颜色突变方便判断反应终点。本合成化学实验综合运用催化化学前沿理论,通过基础合成实验相关操作完成实验,实验独立完成,总时长大约6 h。启发学生自行设计实验方案考察不同反应参数(如换用不同溶剂、改变金属-配体比例、采用不同含氮配体等)的影响,结合红外波谱谱图收集与分析、核磁谱图的解析,有效培养学生的综合化学实验能力,激发学生的科研热情。
(1) 以CuCl/TEMPO催化空气氧化苄醇制备芳香甲醛,条件优化为:苄醇270 mg (2.5 mmol),丙酮20 mL,CuCl 35 mg (0.35 mmol),bpy 40 mg (0.25 mmol),NMI 25.6 mg (0.30 mmol)和TEMPO 40 mg (0.25 mmol),反应在100 mL广口锥形瓶中进行,室温反应约20 min即可完成。该优化条件进行8次平行试验,收率稳定在79%-84%范围。通过底物拓展,实验对缺电芳醛(对硝基苯甲醛)和富电芳醛(对甲氧基苯甲醛)都给出很好收率(77%-83%)。
(2) 该反应避免了高污染重金属催化体系和刺激性氧化试剂的使用,反应绿色环保,同时使用空气为氧化源,大大降低了实验成本。反应条件温和,没有过度氧化至苯甲酸,选择性高。实验操作简单,现象明显,实验成功率高。
(3) 实验加深了学生对催化氧化反应的理解,同时通过TLC检测、萃取、蒸馏等操作的有效训练,提升学生相应的实验操作技能和实验思维能力。
6 实验创新性
6.1 安全环保、成本低廉
本实验以Cu(I)/TEMPO及含氮配体为催化剂,空气作为氧化剂催化氧化苄醇为芳醛,避免使用刺激性氧化试剂和高污染重金属氧化试剂,实验安全环保;通过优化实验条件及试剂用量,能将实验试剂成本控制在少于1.0元/次,实验运行成本低廉。
6.2 选择性好、收率理想
本催化反应产物停留在苯甲醛的阶段,没有过度氧化产物苯甲酸生成,反应选择性好;实验通过三位同学8次平行独立实验验证,产率稳定在78%-81%之间,实验收率理想。
6.3 现象明显、操作简单
含氮配体bpy与NMI组合催化反应,反应过程中体系颜色由红棕色突变为绿色,指示反应终点;实验产品纯化简单,通过萃取、分液、洗涤、干燥和常温减压蒸除溶剂,即可得到高纯度氧化产物,操作简单;进一步减量反应,实验可实现微型化。

