酚酞指示剂变色原理的计算化学实验研究
贾智慧,邢惠萍,李玉虎
陕西师范大学材料科学与工程学院,西安 710119
1 引言
酚酞是一种最常见的酸碱指示剂,其变色反应是典型的有机化学反应,也是无机化学课程的基本内容。尽管在中学、大学化学教材定性描述酚酞指示剂遇碱显示红色,在酸性溶液中不显色[1–3],重点强调变色反应的pH范围。由于缺乏定量、直观的信息,学生通常不能全面理解,往往采用死记硬背的机械记忆方式予以学习。在重视创造力和革新的“新工科”背景下,如何在不增加学生线下基础课时的基础上,通过挖掘宏观现象背后化学反应的微观本质来培养学生知识学习、思维锻炼、能力提高等综合目标,让老的知识在这个飞速发展的时代展现新的活力,是目前化学实验教学改革探究的新方向。
2013年诺贝尔化学奖表彰美国三位科学家Martin Karplus,Michael Levitt和Arieh Warshel在开发多尺度复杂化学系统模型方面所做的贡献,评选委员会发表的声明“如今对化学家来说,电脑同试管一样重要,计算机对真实生命的模拟已成为当今化学领域中大部分新研究成果成功的关键因素”肯定了理论与计算化学在化学学科中的作用。近年来,以量子化学计算为基础的计算化学作为阐明反应机理的重要方法,逐步与大学化学教学相结合开展探究式教学模式[4–6],有助于学生加深对化学基本概念和基础理论的理解,将化学教学中较为抽象的内容变得生动和具体,提高学生的课堂兴趣和教学质量。
本文针对无机化学课程中最基础的酚酞指示剂变色反应,设计了一个面向化学专业大三年级本科生的计算化学机理研究探索性实验,在缩短学生集中线下课时的同时(学生可利用课余时间在个人计算机(Personal Computer,PC)上自主完成),形成“课堂-微课题-翻转课堂”的科创培育模式,激发学生的学习兴趣,培养学生举一反三的科研创新能力。本论文应用高斯(Gaussian)程序研究酚酞变色反应历程,通过变色前后紫外-可见吸收光谱变化的宏观现象,引导学生从几何结构、自然布居分析(Natural Population Analysis,NPA)电荷及自然键轨道(Natural Bond Orbital,NBO)多个微观角度来理解酚酞变色反应机理,引导学生感悟计算方法中严密的逻辑关系,并增加数据可视化、获取原子尺度信息,有利于提高学生分析解决问题能力、科学研究能力与动手实践能力,对学生后续的课程学习及日后从事科研工作都有所帮助,为高端技术人才培养提供基础支撑。具体教学内容包括:(1)反应机理讲解;(2)Gaussian 09及GaussView 6.0计算软件介绍;(3)实验内容;(4)上机操作;(5)数据处理和分析;(6)问题思考与讨论。
2 实验软件
高斯程序是计算化学领域应用最普及的程序,它可以进行各种类型的从头算(Ab initio)、半经验(Semi-empirical)和密度泛函理论(Density Functional Theory,DFT)计算,能够预测分子和化学反应的诸多性质,因此具有广阔的应用前景[7]。此外,与之匹配的GaussView软件在建模方面非常便利,而且有PC机版本,初学者很容易使用。本实验采用Gaussian 09及GaussView 6.0软件进行酚酞变色反应的计算化学实验研究。
3 实验内容
图1给出了酚酞指示剂的变色反应。在酸性和中性条件下,酚酞分子结构的中心碳原子为sp3杂化,连接中心碳原子的四条共价键非共平面。酚酞分子是两个苯酚基团连接在异苯并呋喃酮上,分子中包含三个共轭小体系,无法吸收可见光,因此呈无色[8,9]。在碱性条件下,酚酞分子结构的中心碳原子为sp2杂化,连接中心碳原子的三条共价键共平面。酚酞分子发生开环生成醌式结构的二价负离子,该碱性结构是大共轭体系,容易吸收可见光,因此呈红色[8,9]。
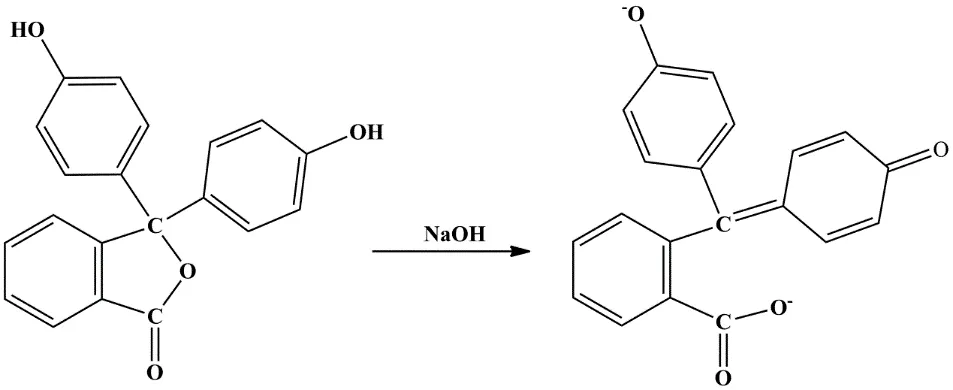
图1 酚酞指示剂的变色反应
4 上机操作
先前文献给出了酚酞分子在中性、酸性和碱性条件下的几何结构[10],即中性和酸性条件下酚酞分子结构为内酯式结构,碱性条件下酚酞分子结构为醌式结构。本实验首先采用GaussView 6.0软件构建酚酞分子,选取B3LYP/6-31+g(d,p)方法对气相酚酞分子进行构型优化和频率计算。通过振动频率分析确认优化后的酚酞分子无虚频,即最稳定分子几何构型。在气相优化几何构型的基础上,选用极化连续介质模型(Polarizable Continuum Model,PCM)考虑了溶剂化效应。通过设置电荷和多重度来区分中性、酸性和碱性的溶剂化效应,中性条件下电荷和多重度分别设置为0和1;酸性条件下电荷和多重度分别设置为1和1;碱性条件下电荷和多重度分别设置为-2和1。所有量子化学计算使用Gaussian 09程序完成[11],自然键轨道分析使用Multiwfn程序完成[12]。
5 数据结果及分析
5.1 紫外-可见吸收光谱
鉴于B3LYP泛函并不是一个可靠的计算电子激发态方法,本文采用TD-CAM-B3LYP方法计算电子激发态,获取酚酞分子在中性、酸性和碱性条件下的紫外-可见吸收光谱。图2给出了TD-CAMB3LYP/6-31+G(d,p)方法获得的酚酞分子在不同条件下的紫外-可见吸收光谱。中性条件下酚酞分子最大吸收峰的位置在248.8 nm,位于紫外区,第一激发能和振子强度分别为3.7812 eV和0.1145。酸性条件下酚酞分子最大吸收峰的位置在271.6 nm,位于紫外区,第一激发能和振子强度分别为2.8330 eV和0.0490。如上所述,中性和酸性条件下的最大吸收峰均不在可见光区,因此酚酞指示剂呈无色。碱性条件下酚酞分子最大吸收峰的位置在540.6 nm,位于可见光区,与实验值540.0 nm接近。第一激发能和振子强度分别为2.2976 eV和1.2521。与中性和酸性条件相比,碱性条件下最大吸收峰位置发生了明显红移,有利于吸收可见光,因此酚酞指示剂呈红色。碱性条件下酚酞分子紫外-可见吸收光谱发生红移的主要原因是碱式结构具有较大的共轭体系。以下笔者将主要从几何结构、自然布居分析电荷和自然键轨道三个方面解释酚酞分子从中性/酸性到碱性结构共轭性增大的原因。

图2 酚酞分子的紫外-可见吸收光谱
5.2 几何结构
图3给出了酚酞分子优化后的几何构型。中性条件下酚酞分子的中心碳原子与邻近碳原子的C―C键长分别为1.532(C1―C2)、1.528(C1―C8)和1.525 Å(C1―C14)(1 Å=0.1 nm),具有典型的碳碳单键特征。苯酚基团中C―C键长约为1.400 Å,C―O键长约为1.370 Å。异苯并呋喃酮中C20―O1和C20=O2键长分别为1.363和1.218 Å。酸性条件下,C1―C2、C1―C8和C1―C14键长几乎不变。苯酚基团中与C2和C8相连的C―C键伸长了约0.020 Å,而毗邻的C―C键缩短了约0.020 Å,C―O键也缩短了约0.030 Å。异苯并呋喃酮中C20―O1键伸长了0.011 Å,C20=O2键长几乎不变。上述结果表明,酸性条件对酚酞分子的几何结构影响较小。碱性条件下异苯并呋喃酮中C1―O1键断裂生成醌式结构。与中性结构相比,C1―C2、C1―C8和C1―C14键长均会有不同程度的缩短,其中C1―C2和C1―C8键长缩短最多(~0.100 Å),其介于典型的碳碳单键和双键之间。醌式结构中的C―C键长为1.435 Å,其要比相应中性条件下的C―C键伸长约0.030 Å,C=C和C=O键长分别为1.373和1.270 Å,它们要比相应中性条件下的C―C和C―O键缩短约0.020和0.100 Å。羧酸根中的C20―O1和C20―O2键长几乎相等(~1.265 Å)。上述结果表明,碱性条件对酚酞分子的几何结构影响较大,与中性和酸性结构相比,碱性结构的共轭效应明显增强。
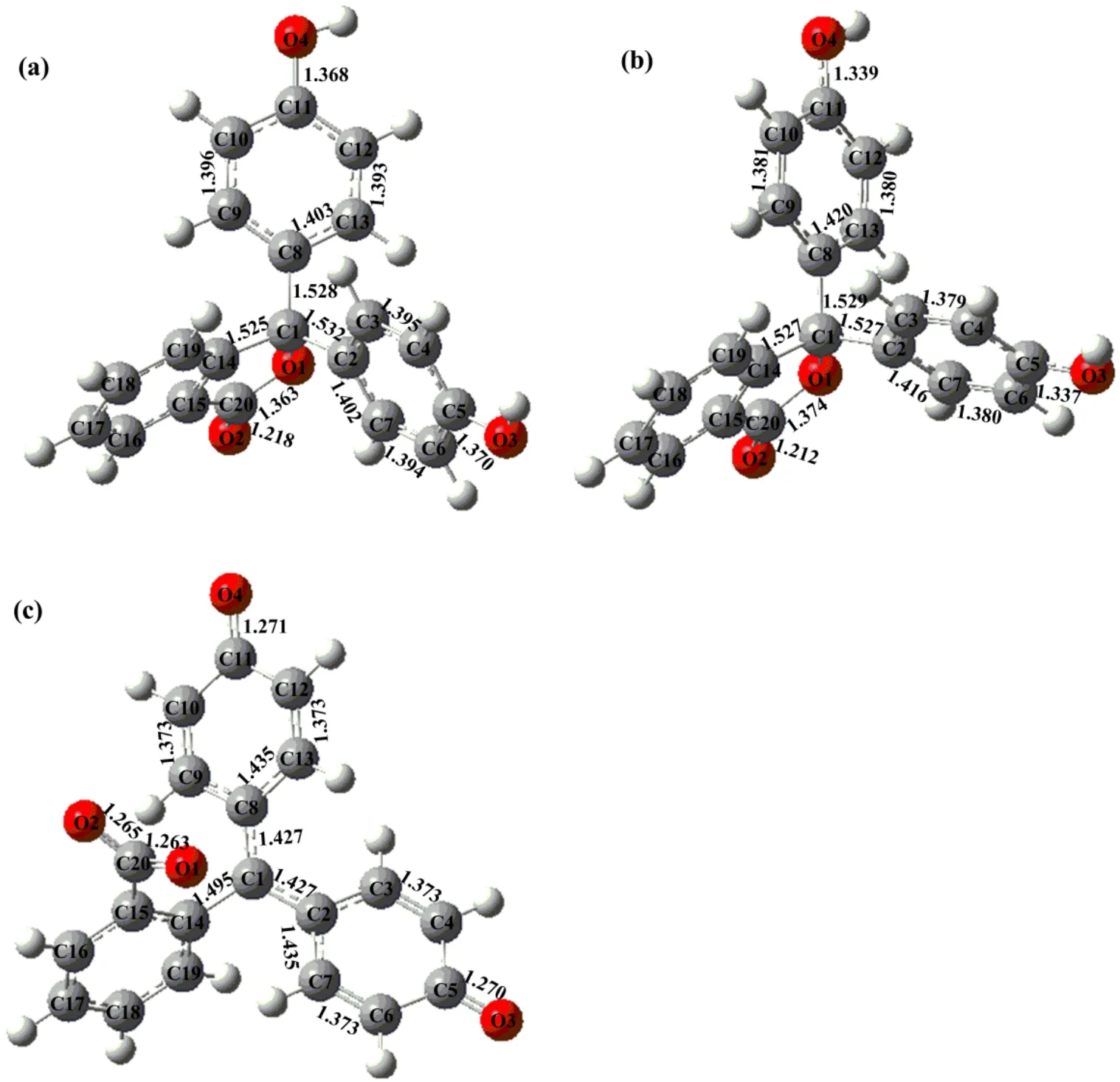
图3 B3LYP/6-31+g(d,p)理论水平上酚酞分子液相优化后的几何构型
5.3 NPA电荷
表1给出了酚酞分子结构的中心碳原子及其附近原子的NPA电荷。中性条件下,中心碳原子的NPA电荷为0.248e(C1),与其相连三个碳原子的NPA电荷分别为-0.087e(C2)、-0.094e(C8)和-0.007e(C14)。异苯并呋喃酮中C20、O1和O2原子的NPA电荷分别为0.801e、-0.550e和-0.576e。苯酚基团中O3和O4原子的NPA电荷均为-0.708e。酸性条件下,中心碳原子C1的NPA电荷为0.236e,其比相应中性条件下的C1原子电荷减少了0.012e。C2和C8原子的NPA电荷分别减少了0.066e和0.108e,而C14原子的NPA电荷增加了0.023e。异苯并呋喃酮中C20原子的NPA电荷几乎不变,O1和O2原子的NPA电荷分别减少了0.016e和0.046e。苯酚基团中O3和O4原子的NPA电荷减少约0.08e。上述结果表明,酸性条件不利于氧原子电荷的积累。碱性条件下,中心碳原子C1的NPA电荷为0.127e,其比相应中性条件下的C1原子电荷减少0.121e。主要原因是C1―O1键断裂后,高电负性的O1原子对低电负性的C1原子作用减弱,使得C1原子电荷减少。与中性分子的电荷相比,C2、C8和C14原子的NPA电荷均有不同程度的增加,其中C2原子的NPA电荷增加最多(0.077e)。异苯并呋喃酮中C20原子的NPA电荷由中性的0.801e减少到碱性的0.749e,O1和O2原子的NPA电荷由中性的-0.550e和-0.576e增加到碱性的-0.747e和-0.764e。苯酚基团中O3和O4原子的NPA电荷增加约0.01e。上述结果表明碱性条件有利于氧原子电荷的积累。
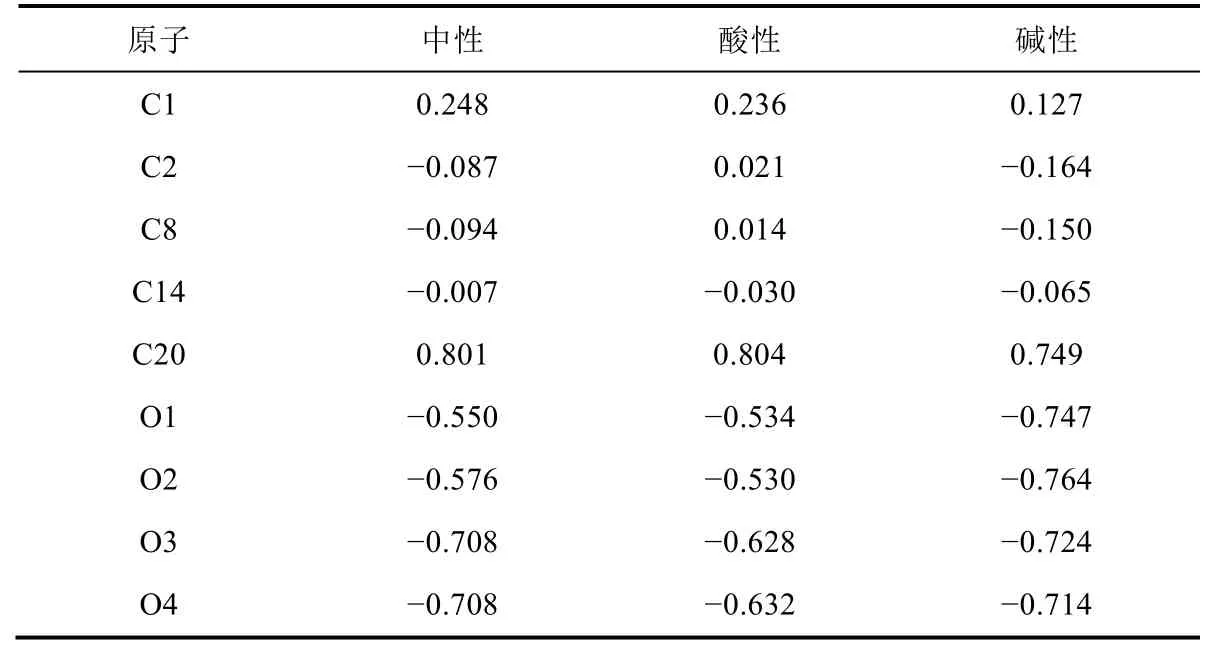
表1 酚酞分子中部分原子的NPA电荷
5.4 NBO分析
使用二阶微扰理论对酚酞分子在中性、酸性和碱性条件下所有可能的给体-受体轨道进行了NBO分析。通过离域化稳定能E(2)的大小来评估每一个给体轨道(Donor NBO(1))与每一个受体轨道(Acceptor NBO(2))相互作用的强弱。如图4所示,中性条件下酚酞分子中苯酚基团的C12―C11反键轨道与C9―C10反键轨道之间有强相互作用,两个轨道重叠相对应的离域化稳定能为984.39 kJ∙mol-1。与中性条件类似,酸性条件下苯酚基团中C4―C5反键轨道与C2―C3反键轨道之间有强相互作用,两个轨道重叠相对应的离域化稳定能为691.37 kJ∙mol-1。上述结果表明中性条件引起的电子离域使酚酞分子具有更大的稳定性。碱性条件下醌式结构中C5=O3反键轨道与C3=C4反键轨道之间有强相互作用,两个轨道重叠相对应的离域化稳定能为814.68 kJ∙mol-1。从π*C5=O3到π*C3=C4的电荷转移有助于共轭体系增大。
6 问题思考与讨论
(1)量子化学计算方法有很多种类,如何选取一种适合于目标体系的研究方法?
(2)其他溶剂化模型(如Minnesota Solvation model,SMD)对酚酞的第一激发能和振子强度有何影响?
7 教学安排
本实验是面向大三年级本科生开设的探索性计算化学实验。需8学时完成,包含:(1)简要介绍量子化学基础(1课时),线上讲授微观粒子的运动特征、量子力学基本假设和箱中粒子的薛定谔方程及其解;(2)介绍GaussView 6.0软件的使用方法,输入文件的编制(2学时),即完整的输入文件应包括命令行、计算执行命令行、标题行、电荷、多重度和分子坐标;(3)介绍Gaussian 09程序的使用方法,如何调用Gaussian 09程序来进行任务计算(1学时);(4)如何阅读高斯计算的输出文件(1课时),每个Link对应不同的部分,如Link 101读入输入文件,Link 202判断体系对称性,Link 301产生基组信息。教师边讲解边上机演示,并录制实验视频,以便课后复习查阅;(5)根据学生掌握量子化学基础知识的基本情况来编排小组,每个小组5–7人为宜,并设置两名组长。在充分理解本实验知识内容的基础上,完成问题思考与讨论部分提出的两个问题,并让学生尝试自主完成拓展实验——甲基橙的变色反应实验(2课时);(6)角色翻转。各小组录制实验视频,选出一名学生讲解,并通过反应模型的搭建、酚酞分子的构建、输入文件的编写、高斯程序的调用、紫外-可见吸收光谱的绘制等指标来进行小组间的互评(1课时),将互评结果上传教学平台,教师进行评阅。教学安排中(1)–(4)是线上课堂完成,(5)–(6)是线下微课题-翻转课堂完成。
8 实践效果
学生综合能力的培养是“以学生为中心”教育理念的实质。如何引导学生在学习特定基础知识的同时提升自身的综合素质是课程教学改革探索的方向。通过在课堂中不断尝试研究型教学、问题导向型教学等多种教学模式的改革探索,兼顾化学的基础性、前沿性和交叉性,理论与实践相结合,结合教师科学研究中的内容、技术和方法,引导学生学习和实践新内容和新方法,促进了学生解决实际问题以及创新能力的培养[13,14]。
本实验课将量子化学与无机化学实验融合,以最基础的酚酞变色反应的理论计算化学为切入点,一方面引导学生利用先进、前沿的科学研究手段探究宏观现象背后更深层的微观机制,通过补充交叉领域的背景知识或前沿进展,激发学生探索意识,开拓创新思维;另一方面培养学生的学习迁移能力,不断提升学生自主思考和举一反三的应用实践能力,通过进行课堂分组的知识拓展,锻炼学生查阅文献自主学习能力、自主探究能力、团队协作能力、表达能力和实践能力。实践结果表明,该计算化学实验课不占用线下教学时间,学习时间灵活,具有较好的普适性,学生能够顺利地完成实验并且小组高效协作,受到了学生好评。本实验教学方法的探究打通从被动的常规知识学习到主动科研探索训练的本科生培养环节,形成“课堂-微课题-翻转课堂”的人才科创培育模式,有望在教学改革与科研创新方面均取得较好成效。

