不同氮源处理对4 个木薯品种幼苗生长发育的影响
赵金铃,潘晋龙,吴宇垚,韩昊祥,张怀方,陈 新,曾长英
(1. 海南大学 热带作物学院,海口 570228; 2. 中国热带农业科学院 热带生物技术研究所,海口 571101)
氮素是一种重要的常量营养元素,同时也是一种限制元素,对植物的生长发育起着重要的作用[1-2],土壤中的氮素主要以硝态氮(NO3-)和铵态氮(NH4+)的形式被植物吸收[3-4]。硝态氮为负电荷,在土壤中易随水流失,需要消耗还原力形成铵态进一步形成氨基酸以参与植物细胞生化过程及生理代谢。铵态氮为正电荷,本身是还原态氮,可以融合有机酸,形成氨基酸,但它们具体的作用条件和施用效果与不同的作物及种质有关。我国木薯(Manihot esculenta)多种植于贫瘠的地方,其土壤中的氮素分布不足且不均匀,需要外施氮肥来确保木薯的产量和品质[5-6]。木薯在农业生产中管理相对粗放,薯农通过种植高产的新品种及施用化肥来提高产量,而在木薯的生产过程中大多主要考虑通用复合肥或单质化肥的施用量,通常忽略氮磷钾的营养配比、不同木薯种质对养分需求的差异以及对氮源喜好性不同。目前对木薯氮素利用的研究大都集中于氮磷钾平衡施肥或施氮对木薯养分积累和块根品质提高的影响,且对木薯氮素利用效率的研究也往往集中在单一氮源的种质鉴定和筛选上[7-9],但是不同木薯品种对氮源的喜好性存在一定的差异,而对不同氮源响应方面的研究相对较少且滞后。因此,本研究选取4 个常见的木薯品种作为试验材料,分析不同氮源(无氮、硝态氮、铵态氮)处理对不同木薯品种生理特性的影响,利用基因型差异开展木薯种质对不同氮源吸收偏好性的研究,致力于优异种质资源筛选及品种的遗传改良,同时,也能在生产上为木薯的针对性氮源施肥提供理论指导。
1 材料与方法
1.1 试验材料选取‘CH16’、‘SC16’、‘SC205’、‘17Q’等4 个木薯品种作为供试材料,其中‘CH16’和‘17Q’为国外引进品种,‘SC205’为国内主推品种,‘SC16’为‘SC205’和国外引进品种‘Q10’的杂交品种。木薯种茎均来自于中国热带农业科学院生物技术研究所澄迈基地。栽培基质为椰糠与贫营养土的混合物(V椰糠∶V贫营养土= 1∶1.5)。
1.2 试验地概况试验地点为海南大学农学试验基地(35°41′N,109°43′E),该地区为热带季风性气候,年均温度为23~29 ℃,年平均降水量在2 000 mm 左右,年平均日照时数2 000 h 以上(来源于海南省气象局,http://hi.cma.gov.cn/)。试验田面积约为16 m2,在实验田中起垄,按照品种进行木薯种茎种植,每2 天浇1 次水,不额外施肥,待木薯生根且根系生长到10~15 cm 后移栽至装有栽培介质的营养钵(规格:9 cm×9 cm×32 cm)中以便后续试验。
1.3 试验设计试验周期为40 d,木薯处于幼苗期。参考已有的木薯高低氮处理相关研究[10-11],木薯施用营养液的正常氮素投入量一般认定为3~5 mmol·L-1,因此,本试验设置营养液的浓度为3 mmol·L-1。共设置3 个不同的氮源处理:减氮均质处理(-N)、硝态氮均质处理(3 mmol·L-1NO3-)、铵态氮均质处理(3 mmol·L-1NH4+);其余营养元素按照H.C 阿夫道宁营养液配置(NaH2PO4·H2O 0.0633 g·L-1,Na2HPO4·12H2O 0.0633 g·L-1,KCl 0.110 g·L-1,CaCl20.2327 g·L-1,MgSO4·7H2O 0.3433 g·L-1)[12]。木薯幼苗移栽后,每2 天浇1 次水,5 d 浇1 次营养液。
1.4 项目测定及方法样品采集与形态指标测定:将木薯从土壤中取出后,轻轻抖落根系附着的泥土,用卷尺对木薯株高进行测量;随后,分别取木薯的根、茎、叶,装入已写好标记的牛皮纸袋中,取完样品后即刻对根、茎、叶进行质量测定;测定完成后,将茎和叶暂放冰箱保存,对根进行根系扫描,扫描仪器为 EPSON Expression 12000XL(USB)。待扫描完成后,将所有样品放进烘箱,先105 ℃杀青40 min,再于80 ℃下烘至恒重,烘干后的样品立刻进行质量测定和氮含量测定。
木薯氮含量测定:准确称取已杀青并烘干打碎的木薯各部位样品0.1000 g 于消煮管中,用浓H2SO4-H2O2消煮法进行消化,最后采用纳氏试剂比色法测定溶液吸光度[13],计算各部位氮素含量。其计算方法分别为:氮积累量等于氮含量乘以干质量;木薯各器官氮素分配比例等于该木薯各器官的氮素积累量除以植株氮素积累量再乘以100%;氮素生理利用效率(NPUE)等于干物质重除以氮积累量;氮效率系数(NEC)等于缺氮均质处理下全株氮素积累量除以硝态氮(铵态氮)均质处理下全株氮素积累量。
1.5 数据处理使用Excel 2021 进行汇总作图,使用SPSS Statistics 23 进行差异性显著分析。
2 结果与分析
2.1 不同氮源处理对4 个木薯品种幼苗生长情况的影响如图1-a 和图1-b 所示,NO3-和NH4+处理后,4 个木薯品种的整体长势均优于-N 处理。其中,NH4+处理下的‘17Q’和‘SC205’的生物量增加最显著,而‘CH16’和‘SC16’在NO3-处理下生物量高于NH4+处理,说明外施氮源能够显著促进木薯生物量的累积,并在不同品种间存在偏好性。
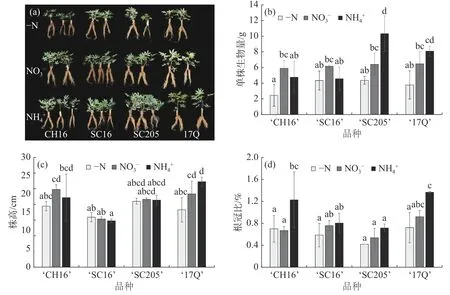
图1 不同氮源处理对4 个木薯品种幼苗生长情况的影响
结合图1-c 和图1-d 分析,在NH4+处理下,‘17Q’株高增加,根冠比变大,从而导致生物量显著高于-N 处理,说明‘17Q’的地上部和根系是同步增长;而‘SC205’株高和根冠比与-N 处理相比没有差异,但是生物量最大,结合形态特征分析发现,生物量增大的原因是叶面积和根面积同步增加。有趣的是,‘SC16’的生物量在-N 处理与2 种氮源处理之间没有显著性差异,说明‘SC16’在幼苗期对施氮响应不敏感,或具有较高的耐低氮能力。
2.2 不同氮源处理对4 个木薯品种幼苗根系形态的影响根系的发育情况会影响整个植株的生长状态,根系从土壤中吸收养分,并传送到茎叶等部位,供给植株地上部的生长,而地上部长势良好有利于植株根系的发育。通过根系扫描对4 个木薯品种的总根长、平均根茎、总根表面积、总体积等进行测定,结果如图2 所示。从图2 可知,NO3-处理能够促进‘CH16’和‘SC16’根长、根表面积和根体积的增加,NH4+处理能够促进‘SC205’和‘17Q’根长、根表面积和根体积的增加,但这种促进作用均不显著,可能是由于氮浓度差异不大造成的;不同氮源处理对4 个木薯品种的平均根茎没有显著的影响,最大的根茎为0.68 mm,最小的为0.57 mm。以上结果表明,外加氮源对木薯根系发育的促进作用是通过增加根系的长度和分支来实现的,根系直径没有显著变化;4 个木薯品种中,施加NO3-有利于‘CH16’和‘SC16’的根系发育,施加NH4+有利于‘SC205’和‘17Q’的根系发育。
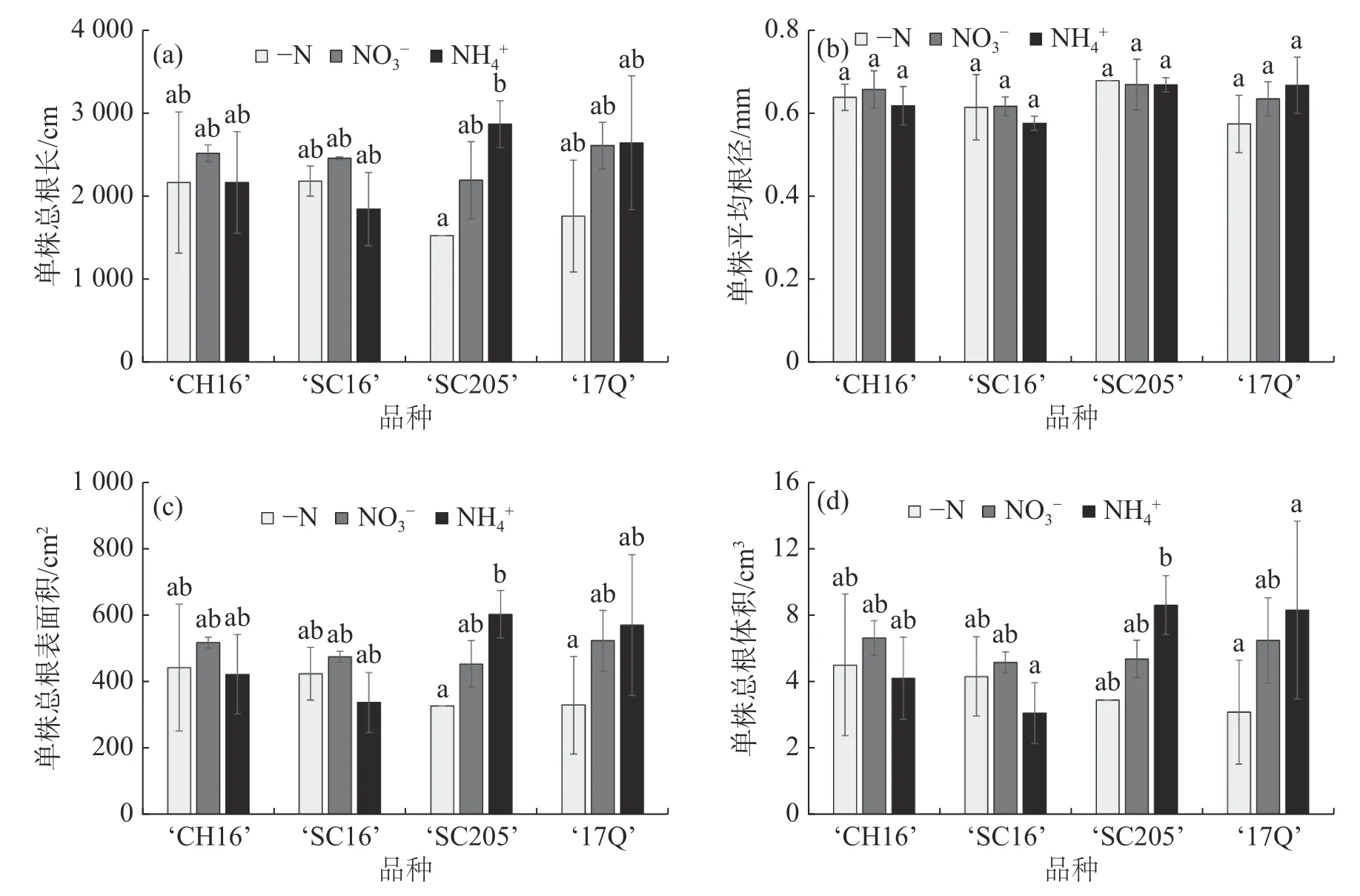
图2 不同氮源处理对4 个木薯品种幼苗的根系形态的影响
2.3 不同氮源处理对4 个木薯品种幼苗(根茎叶)氮含量的影响如图3-a、图3-b 和图3-e 所示,-N 处理后,‘CH16’和‘SC16’根、叶及全株的氮含量显著低于NO3-处理和NH4+处理,2 种氮源间比较,‘CH16’和‘SC16’的全株总氮含量没有显著性差异,说明,外施氮源施能够促进‘CH16’和‘SC16’氮含量的累积,但2 种氮源间无显著差异;从图3-c和图3-e 可知,相比于NO3-处理,‘SC205’叶的氮含量要高于-N 处理和NH4+处理,在茎中的氮含量低于-N 处理和NH4+处理,在根中的氮含量高于NH4+处理,略低于-N 处理,单株总氮含量显著高于-N 处理和NH4+处理,说明,施加NO3-有利于‘SC205’氮含量的累积;从图3-d 和图3-e 可知,-N 处理后,‘17Q’根和茎中的氮含量均低于NO3-处理和NH4+处理,在叶中的氮含量远高于NO3-处理和NH4+处理,分别为NO3-处理和NH4+处理的1.62 倍和2.39 倍,全株总氮含量显著高于NO3-处理和NH4+处理,表明‘17Q’是一个耐低氮品种,在-N 条件下叶片的氮含量高,根中的氮含量低,根系吸收的氮素优先转移到叶片中,促进叶片的生长,可能是对低氮胁迫的一种应对策略和适应机制。整体来看,3 种不同氮源处理后,4 个木薯品种各部位的氮含量从大到小依序为叶、茎、根,表明根系吸收的氮素大部分转移到了叶中,少部分转移到了茎中。
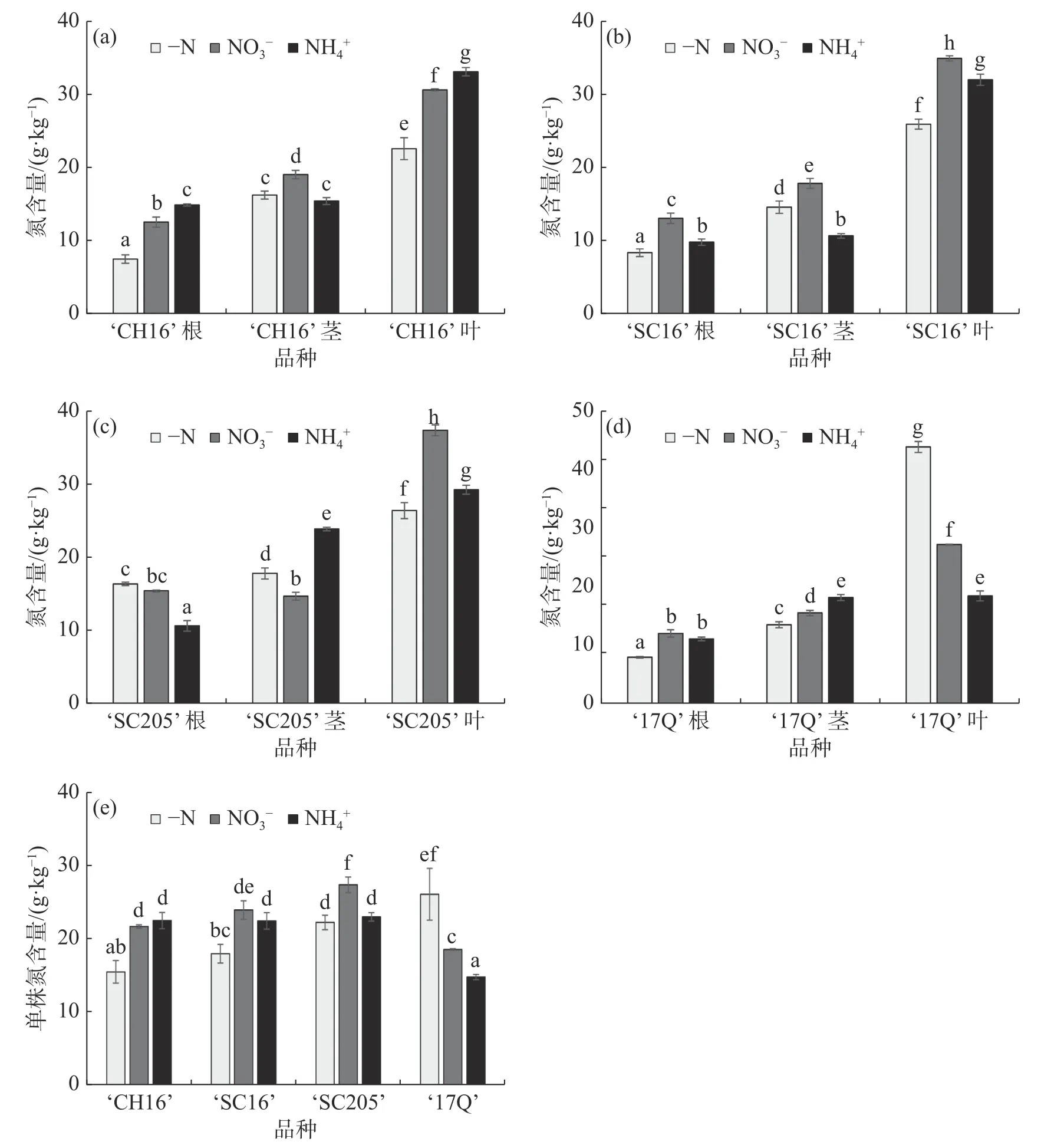
图3 不同氮源处理对4 个木薯品种幼苗氮含量的影响
2.4 不同氮源处理对4 个木薯品种幼苗氮积累量和各器官氮素分配比的影响从表1 可知,-N 处理后,‘SC16’、‘SC205’、‘17Q’的总氮积累量显著高于‘CH16’,表明‘CH16’是一个低效吸收品种;‘CH16’的总氮积累量远低于NO3-处理和NH4+处理,但NO3-处理和NH4+处理之间不存在显著性差异,表明,氮源的差异对‘CH16’的氮积累量没有显著影响,且‘CH16’是一个不耐贫瘠的木薯品种;‘SC16’的总氮积累量从大到小依序为NH4+、NO3-、 -N,其中根和茎的氮素分配比例最大的皆是NO3-处理,分别为22.23%和9.16%,叶的氮素分配比例最大的是NH4+处理,为80.5%,表明NH4+处理促进‘SC16’氮素向叶片的转运;‘SC205’的总氮积累量从大到小依序为NH4+、NO3-、-N,且不同处理间差异显著,NH4+处理是-N 处理和NO3-处理的2.75 倍和1.54 倍,相比于NO3-处理,NH4+处理茎的氮素分配比更大,根和叶的氮素分配比略小,表明,‘SC205’是一个喜铵品种,且铵态氮能够促进‘SC205’茎的生长;‘17Q’的总氮积累量从高到低的顺序为NH4+、NO3-、 -N,不同处理间无显著性差异,根部和茎部氮素的分配比从大小的依序为NH4+、NO3-、-N,叶片氮素的分配比相反,从大到小依序为-N、NO3-、 NH4+,表明缺氮条件下‘17Q’吸收的养分会优先供给叶片生长,正常氮条件下,会优先供给根系生长;整体来看,不同氮源处理下4 个木薯品种各器官的氮积累量高低顺序均为叶、根、茎,表明氮源的差异不影响木薯营养分配的优先顺序。
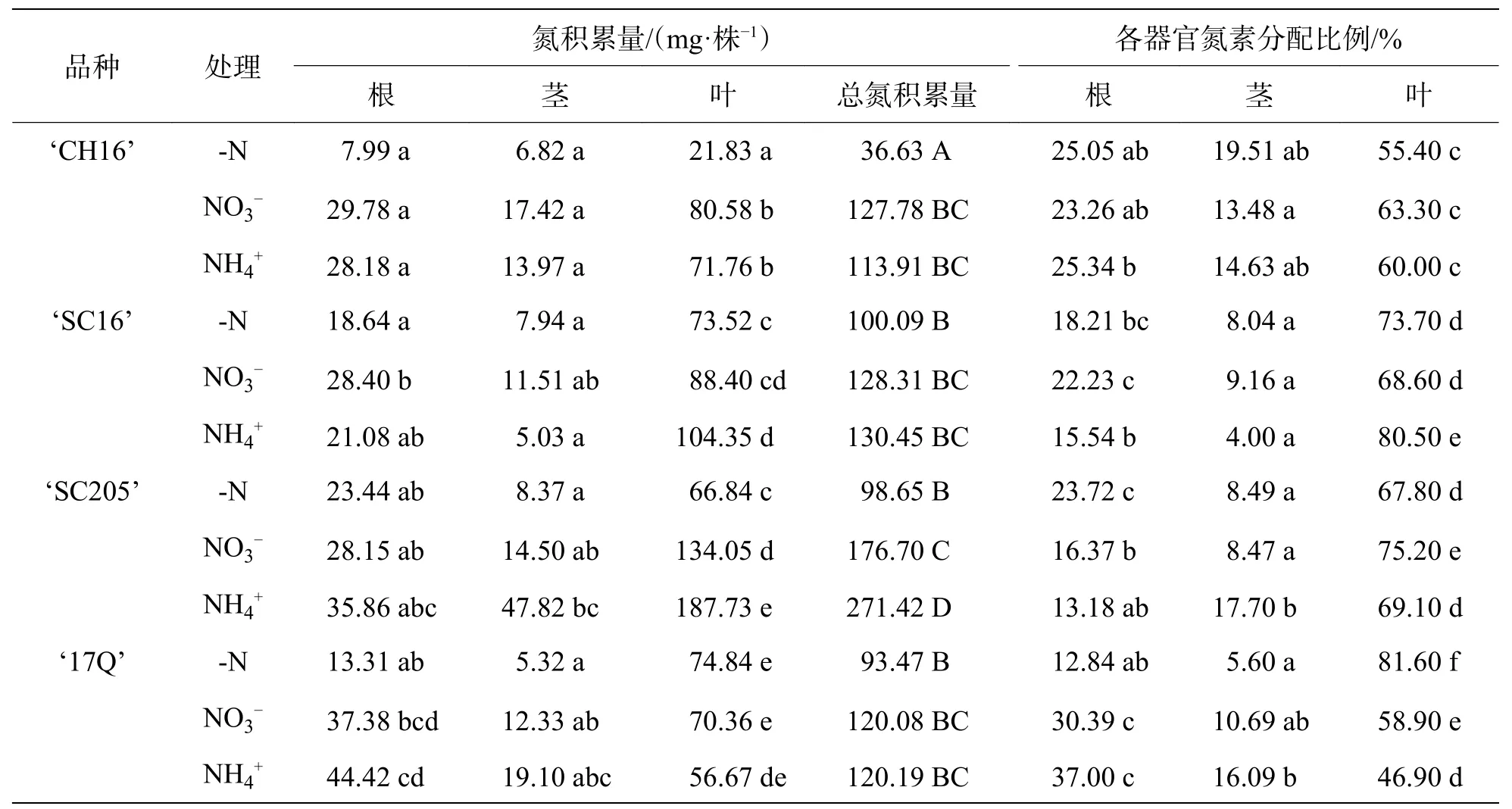
表1 不同氮源处理下4 个木薯品种幼苗的氮积累量和各器官分配比
2.5 不同氮源处理对4 个木薯品种幼苗氮效率系数和氮素生理利用效率的影响氮效率系数可反映不同木薯品种耐低氮胁迫能力,氮效率系数越大说明该品种耐低氮胁迫能力越强。从表2 可知,无论是NO3-处理,还是NH4+处理,4 个木薯品种的氮效率系数大小排序均为‘17Q’、‘SC16’、‘SC205’、‘CH16’,说明‘17Q’和‘SC16’的耐低氮胁迫能力相对较强,是氮高效品种,‘SC205’和‘CH16’的耐低氮胁迫能力相对较弱,是氮低效品种。在氮素生理利用效率方面,-N 处理后,‘CH16’和‘SC16’的氮素生理利用效率高于另外2 个品种,施氮后的NPUE,除‘17Q’外,其他3 个品种均下降,2 种氮源间的NPUE 差异不显著;‘SC16’和‘SC205’的氮素生理利用效率从高到低的排序均为-N 、NH4+、NO3-,‘SC16’对2 种氮源的NPUE差异不显著,而‘SC205’对铵态氮的利用显著高于硝态氮;‘17Q’的氮素生理利用效率从高到低的排顺序为NH4+、NO3-、-N,也是对铵态氮的利用效率高于硝态氮。

表2 不同列的不同小写字母表示4个品种不同处理间的差异显著(P<0.05)。
3 讨 论
在农业生产中,外施氮肥只有30%~50%能够被作物利用,剩余的都流失在土壤中,对环境造成污染,从而造成氮素利用效率(NUE)很低。在不同品种的木薯中,对硝态氮和铵态氮的氮素利用效率存在一定的差异,进而影响到木薯的根系发育,有研究表明,养分高效品种的根系比低效品种的根系发达[14],这与本试验的结果一致。‘SC205’在NO3-处理下的总氮积累量和氮素生理利用效率均小于NH4+处理,单株氮含量却大于NH4+处理,表明‘SC205’对硝态氮的氮素利用效率较低,对铵态氮的氮素利用效率相对较高。本研究中,‘SC205’和‘17Q’的总氮积累量和氮素生理利用效率经NH4+处理后相对较高,而NO3-处理后相对较低,即铵态氮的氮素利用效率相对较高而硝态氮的氮素利用效率较低,其中‘17Q’对2 种氮源的吸收能力没有显著差异,且是4 个品种中氮效率系数最高的品种,表明是耐低氮能力最强的品种。相反,‘CH16’对硝态氮和铵态氮的利用效率无显著差异,耐低氮能力最弱;有研究表明,通过施肥提高土壤养分含量能够提高氮素在根部的分配而降低叶片的氮素分配[15-16],本试验中‘CH16’恰恰相反,-N 处理后,其总氮含量和根中分配比例显著低于‘SC205’、‘17Q’、‘SC16’,而在根茎中的分配比例分别为25.05%和19.51%,高于其他品种,即吸收的氮截留在根系的比例较高,转运到地上部的效率较低,表明‘CH16’不耐贫瘠,在-N 条件下的氮吸收能力较弱,吸收的氮素优先供给根系生长。‘SC16’在-N 条件下的氮吸收能力最强,对施氮的响应不显著,耐低硝能力仅低于‘17Q’,耐低铵能力与‘17Q’相当。总的来说,‘17Q’和‘SC16’的耐低氮胁迫能力相对较强,是氮高效品种,‘SC205’和‘CH16’的耐低氮胁迫能力相对较弱,是氮低效品种。
有研究表明,高铵对植物有毒害作用,而适量浓度铵的投入对植物的生长有促进作用,能够增强植物的抗逆性,不同植物的耐高铵阈值也各不相同[17-18],这与本试验的结果一致,相比于-N 处理和NO3-处理,单独的NH4+处理,对木薯的整体长势有促进作用,主要表现为根冠比的增大、生物量的增加以及根系形态的发育,其中,‘SC205’的表现最为显著。不同作物对硝态氮和铵态氮的喜好性差异很大[19],如枳橙(Citrus×insitorum)、小麦(Triticum aestivum)等喜欢硝态氮[20-21],而枇杷(Eriobotrya japonica)、槟榔(Areca catechu)幼苗等更喜欢铵态氮[22-23]。本试验结果表明,同一作物的不同品种对硝态氮和铵态氮的喜好性也存在显著差异,如‘SC205’和‘17Q’更喜欢铵态氮,而‘CH16’和‘SC16’对硝态氮和铵态氮则没有明显的偏好性,木薯的这一特性在其他作物中是否也是类似的情况值得研究。本试验为后续发掘硝态氮(铵态氮)高效利用基因型中的相关基因及解析其机理,为其他作物氮素利用基因型差异的研究提供参考。同时,不同氮素氮效率的区分有利于木薯农业生产中针对性地进行施肥管理,氮素肥料指导和推荐。

