不同培养温度的鱼源海豚链球菌转录组分析
贾新蕾,黄增朝,杨林狄,吕 静,李妍萍,简纪常,黄郁葱
(1. 广东海洋大学 水产学院/广东省水产动物病害防控与健康养殖重点实验室,广东 湛江 524088;2. 南方海洋科学与工程广东省实验室(湛江),广东 湛江 524006)
海豚链球菌(Streptococcus iniae)是一种重要的水生动物致病菌,1976 年Pier 等[1]从亚马逊江豚(Inia geoffrensis)中首次分离获得,之后陆续发现它可感染除南极洲以外的所有鱼类[2]。我国也有海豚链球菌感染卵形鲳鲹(Trachinotus ovatus)[3 - 4]、尼罗罗非鱼(Oreochromis niloticus)[5-6]、鲟鱼(Acipenser sinensis)[7 - 8]、银鼓鱼(Selenotocamultifasciata)[9]、小黄鱼(Larimichthys polyactis)[10]、黄鳍鲷(Acanthopagrus latus)[11]等发病的相关报道。海豚链球菌具有感染宿主范围广、传染性强、导致死亡率高等特点,给养殖业造成巨大的经济损失,并受到了国内外水产行业工作者的高度关注。
海豚链球菌病的暴发除了与病原菌本身的毒力有关,一些环境因子在疾病发生发展过程中亦发挥重要作用,如温度、pH 值等[12],尤其是养殖的环境温度与该病的发生呈现比较明显的相关性,发病时水温通常在27 ℃以上[13]。祝璟琳等[14]开展的流行病学研究表明,在32 ℃以上的温度下罗非鱼更容易爆发链球菌病,罗非鱼免疫力在高温条件下受到明显的抑制[15],链球菌对宿主的粘附、定植、入侵和抵抗免疫清除能力明显增强[16 - 17]。同时,较高温度时海豚链球菌产生的胞外产物中可能含有较多致病因子,从而影响细菌毒力[18],尼罗罗非鱼在感染海豚链球菌后其肝脏、肾脏在高温时病理损伤更严重[19]。以上研究均表明在较高的温度下病原链球菌的毒力显著增强,从而引起链球菌病的爆发。
转录组测序(RNA-Seq)技术是一项能够检测有机体整体转录水平的新兴技术手段,目前已有学者利用转录组技术研究细菌的毒力调控。如:Li 等[20]利用RNA-seq 技术分析了提高温度和营养成分对副溶血性弧菌毒力的影响,结果发现温度和营养成分的提高可显著提高副溶血性弧菌的毒力;王松艳[21]对不同温度下培养的无乳链球菌进行转录组测序,筛选出7 个毒力相关基因;师若萍[22]运用高通量RNA 测序和非靶向代谢组学的研究方法,探究大肠杆菌在不同温度下的生长及其在转录和代谢水平的变化,了解其对于不同温度的生理调节机制,以上研究结果表明温度可广泛影响细菌毒力和基因的表达。但目前尚未见温度对海豚链球菌致病性的影响以及其基因转录表达的研究报道。卵形鲳鲹是我国海水养殖鱼类中产量位居第二的优良品种,高温期易暴发海豚链球菌病[3-4]。本研究以卵形鲳鲹源海豚链球菌Tozj-1为研究对象,选用RNA-Seq 技术对不同温度(25 ℃和35 ℃)培养的海豚链球菌进行高通量测序分析,筛选差异表达基因,对差异表达基因进行GO 功能和KEGG 通路富集分析,探究温度对海豚链球菌基因转录表达的影响及富集的功能和信号通路,以期为揭示温度与海豚链球菌致病性积累基础数据,为后续进一步研究海豚链球菌的致病机理提供理论依据。
1 材料和方法
1.1 材料本研究测序和试验用菌株Tozj-1来源于广东省水产动物病害防控与健康养殖重点实验室。Tozj-1为实验室于2020 年8 月从广东省湛江市某深海网箱养殖的患病卵形鲳鲹(Trachinotus ovatus)分离获得。分离的菌株经16S rRNA 测序、生理生化鉴定为海豚链球菌(S.iniae),通过人工感染卵形鲳鲹确认其为病原菌,并保存于广东省水产动物病害防控与健康养殖重点实验室。
1.2 方法
1.2.1 生长曲线测定将Tozj-1菌株划线接种于BHI 固体培养皿上,置于28 ℃恒温培养箱中培养24 h。用无菌接种环挑取单个菌落接种于新鲜的无菌BHI 液体培养基,于28 ℃,120 r·min-1下振荡过夜扩大培养。将上述菌液以1∶50(V/V)的比例接种到无菌的BHI 培养基,分别置于25 ℃和35 ℃恒温摇床,150 r·min-1振荡培养,每个温度下设置3 个重复。每隔1 h 取样,测定菌液的吸光值(OD600),并绘制不同温度下的海豚链球菌生长曲线。
1.2.2 人工回归感染试验为了探究不同温度对卵形鲳鲹源海豚链球菌毒力的影响,本研究使用卵形鲳鲹进行体内攻毒试验。实验前,将28 ℃扩大培养的海豚链球菌以1∶50(V/V)的比例接种到新鲜BHI 培养基中,分别置于25、35 ℃恒温摇床中培养至对数生长期(OD600=0.9~1.1),收集菌体,用无菌PBS 缓冲液将菌液稀释至1.0×107CFU·mL-1备用。
将360 尾健康的卵形鲳鲹[体质量(50±6)g·尾]随机分为4 组(2 个实验组和2 个对照组),每组设3 个重复,每个重复30 尾鱼。25 ℃实验组于水温25 ℃饲养,每尾腹腔注射25 ℃体外培养的Tozj-1菌悬液,对照组注射无菌PBS;35 ℃实验组于水温35 ℃饲养,每尾腹腔注射35 ℃体外培养的Tozj-1菌悬液,对照组注射等量无菌PBS。观察攻毒后14 d 内试验鱼的发病情况,记录并统计死亡鱼数量,通过解剖濒临死亡鱼并进行病原分离鉴定,以确定感染病原,鉴定方法同1.1。
1.2.3 总RNA 提取、cDNA 文库构建和高通量测序将28 ℃下培养的菌株Tozj-1以1∶50(V/V)的比例稀释于新鲜BHI 肉汤中,分别于35 ℃和25 ℃条件下培养至对数生长期(OD600=0.9~1.1)。每个温度设置3 个生物学重复。其中,以25 ℃培养的海豚链球菌作为对照组,标记为CK-1、CK-2、CK-3;以35 ℃培养的海豚链球菌作为实验组,标记为Test-1、Test-2、Test-3。每个样品取1 mL 菌液,12 000 r·min-1离心2 min,弃去上清,加入100 μL 溶菌酶,混匀,置于37 ℃裂解15 min,按照Trizol 试剂盒操作说明进行菌体的总RNA 抽提,使用Agilent 2100 生物分析仪评估RNA 质量并通过RNase free 琼脂糖凝胶电泳进行检测,经质量检测合格后纯化总RNA,cDNA 文库构建和转录组测序工作委托广州基迪奥生物科技有限公司完成。
1.2.4 原始数据质控与差异表达基因分析原始数据的存储采用FASTQ 格式,通过fastp[23](https://github.com/OpenGene/fastp)对下机数据进行质量检测和数据过滤,去除原始数据中质量低、接头污染、全部都是A 碱基以及未知碱基N 含量过高的Reads 后最终获得Clean reads。利用工具Bowtie 2[24]建立参考基因组索引,将质控分析后的高质量测序数据比对到海豚链球菌参考基因组SF1(GenBank 登录号CP005941.1)上。采用FPKM 法计算每个注释基因的表达水平,使用FDR 与log2FC 来筛选差异基因,筛选条件为FDR<0.05 且|log2FC|>1。
1.2.5 聚类分析根据每组筛选的差异表达基因,使用R 语言Pheatmap 软件包对差异基因进行双向聚类分析。首先,得到的差异表达基因在GO(The Gene Ontology)数据库中的各个项目进行映射,然后通过GO 功能显著性富集分析[25],在宏观上了解该物种的基因功能分布特征。然后,基于KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库,对每个KEGG pathway 不同层次上存在的差异表达基因数量进行统计,确定这些差异表达基因的主要代谢路径和信号通路[26],进一步了解基因的生物功能。最后,利用超几何学方法,以Qvalue≤0.1 的Pathway 作为在差异表达基因中显著富集的Pathway。
1.2.6 差异表达目标基因的qRT-PCR 验证为了验证海豚链球菌转录组数据的可靠性,将差异表达基因与毒力因子数据库(Virulence Factors of Pathogenic Bacteria,VFDB)进行比对,筛选出22 个与毒力相关的差异表达基因,使用primer 5.0 软件设计特异性定量引物(基因名称和引物序列见表1),引物委托生工生物工程(上海)股份有限公司合成。根据cDNA 反转录试剂盒的使用说明书将质检合格的总RNA 反转录为cDNA,应用实时荧光定量PCR(Real-time quantitative PCR,qPCR)技术对其进行转录水平的验证,qPCR 反应程序为95 ℃预变性1 min,95 ℃变性15 s,60 ℃退火20 s,72 ℃延伸30 s,共计40 个循环结束,60 ℃读取熔解曲线。以16S rRNA 基因为内参基因,采用2-ΔΔCt方法分析计算各毒力基因的相对表达量。

表1 检测海豚链球菌毒力基因的qRT-PCR 特异性引物
2 结果与分析
2.1 不同温度下海豚链球菌的生长曲线海豚链球菌在本试验的2 个培养温度下,35 ℃生长速度明显快于25 ℃,能够快速进入生长对数期,35 ℃在3 h 左右即达到对数生长期,25 ℃在9 h 左右才达到对数生长期。到达生长平台期后,35 ℃的吸光值略高于25 ℃的吸光值。当吸光值OD600在1.0 左右时,2 个培养温度的海豚链球菌均处于对数生长期(图1)。
然而目前职业学校,很多家长的文化程度本身较低,对孩子的教育重视程度不够。而且很多家长忙于生计,工作时间较长,经常会说“我不会教育”,“我管不了孩子”,“我没时间”。对于这样的家长,我觉得必须帮助他们认识到一个问题,那就是任何事业的成功,都不能弥补孩子教育的失败。忙,不是借口;不会,不是理由。“活到老,学到老”,父母也应该学习在当今时代如何与孩子沟通,如何陪伴孩子的成长。
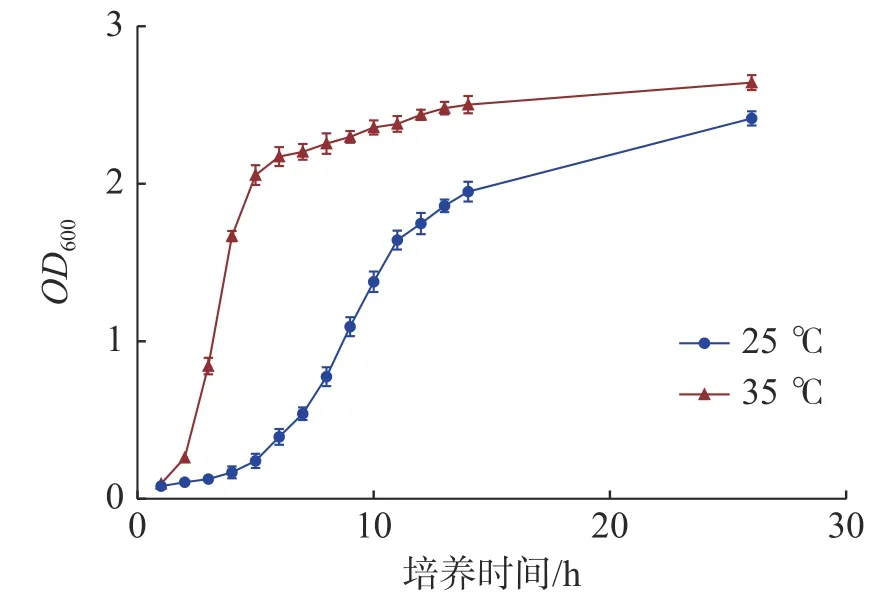
图1 海豚链球菌在不同培养温度下的生长曲线
2.2 人工感染试验结果不同温度人工感染结果显示(图2),35 ℃时,在感染后1~3 d 卵形鲳鲹即出现大量死亡,之后死亡量逐渐趋于稳定,第5 天停止死亡,患病卵形鲳鲹死亡前出现游泳异常、眼球突出、鳍条基部充血等症状,病原菌经分离培养,16S rRNA 鉴定为海豚链球菌。25 ℃时,卵形鲳鲹在感染后3 天内未出现死亡,第4 天开始出现少量死亡,死亡率较低,第7 天停止死亡。海豚链球菌在水温35 ℃和25 ℃造成的卵形鲳鲹的累积死亡率分别为81.11%和12.23%,PBS 对照组均未出现死亡。
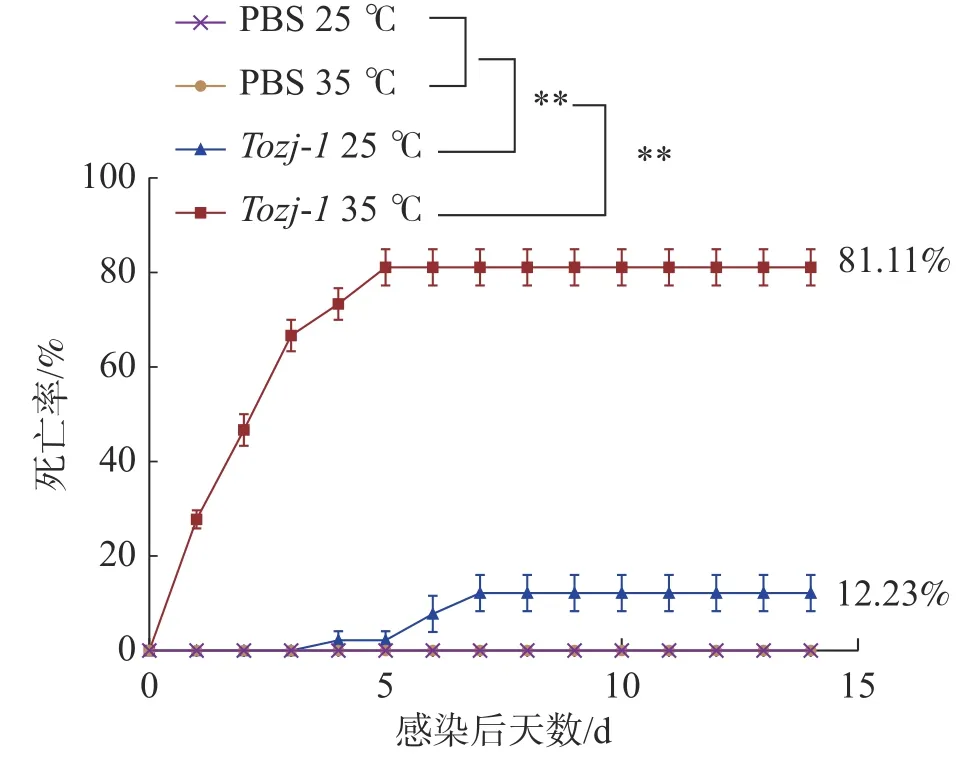
图2 环境温度对卵形鲳鲹海豚链球菌病死亡率的影响
2.3 总RNA 的提取提取培养至对数生长期(OD600=0.9~1.1)的海豚链球菌的总RNA,1%琼脂糖凝胶电泳结果如图3 所示,28 S 和18 S 的条带清晰无弥散,RNA 完整性好,无降解。核酸蛋白检测仪测定结果显示样品的A260/A280比值在2.0 左右,浓度为400~700 ng·μL-1,RNA质量符合转录组测序的要求。

图3 1%琼脂糖凝胶电泳检测海豚链球菌Tozj-1 株总RNA
2.4 样品相关性分析本试验中每个温度设有3 个生物学重复,其中CK-1、CK-2、CK-3 分别表示25 ℃的3 个平行样品,Test-1、Test-2、Test-3 分别表示35 ℃的3 个平行样品。如图4 所示,同一温度的3 个平行样品相关性系数在0.998 0以上,表明来自3 个重复性试验的转录组数据具有高度可重复性,可用于后续分析。
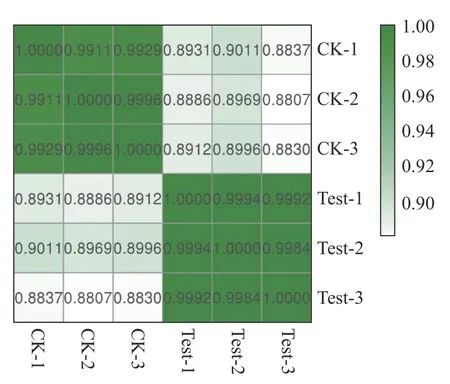
图4 样品相关性分析热图
2.5 数据过滤与质量评估Illumina 测序得到的数据经过质量检测和数据过滤,最终获得Clean reads,各样本的Clean reads 与Raw reads 的Q20和Q30 分别达到了97%和93%以上,GC 含量在各样本中较为一致,为40.19%~41.22%(表2)。以上数据均表明转录组测序的数据良好,可以用于后续进一步分析。
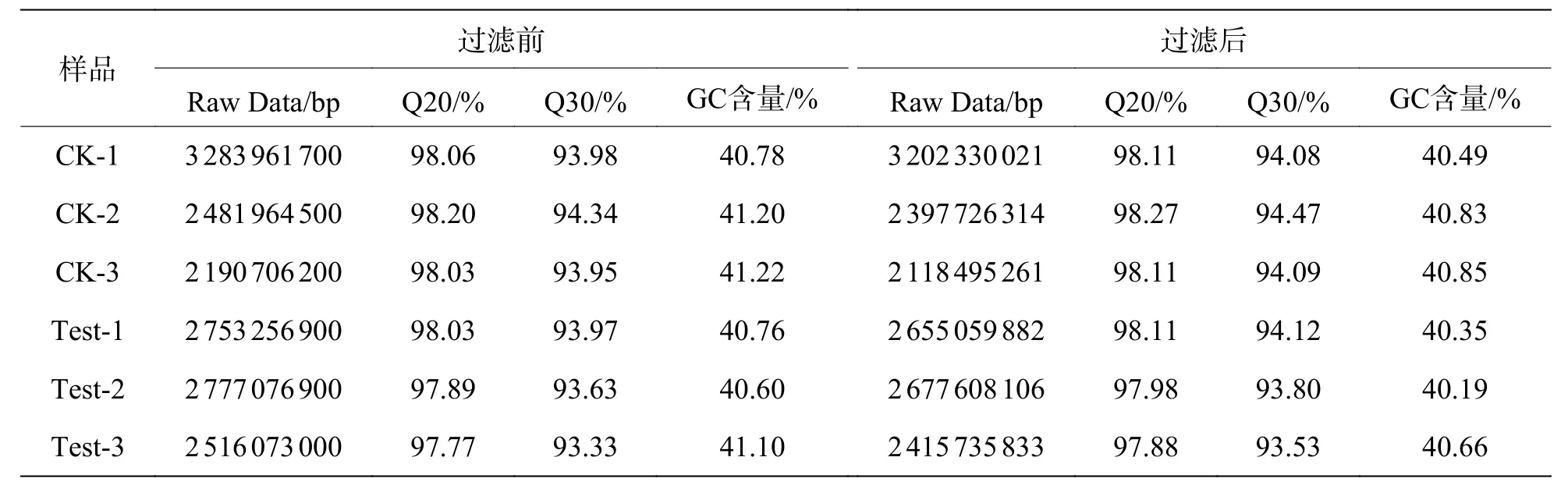
表2 过滤前后碱基信息统计
2.6 差异表达基因的分析使用Bowtie 2 软件将6 个转录组数据映射到海豚链球菌SF1 基因组,结果显示,所有样品数据皆可映射到基因组上,并且这些样本的映射率均在98%以上(表3)。说明该转录组数据可靠,可以用于后续的试验分析。差异表达基因结果如图5 所示,共筛选到927 个显著差异表达基因,其中820 个上调表达,107 个下调表达。
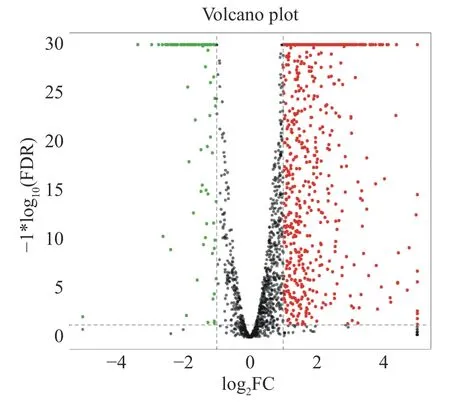
图5 差异基因统计火山图

表3 原始数据比对到基因组
2.7 差异表达基因的GO 功能富集分析对获得的差异表达基因进行GO 注释分析,共得到1 611 个GO 功能注释,其中生物学过程(biological process)959 个、细胞组分(cellular component)446 个和分子功能(molecular function)570 个。如图6 所示,差异基因注释在生物学过程有关的GO terms 数量最多,共计12 个,主要有代谢过程(metabolic process)、细胞过程(cellular process)和单一有机过程(single-organism process)等;其次是与分子功能有关的terms,共计8 个,主要有催化活性(catalytic activity)、结合(binding)等;与细胞组分有关的terms 最少,为7 个,主要有细胞(cell)、细胞成分(cell part)和膜(membrane)等。海豚链球菌代谢过程、细胞过程、单一有机过程、结合过程和催化活性这几个亚类包含的差异基因比较多,它们均受温度调控。
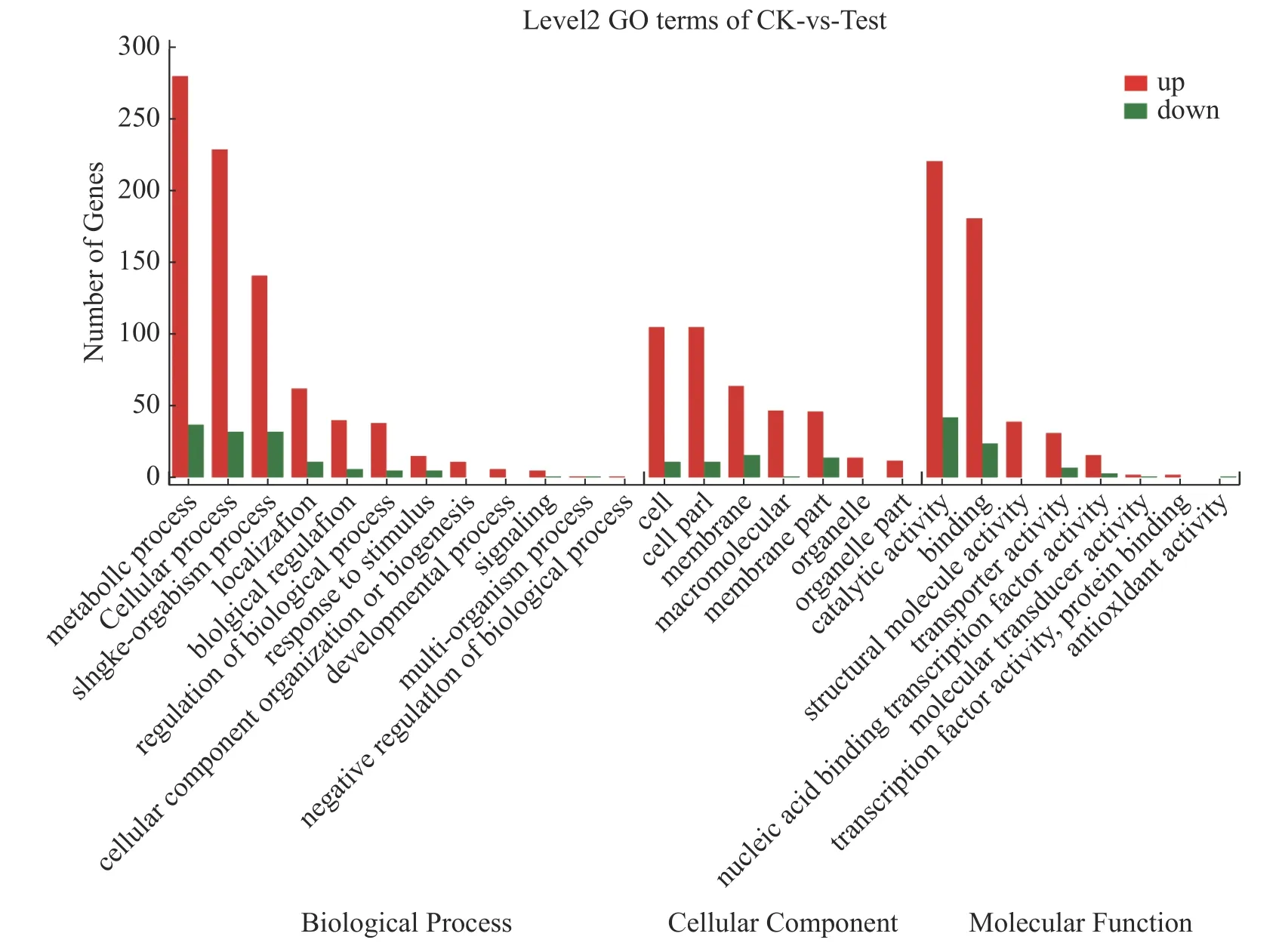
图6 CK 与Test 差异基因GO 分类
2.8 差异表达基因的KEGG 富集分析将2 个样本的差异基因进行KEGG 富集分析,结果显示,820 个上调表达基因中有289 个基因可以富集到KEGG 的98 条pathways,其中显著富集的pathways有5 个。这些显著上调的基因主要与信号转导、跨膜转运和毒力因子表达有关,包括ABC 转运、核糖体通路、群体感应、脂肪酸代谢和合成通路(图7-a)。除此之外,还包括少量与叶酸和淀粉蔗糖代谢的相关基因。值得注意的是,这些显著上调的pathways 中有许多重复出现的基因(表4),特别是srtF基因(K710_0263)在ABC 转运、群体感应系统和双组份调控通路中均上调表达。
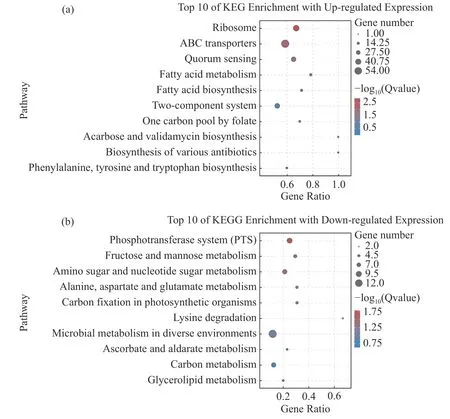
图7 差异表达基因的KEGG 富集分析(35 ℃相对于25 ℃)
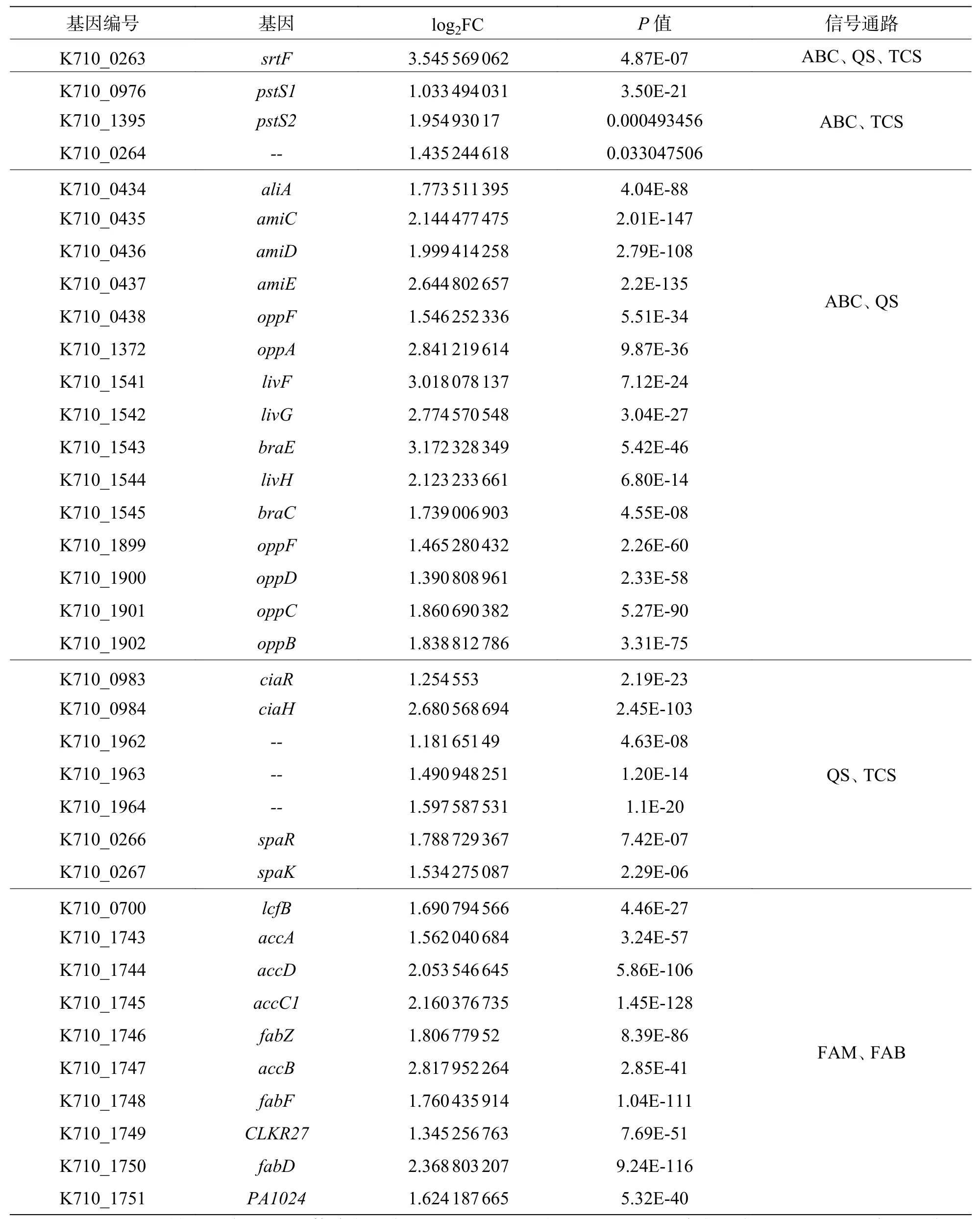
表4 同时参与多条通路的上调表达基因
2.9 转录组数据的qRT-PCR 验证为了评估转录组数据的可靠性,随机筛选22 个差异表达的重要毒力基因,采用实时荧光定量PCR 的方法检测毒力基因的转录水平,每个基因设置3 次生物学重复,以保证数据的准确性,结果如图8 所示。2 种检测方法经SPSS 软件的相关性分析,相关系数达到了0.824,相关极显著(P<0.001),说明qRTPCR 验证结果与RNA-Seq 数据具有较好的一致性,并且基因表达变化的趋势基本相同,进一步验证了转录组数据的可靠性。
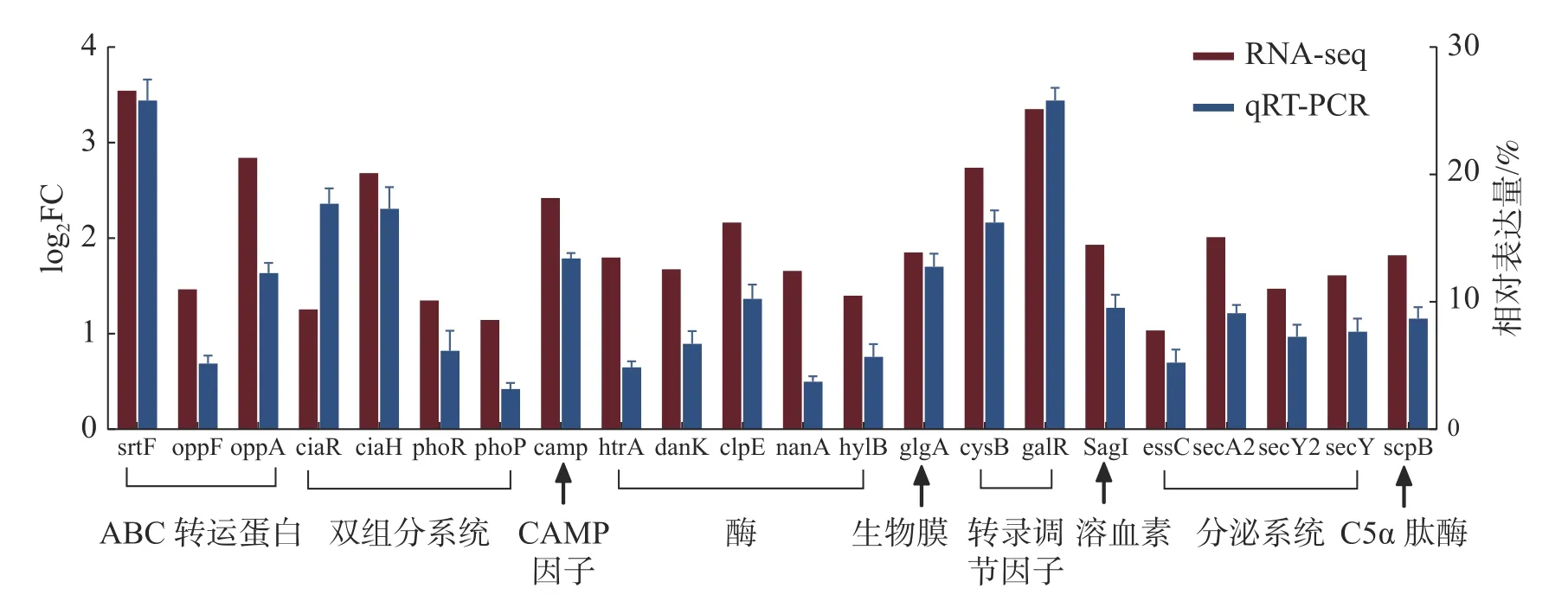
图8 海豚链球菌在25 ℃和35 ℃条件下毒力相关基因的相对表达量
2.10 温度与毒力因子基因表达的相关性根据文献[27- 28]以及VFDB 数据库的筛选,发现约58 个当前已知或预测的海豚链球菌毒力因子。由表5 可知,上调表达的毒力因子有46 个,特别是溶血素(SagI)、黏附素(fap1)、转录调节因子(cysB、galR)和C5α 肽酶(scpB)等重要的毒力因子,在35 ℃培养条件下毒力因子基因的表达量与25 ℃培养条件下相比明显升高(log2FC>1.6);下调表达的毒力因子基因相对较少,仅有12 个(表6),其中包含海豚链球菌毒力标志基因simA。
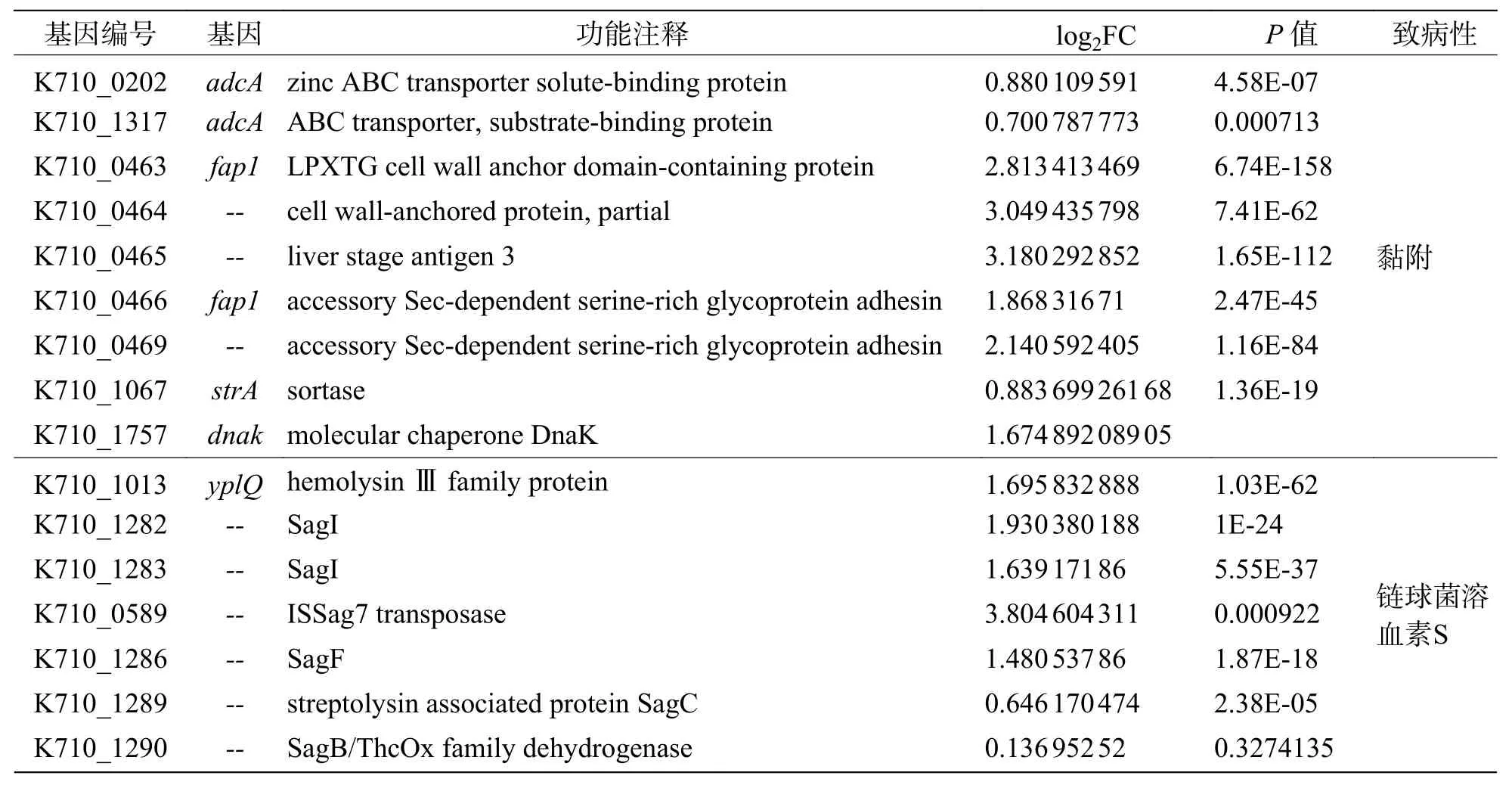
表5 上调表达的细菌毒力因子

表6 下调表达的细菌毒力因子
3 讨 论
温度是影响细菌毒力的重要环境因子。由病原菌引发的鱼类疾病的暴发往往与水温有着极为紧密的关联性。郭富强等[29]的研究结果表明,随着水温的不断升高罗非鱼感染无乳链球菌的累积死亡率也随之升高,在33 ℃死亡率最高;刘志刚等[17]发现无乳链球菌感染罗非鱼在37 ℃死亡率最高;Zamri-Saad 等[30]认为链球菌水温在32~37 ℃时易出现高发病率和高死亡率,而水温26 ℃以下时较少发病。在本研究中,人工回归感染试验结果表明,卵形鲳鲹感染海豚链球菌后在35 ℃下的死亡率高达81.11%,而在25 ℃下的死亡率仅为12.23%,2 个温度的PBS 对照组均未出现死亡,说明海豚链球菌在35 ℃时毒力更强,导致宿主死亡率更高,发病症状更为明显。同时,本课题组在卵形鲳鲹链球菌病的流行病学调查研究中发现,卵形鲳鲹在25 ℃以下几乎不感染发病,在30~35 ℃时死亡率较高。因此,本研究设置25 ℃培养的海豚链球菌作为对照组,35 ℃培养的海豚链球菌为实验组,探究其在不同温度下基因转录水平上的差异表达,揭示温度对海豚链球菌毒力基因的影响。
在本研究中,当设置FDR<0.05 且|log2FC|>1时,与25 ℃培养的海豚链球菌相比,35 ℃培养的海豚链球菌显著上调的基因有820 个,而显著下调的基因只有107 个。从整体来看,在较高的培养温度下(35 ℃)菌株大多数基因处于上调状态,菌株表现为更加“活跃”的状态,而在较低的温度下(25 ℃)菌株大多数基因则显著下调,菌株显得相对不那么“活跃”,具体表现为与糖类、碳类的代谢相关的基因显著下调,而与细菌毒力相关的基因则显著上调。Mereghetti[31]等在研究无乳链球菌全基因转录组测序时也有类似的发现,编码毒力的相关基因在40 ℃时上调表达,而处于生长稳定期的大量的新陈代谢相关基因在30 ℃时上调表达。
ABC 转运蛋白是已知的最大蛋白家族之一,并在细菌中广泛存在,其将ATP 水解与各种底物(例如蛋白质、脂质、肽、固醇、糖、离子及药物)的主动运输结合在一起[32-33],这将导致细胞质膜两侧的物质频繁交换。在本研究中,海豚链球菌在35 ℃时ABC 转运通路相关的基因显著上调,说明35 ℃海豚链球菌可能涉及各种物质参与的能量交换,以及物质的合成与代谢。群体感应是一种协同调节系统,它以一种被称为AIP(autoinduc ing peptide)的自诱导肽作为信号分子,通过感知菌群密度和环境因子的变化,并把周围的环境信息传递到双组份系统当中,再由双组份系统对相关基因进行表达调控[34]。一些AIP 的前体肽在核糖体中合成,但是AIP 无法自由地穿透细胞壁,因此必须通过ABC 运输系统或其他的膜通道蛋白进入胞外发挥作用。因此部分上调表达的基因同时参与了ABC 转运通路、双组份信号系统通路、群体感应通路、脂肪酸代谢和合成通路当中的2~3 个通路,特别是显著上调的srtF(K710_0263)基因同时参与了3 个通路的表达调控,具有重要的研究意义。研究发现,srtF属于C 类sortase 家族,主要作用是在细菌表面形成菌毛并将其固定在细胞壁上,与细胞黏附、定植、生物膜形成等环境过程相互作用[35]。
在下调表达基因中比较典型的是双组份系统中编码柠檬酸合酶(Citrate lyase)相关的基因(K710_0369、K710_0374、K710_0375、K710_0379和K710_1345),由此表明,在35 ℃时,Tozj-1菌株的三羧酸循环被抑制,对葡萄糖的代谢能力明显降低,而在25 ℃相对较低的环境温度中,其对葡萄糖的代谢能力表现良好。这与胡文婷[16]研究的无乳链球菌和刘韬[36]研究的鲁氏耶尔森菌结论一致,低温更有利于病原菌葡萄糖的代谢。并且在35 ℃时,与磷酸转移酶系统、果糖和蔗糖代谢、氨基糖和核苷酸糖代谢相关的基因显著下调,这证明糖类、碳类的代谢更适合在较低温度下进行。
病原菌的致病过程与毒力因子的共同介导作用密切相关。海豚链球菌几种重要的毒力因子包括M 蛋白、磷酸葡萄糖苷酶(pgmA)、溶血素S、C5α 肽酶、脱乙酰基酶、CAMP 因子。M 蛋白[37]是一种可以通过荚膜延伸到菌体表面形成菌毛的蛋白,它在细菌粘附、感染、抵御吞噬等方面起关键作用;磷酸葡萄糖苷酶(pgmA)[38]促进细胞壁和荚膜的生物合成,并能抵抗正电性抗菌肽;溶血素S[39- 40]能破坏宿主红细胞、单核细胞和粒细胞,有可能对脑血管造成损伤;C5α 肽酶能水解中性粒细胞化学诱导物补体因子C5α,从而破坏宿主细胞的抗侵袭能力;脱乙酰基酶[41]能够提高病原菌对溶菌酶的耐受性,逃避宿主免疫,黏附并入侵宿主的上皮细胞;CAMP 因子[42]通过与FC 区域的免疫球蛋白结合,从而有助于拦截抗体向补体呈递抗原。这些毒力因子相互作用协助S.iniae侵入宿主,逃避宿主的免疫防御。在本研究中,不同温度下培养的海豚链球菌,其毒力因子呈差异表达,在35 ℃时,除了溶血素、黏附素、转录调节因子等毒力因子转录上调之外,抗逆因子和一些酶类基因的转录表达量也大幅上升,只有少量的毒力因子下调表达。刘志刚等[17]、王松艳[21]和郭富强[29]对无乳链球菌的研究亦发现类似的结果。以上相关研究结果均表明,高温有助于海豚链球菌毒力相关基因表达,导致其毒力增强,有助于其黏附、定植、入侵、胞内存活和扩散等致病过程,引起宿主发病。
本研究结果初步证实温度能够广泛影响海豚链球菌基因的转录水平,进而调控海豚链球菌的致病性,为进一步研究海豚链球菌的致病机理提供理论依据,但其调控机制仍需要进一步研究加以阐明。
——奇妙的蛋

