烟碱对小鼠中枢神经炎症的改善作用及其机制
刘薇,陈璟莉,严虹,任凌云,彭仕玉
华中科技大学同济医学院附属武汉中心医院麻醉科,武汉 430014
中枢神经炎症是一种复杂的神经系统炎症反应,表现为病态行为及认知功能障碍,最终导致精神疾病及神经功能退化。研究表明,脂多糖(LPS)、多聚肌苷酸—多聚胞苷酸[Poly(I∶C)]和活细菌引起的全身性炎症反应可刺激脑小胶质细胞活化,增加脑组织免疫反应,导致中枢神经炎症发生[1-3]。目前尚无治疗中枢神经炎症的特效药物,因此,寻找能够控制全身性炎症反应并抑制小胶质细胞活化的药物是治疗中枢神经炎症的关键。胆碱能抗炎通路是由迷走神经及其递质乙酰胆碱构成的下行通路,当炎症信号传递到迷走神经中枢后,迷走神经传出冲动增强,其末梢纤维释放乙酰胆碱增加,经分布于全身各器官系统单核/巨噬细胞表面的含α7亚基N 型乙酰胆碱受体(α7nAchRs)介导,抑制NF-κB 活化、降低TNF-α 和IL-6 等炎症因子水平,从而拮抗全身性炎症反应[4]。烟碱是α7nAchRs 激动剂,研究表明,烟碱能够通过激活胆碱能抗炎通路发挥抗炎作用[5]。2023 年6 月—8 月,我们通过观察烟碱对Poly(I∶C)所导致的中枢神经炎症和认知行为的改变,探讨烟碱对小鼠中枢神经炎症和认知行为的改善作用及其作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 6~8 周龄雌性C57BL/6 小鼠60 只,体质量18~20 g,购自湖南斯莱克景达实验动物有限公司。适应性饲养1周,自由进食进水,12 h/12 h 光暗条件下喂养,环境温度20~25 ℃。本研究经过武汉大学动物伦理委员会审核批准,严格按照实验动物管理和实用指南进行操作。
1.1.2 主要试剂与仪器 烟碱(美国KKL Med),Poly(I∶C)、α7烟碱型乙酰胆碱受体特异性拮抗剂甲基牛扁亭柠檬酸盐(MLA,美国MedChemExpress);小胶质细胞/巨噬细胞特异性蛋白抗体IBA-1(英国Abcam);磷酸化蛋白酶抑制剂(武汉阿斯本生物);细胞总RNA 提取试剂(武汉科鹿生物);PCR 基因扩增仪(杭州博日科技);p-NFκB p65 一抗、NFκB p65一抗(美国Cell Signaling Technology);多聚甲醛(国药集团)。小鼠旷场,Morris 水迷宫,视觉追踪啮齿动物行为学分析软件3.0.0.1(上海欣软信息科技有限公司)。
1.2 动物分组与模型构建 采用随机数字表法将小鼠分为正常组、模型组、烟碱组、MLA 组,每组各15 只。模型组、烟碱组和MLA 组腹腔注射Poly(I∶C)12 mg/kg 制备中枢神经炎症模型,正常组腹腔注射等量生理盐水。
1.3 药物干预 烟碱组于造模前30 min 腹腔注射烟碱1 mg/kg;MLA 组于造模前1 h 腹腔注射MLA 5 mg/kg,造模前30 min 腹腔注射烟碱1 mg/kg。模型组和正常对照组在同一时间点注射等量生理盐水。
1.4 小鼠空间学习记忆能力观察 于造模前5 d开始进行Morris水迷宫适应性训练,每天训练4次,两次训练间隔15~20 min。造模后3 h,每组随机选取6只小鼠进行Morris水迷宫实验,使用啮齿动物行为学分析软件记录小鼠60 s内穿越原平台次数和逃避潜伏期。
1.5 小鼠自主运动能力观察 采用旷场实验。每组随机选取6只小鼠,放入旷场中间区域,使用啮齿动物行为学分析软件记录5 min 内小鼠在旷场中的平均运动速度和运动距离。
1.6 小鼠海马及前额叶小胶质细胞激活度观察采用免疫组化法。造模后3 h,每组各取3 只小鼠麻醉,打开胸腔,向左心室灌注PBS 冲洗,随后灌注4%多聚甲醛溶液固定。取脑组织,加入4%多聚甲醛固定,切取海马区及前额叶区进行石蜡包埋、切片、脱蜡、纯水洗,切片置于柠檬酸盐缓冲液中,微波加热进行抗原修复。加入3% H2O2室温封闭,PBS冲洗。滴加适量一抗IBA-1,4 ℃孵育过夜。滴加二抗,37 ℃孵育30 min,PBS 冲洗。DAB 显色,苏木素染核,1%盐酸分化,1%氨水返蓝,脱水封片,显微镜下观察。采用图片分析软件Image-Pro Plus 6.0 测量累积光密度(IOD),用来评估小胶质细胞激活度。
1.7 脑组织IL-6、TNF-α、INF-β、INF-α、IL-1β mRNA 检测 采用qPCR 法。造模后3 h,每组各取3 只小鼠麻醉处死,取脑组织,-80 ℃保存。取脑组织冰上研磨,加入细胞裂解液提取总RNA,以其为模板合成cDNA。以cDNA 为模板,使用实时荧光定量PCR 仪进行PCR 扩增。引物序列见表1。反应体系:2 × Master Mix 5.0 μL、引物工作液(2.5 μmol/L)1.0μL、Template 1.0 μL、ddH2O 2.0 μL、Rox 1.0 μL。反应条件:预变性95 ℃,30 s;95 ℃ 10 s,58 ℃ 30 s,72 ℃ 30 s,共循环40 次。以GAPDH 为内参,采用2-ΔΔCt法计算目的基因的相对表达量。
1.8 小鼠脑组织NF-κB p65 蛋白磷酸化水平检测 采用Western blotting 法。造模后3 h,每组各取6 只小鼠麻醉处死,取脑组织,加入细胞裂解液提取组织总蛋白,使用BCA 法测定蛋白浓度。取蛋白进行凝胶电泳分离,蛋白上样后120 V 恒压电泳,转膜。加入封闭液,室温封闭1 h。分别加入稀释后的一抗p-NFκB p65(1∶500)、NF-κB p65(1∶5 000)、GAPDH(1∶10 000),4 ℃孵育过夜。TBST洗涤,加入HRP 偶联二抗,室温孵育30 min。TBST 洗涤,滴加新鲜配制的ECL 混合溶液,暗室中曝光、显影、定影。使用AlphaEaseFC 软件分析蛋白条带的光密度值,以目的蛋白与GAPDH 光密度值的比值计算目的蛋白的相对表达量。
1.9 统计学方法 采用SPSS22.0 统计软件。计量资料采用Kolmogorov-Smirnov法进行正态性检验,符合正态分布的数据以±s表示,组间比较采用单因素方差分析,多组间两两比较,方差齐时采用LSD检验,方差不齐时采用Dunnett'sT3检验。P<0.05为差异有统计学意义。
2 结果
2.1 四组小鼠空间学习记忆能力比较 与正常组比较,模型组潜伏期延长,穿越平台次数减少(P均<0.05);与模型组比较,烟碱组潜伏期延长,穿越平台次数增加(P均<0.05);与烟碱组比较,MLA 组潜伏期延长,穿越平台次数减少(P均<0.05)。见表2。
表2 四组小鼠水迷宫实验结果比较(± s)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05;与烟碱组比较,△P<0.05。
?
2.2 四组小鼠自主运动能力比较 与正常组比较,模型组平均运动速度、运动距离减少(P均<0.05);与模型组比较,烟碱组平均运动速度以及运动距离增加(P均<0.05);与烟碱组比较,MLA 组平均运动速度以及运动距离减少(P均<0.05)。见表3。
表3 四组小鼠旷场实验结果比较(± s)

表3 四组小鼠旷场实验结果比较(± s)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05;与烟碱组比较,△P<0.05。
?
2.3 四组小鼠前额叶及海马小胶质细胞激活度比较 与正常组比较,模型组前额叶及海马小胶质细胞激活度增加(P均<0.05);与模型组比较,烟碱组前额叶及海马小胶质细胞激活度降低(P均<0.05);与烟碱组比较,MLA 组前额叶及海马小胶质细胞激活度增加(P均<0.05)。见表4。
表4 四组小鼠前额叶及海马小胶质细胞激活度比较(± s)

表4 四组小鼠前额叶及海马小胶质细胞激活度比较(± s)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05;与烟碱组比较,△P<0.05。
?
2.4 四组小鼠脑组织IL-6、TNF-α、INF-β、INF-α、IL-1β mRNA表达比较 与正常组比较,模型组脑组织IL-6、TNF-α、INF-β、INF-α、IL-1β mRNA表达增加(P均<0.05);与模型组比较,烟碱组脑组织IL-6、TNF-α、INF-β、INF-α、IL-1β mRNA 表达降低(P均<0.05);与烟碱组比较,MLA 组脑组织IL-6、TNF-α、INF-β、INF-α、IL-1β mRNA 表达增加(P均<0.05)。见表5。
表5 四组小鼠脑组织IL-6、TNF-α、INF-β、INF-α、IL-1β mRNA表达比较(± s)
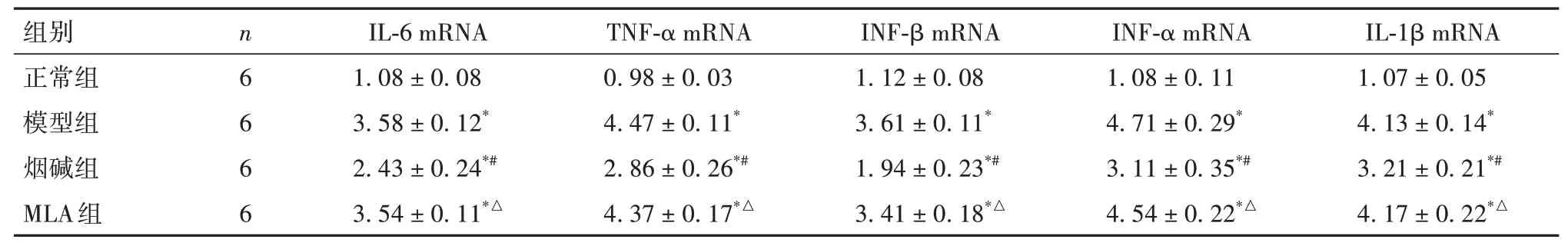
表5 四组小鼠脑组织IL-6、TNF-α、INF-β、INF-α、IL-1β mRNA表达比较(± s)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05;与烟碱组比较,△P<0.05。
?
2.5 四组小鼠脑组织NF-κB p65 磷酸化水平比较 与正常组比较,模型组脑组织p-NF-κB p65 水平增加(P<0.05);与模型组比较,烟碱组脑组织p-NF-κB p65 水平降低(P<0.05);与烟碱组比较,MLA 脑组织p-NF-κB p65 水平增加(P<0.05)。见表6。
表6 四组小鼠脑组织NF-κB p65磷酸化水平比较(± s)

表6 四组小鼠脑组织NF-κB p65磷酸化水平比较(± s)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05;与烟碱组比较,△P<0.05。
?
3 讨论
中枢神经炎症是一个复杂的生物学过程,NFκB 及其相关通路在中枢神经系统神经炎症中起重要作用[6]。Poly(I∶C)是一种合成的双链RNA,可通过结合TLR3 模拟病毒炎症模型[7]。JEONG 等[8]报道,给予小鼠Poly(I∶C)外周注射可刺激细胞因子TNF-α、IL-1β 表达,并导致行为的改变和认知功能缺陷。小胶质细胞是参与中枢神经系统炎症反应的关键细胞类型。Poly(I∶C)引起的系统性炎症反应刺激小胶质细胞活化,该细胞进一步释放细胞因子、趋化因子、活性氧和第二信使介导,增加脑组织免疫反应,导致中枢神经炎症[9]。α7nAchRs 在胆碱能抗炎通路中起重要作用,全身各器官系统单核/巨噬细胞表面的α7nAchRs 被激活后,能够抑制NF-κB 活化,降低TNF-α和IL-6等促炎细胞因子水平,进而拮抗全身性炎症反应[4]。烟碱是α7nAchRs 激动剂,通过作用于烟碱型受体,调控神经介质释放,影响中枢神经系统和周围神经系统中的多种通路,产生神经保护、神经—免疫调节及镇痛等作用,可作为治疗神经系统疾病的潜在药物[10]。我们的前期研究表明,烟碱能够通过激活胆碱能抗炎通路,改善心肌缺血再灌注大鼠心功能和内毒素血症大鼠凝血功能异常[11-12]。本研究结果显示,与对照组比较,模型组水迷宫实验潜伏期延长、穿越平台次数减少,旷场实验平均运动速度以及运动距离减少,表明给予Poly(I∶C)后小鼠出现了认知行为的改变;与模型组比较,烟碱组水迷宫实验潜伏期延长、穿越平台次数增加,旷场实验平均运动速度以及运动距离增加,表明烟碱预处理能改善Poly(I∶C)所导致的小鼠认知行为的改变;与烟碱组比较,MLA 组水迷宫实验潜伏期延长、穿越平台次数减少,旷场实验平均运动速度以及运动距离减少,表明烟碱改善小鼠认知行为的作用与α7nAchRs有关。
小胶质细胞是常驻免疫细胞,提供第一道中枢神经系统的防御。在稳定状态下,小胶质细胞分泌神经营养因子维持正常脑功能。当受到病原体刺激时,静止的小胶质细胞被激活,释放多种致炎因子,导致神经元损伤[8]。本研究结果显示,与对照组比较,模型组前额叶及海马小胶质细胞激活度增加,表明脑组织存在炎症改变;与模型组比较,烟碱组前额叶及海马小胶质细胞激活度降低,表明烟碱预处理能够降低Poly(I∶C)所导致的小鼠前额叶及海马的炎症改变;与烟碱组比较,MLA 组前额叶及海马小胶质细胞激活度增加,表明烟碱降低Poly(I∶C)所导致的脑组织炎症改变与α7nAchRs有关。
IL-6、TNF-α、IL-1β 是用于评价脑组织炎症改变的常用炎症因子指标[13]。IFN-α 是机体受病毒感染时,免疫细胞产生的一种细胞因子。研究显示,慢性病毒性肝炎患者长期使用IFN-α 重组制剂会引起各种神经精神不良反应,导致中枢神经系统病变[14]。IFN-β 是TLR3 激活的主要产物,能够增加海马神经元间期样自发活动,下调脑源性神经营养因子(BDNF)受体TrkB 表达[15]。研究发现,烟碱能减弱Poly(I∶C)诱导的巨噬细胞的反应,如降低IL-6、TNF-α mRNA 及蛋白表达,并改变MEK4、Myc 以及PYK2 的磷酸化[16]。本研究结果显示,与对照组比较,模型组脑组织IL-6、TNF-α、INF-β、INF-α、IL-1β mRNA表达增加;与模型组比较,烟碱组脑组织IL-6、TNF-α、INF-β、INF-α、IL-1β mRNA表达降低;与烟碱组比较,MLA 组脑组织IL-6、TNF-α、INF-β、INF-α、IL-1β mRNA 表达增加。这表明预处理烟碱能降低Poly(I∶C)所导致的小鼠脑组织炎症因子的表达,且该作用与α7nAchRs有关。
NF-κB p65是一种转录因子,其磷酸化后能够从细胞质转移到核内,调控多种炎症因子表达[13]。WEI等[17]报道,在老年大鼠肝部分切除术后认知功能障碍模型中,烟碱对中枢神经具有保护作用,其机制与抑制NF-κB 信号通路有关。本研究结果显示,与对照组比较,模型组脑组织NF-κB p65 磷酸化水平增加,表明小鼠脑组织发生炎症改变;与模型组比较,烟碱组脑组织NF-κB p65磷酸化水平降低,表明小鼠脑组织炎症改变减轻;与烟碱组比较,MLA组脑组织NF-κB p65磷酸化水平增加,表明烟碱减轻小鼠脑组织炎症改变的作用被α7nAchRs 特异性拮抗剂MLA拮抗。因此认为,α7nAchRs参与了烟碱预处理降低Poly(I∶C)导致的小鼠脑组织炎症改变,α7nAchRs的激活降低了NF-κB p65磷酸化水平。
综上所述,烟碱能够改善Poly(I∶C)引起的中枢神经炎症和认知行为改变,其机制可能是通过作用于α7nAchR,激活胆碱能抗炎通路,减少NF-κB p65磷酸化,进而减少炎症因子释放有关。

