CDC25C表达下调的黑色素瘤细胞线粒体应激反应和线粒体途径凋亡情况观察
缪欣宇,栗彦飞,郑方园,刘海龙,张瑶尧,晁耐霞,莫发荣,2
1 广西医科大学基础医学院,南宁 530021;2 广西高校人体发育与疾病研究重点实验室
黑色素瘤是一种黑色素细胞的抗药性恶性肿瘤,95%以上的黑色素瘤存在于皮肤中,称为皮肤黑色素瘤。目前早期黑色素瘤的主要治疗方法是手术切除,晚期黑色素瘤的主要治疗手段是免疫疗法,但由于黑色素瘤的高转移潜力,其预后极差。因此,进一步研究黑色素瘤的潜在发病机制,有助于发现更为有效的治疗手段,改善患者预后。细胞分裂周期蛋白25 同源蛋白C(CDC25C)主要参与调节细胞G2/M 期进程和介导DNA 损伤修复[1]。细胞周期调控机制失活在细胞癌变过程中发挥重要作用。本课题组前期通过生物信息学分析发现,CDC25C 在黑色素瘤组织中高表达,CDC25C 表达与患者生存率相关,CDC25C表达下调能激活黑色素瘤B16细胞自噬并抑制细胞迁移[2]。有文献报道,抑制CDC25C表达能够阻断线粒体氧化呼吸,阻止细胞增殖,提示CDC25C 可能通过调节线粒体功能引起细胞凋亡,在肿瘤的发生发展中起作用[3]。正常情况下,线粒体中的Ca2+保持动态平衡,一旦打破这个平衡,就会诱导线粒体内ROS 产生增加,继而导致细胞凋亡。线粒体酪蛋白水解酶P(ClpP)、离子肽酶1(LONP1)在线粒体的蛋白质折叠稳态控制机制中起重要作用,在线粒体应激自稳调控过程中,通过上调ClpP和LONP1 表达,减少过度堆积的线粒体蛋白毒性。而内源性细胞凋亡是通过线粒体途径的凋亡,其特征在于细胞色素C 的释放,继而激活Caspase-9 和Caspase-3,引发凋亡级联反应,从而诱发细胞凋亡。2022 年9 月—2023 年9 月,我们通过下调黑色素瘤细胞CDC25C 表达,观察其激活线粒体应激反应和诱导黑色素瘤细胞凋亡的作用。
1 材料与方法
1.1 细胞、试剂与仪器 黑色素瘤B16细胞购自中国科学院细胞库。RPMI1640 培养基、胎牛血清(FBS)、青—链霉素双抗、0.25%胰蛋白酶(加拿大WISENT)。TB Green Premix Ex TaqTMⅡ细胞RNA 提取试剂盒(日本TaKaRa),细胞全蛋白提取试剂盒(北京索莱宝)。Ca2+Rhod-2 AM、ROS MitoSOX 红色荧光测定试剂盒(上海翌胜生物科技)。LONP1、GAPDH 抗体(武汉三鹰生物),ClpP、Caspase-9、Caspase-3 抗体(英国Abcam),羊抗鼠二抗、羊抗兔二抗(杭州弗德生物)。倒置相差显微镜(日本Olympus),四通道实时荧光定量PCR 仪(美国ABI),梯度PCR 仪(德国Eppendof),蛋白质电泳仪(美国Bio-Rad)。
1.2 细胞培养 取B16 细胞,加入含胎牛血清和青—链霉素双抗的RPMI1640 完全培养基,置于37 ℃、5% CO2细胞培养箱中培养。每隔2 d 换液1 次,当细胞贴壁生长至90%融合度时进行传代。取对数生长期细胞用于后续实验。
1.3 细胞分组与转染 取对数生长期细胞,随机分为转染组、转染对照组、空白对照组。首先配制慢病毒稀释液,向慢病毒质粒溶液中加入400 mL RPMI1640 无血清培养基和500 mg/mL Polybrene。然后转染组加入稀释后的含CDC25C 低表达的慢病毒质粒,转染对照组加入同等浓度稀释的空载慢病毒质粒,37 ℃、5% CO2培养箱过夜。24 h 后移去慢病毒液,加入500 μL 含2 μg/mL 嘌呤霉素的完全培养基,转入37 ℃、5% CO2培养箱中继续培养,待细胞融合度达到80%~90%时进行传代培养。空白对照组正常培养,不进行慢病毒质粒转染。利用荧光显微镜观察荧光蛋白表达情况评估转染效率。空白对照组、转染对照组、转染组、CDC25C 蛋白表达量分别为1.03 ± 0.02、0.99 ± 0.01、0.64 ± 0.01,转染组CDC25C 蛋白表达水平低于其他两组(P均<0.05),表明转染成功。
1.4 细胞CDC25C mRNA 检测 采用RT-PCR 法。取三组细胞,使用TaKaRa 试剂盒提取细胞RNA,逆转录为cDNA。在梯度PCR 仪上进行PCR 扩增反应。引物序列:CDC25C 上游5'-ATGTCTACAGGACCTATCCC-3',下游5'-TCTGACTGTGCAGGTTTAAG-3';β -actin 上游5'-ATGGAGAAGATCTGGCACCA-3',下游 5'-TAATCTCCTTCTGCATCCTGTC-3'。取扩增产物,置于琼脂糖凝胶恒压(100 V)电泳30 min,紫外分析仪观察结果。以β-actin 为内参,用Image J 软件对电泳条带进行灰度值分析,以目的基因与内参基因的比值计算目的基因的相对表达量。
1.5 细胞线粒体Ca2+含量检测 采用Rhod-2/AM荧光探针染色法。取三组细胞,以4 × 104/孔接种于24 孔板中的细胞爬片上,置于5% CO2、37 ℃培养箱中培养24 h。PBS 清洗,加入500 μL Ca2+荧光探针Rhod-2/AM工作液,37 ℃孵育15 min。去除Rhod-2/AM 工作液,用PBS(不含Ca2+、Mg2+)洗涤,加入完全培养基,37 ℃孵育30 min。加入4%中性甲醛固定15 min,封片。每组细胞取三个视野,在正置荧光显微镜下观察Rhod-2/AM 探针在细胞内呈现点状染色的情况,用Image J 软件对荧光量进行灰度分析,以平均灰度值代表Ca2+含量。
1.6 细胞线粒体ROS 含量检测 采用MitoSOX 荧光探针染色法。取三组细胞,以5 × 104/孔接种于24 孔板中的细胞爬片上,置于5% CO2、37 ℃培养箱中培养24 h。吸弃培养基,用预冷的PBS(含Ca2+、Mg2+)清洗。加入500 μL 线粒体荧光超氧化物探针MitoSOX Red,37 ℃培养箱避光孵育10 min。用预热的PBS(含Ca2+、Mg2+)洗涤,4% 中性甲醛固定15 min,封片。每组细胞取三个视野,在正置荧光显微镜下观察MitoSOX 探针在细胞内呈现点状染色的情况,用Image J 软件对荧光量进行灰度分析,以平均灰度值代表线粒体ROS含量。
1.7 细胞线粒体应激反应相关分子ClpP、LONP1及线粒体途径凋亡相关分子Caspase-9、Caspase-3基因检测 采用RT-qPCR 法。取三组细胞,使用TaKaRa 试剂盒提取RNA,逆转录为cDNA。加入ClpP、LONP1、Caspase-9、Caspase-3 基因的特异性引物(引物序列见表1)及荧光染料等试剂,在StepOne plus荧光定量PCR仪中进行PCR扩增。RT-qPCR反应体系:在不含RNA 酶的离心管中加入10.0 μL 2×ChamQ Universal SYBR qPCR Master Mix、2.0 μL cDNA 模板、0.4 μL 上游引物、0.4 μL 下游引物,用ddH2O 定溶至总体积20 μL。引物由TaKaRa 公司合成。以GAPDH 为内参基因,采用2-ΔΔCt法计算目的基因的相对表达量。
表1 三组细胞ClpP、LONP1、Caspase-9、Caspase-3 mRNA表达水平比较(± s)

表1 三组细胞ClpP、LONP1、Caspase-9、Caspase-3 mRNA表达水平比较(± s)
注:与空白对照组和转染对照组比较,*P<0.05,**P<0.01。
?

表1 RT-qPCR引物序列
1.8 细胞ClpP、LONP1、Caspase-9、Caspase-3 蛋白检测 采用Western blotting 法。取三组细胞,加入蛋白裂解液提取蛋白质,冰上摇匀后离心,收集上清液,采用BCA 法检测蛋白质浓度。于蛋白上清液中加入4×蛋白上样缓冲液,95 ℃、5 min 煮沸变性。通过SDS-PAGE 凝胶电泳分离目的蛋白,然后转移到PVDF 膜上。加入10%脱脂奶粉封闭,PBST 洗涤。分别加入ClpP、LONP1、Caspase-3、Caspase-9 一抗(稀释浓度均为1∶1 000)和GAPDH 一抗(稀释浓度1∶5 000),4 ℃孵育过夜,PBST 洗涤。加入相应的二抗(稀释浓度1∶5 000)孵育2 h,PBST 洗涤。ECL 化学显影后拍照成像,用Image J 软件对蛋白条带进行灰度值分析,以目的蛋白条带与内参蛋白GAPDH灰度值的比值作为目的蛋白的相对表达量。
1.9 统计学方法 采用SPSS28.0 统计软件,计量资料采用K-S 正态性检验方法,呈正态分布的数据以±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 三组细胞线粒体Ca2+含量比较 空白对照组、转染对照组、转染组细胞线粒体Ca2+含量分别为14.76 ± 0.22、18.60 ± 0.78、21.10 ± 0.29。转染组Ca2+含量高于其他两组(P<0.05或<0.01)。
2.2 三组细胞线粒体ROS 含量比较 空白对照组、转染对照组、转染组细胞线粒体ROS 含量分别为35.61 ± 2.11、46.71 ± 0.90、73.82 ± 2.67。转染组线粒体ROS含量高于其他两组(P均<0.01)。
2.3 三组细胞ClpP、LONP1、Caspase-9、Caspase-3 mRNA 表达水平比较 与空白对照组和转染对照组相比,转染组ClpP、LONP1、Caspase-9、Caspase-3 mRNA表达水平升高(P<0.05或<0.01)。见表1。
2.4 三组细胞ClpP、LONP1、Caspase-9、Caspase-3蛋白表达水平比较 与空白对照组和转染对照组相比,转染组ClpP、LONP1、Caspase-9、Caspase-3 蛋白表达水平升高(P均<0.01)。见表2。
表2 三组细胞ClpP、LONP1、Caspase-9、Caspase-3蛋白表达水平比较(± s)
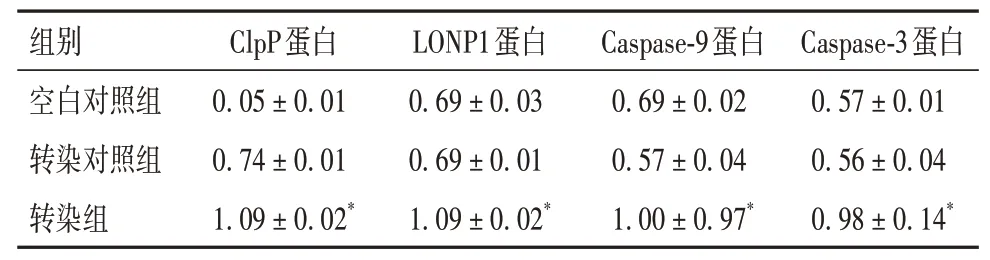
表2 三组细胞ClpP、LONP1、Caspase-9、Caspase-3蛋白表达水平比较(± s)
注:与空白对照组和转染对照组比较,*P<0.01。
?
3 讨论
黑色素瘤的发生发展与多种信号通路密切相关,如基因突变、关键转录调节因子、表观遗传失调、肿瘤促进炎症通路等[4],寻找与黑色素瘤发生发展相关的关键分子,对黑色素瘤的靶向治疗具有重要意义。肿瘤的发生发展是多种因素共同参与的过程,多以细胞周期紊乱和不规则为特征,CDC25C 作为重要的细胞周期调节蛋白,显著影响肿瘤的发生发展。CDC25C 在肝癌、胃癌、黑色素瘤等多种恶性肿瘤组织中,表达水平较正常组织升高[1],提示CDC25C表达水平与肿瘤的发生有关。
线粒体是细胞物质代谢和能量代谢的主要场所,参与多种细胞内信号通路,在决定细胞存活和死亡方面发挥重要作用[5]。肿瘤细胞通过多种途径缓解应激反应,维持线粒体内的蛋白质动态平衡,从而延长生存时间。内质网和线粒体之间存在复杂的动态变化的膜接触[6],调节钙离子流动、脂质生物合成、线粒体DNA 合成和分裂等过程,介导细胞凋亡和细胞自噬信号传导[7]。研究表明,CDC25C表达下调可诱导肝癌细胞发生内质网应激反应[8],当内质网应激时,Ca2+释放并进入线粒体,致使线粒体内钙超载[9],增加线粒体内ROS 的产生,当线粒体内ROS生成过多时,可以引起线粒体内部的未折叠蛋白堆积,发生线粒体应激反应。正常情况下,Ca2+作为细胞内信使参与细胞内多种代谢活动,线粒体Ca2+稳态是维持重要代谢过程的基础,线粒体内Ca2+超载[10]和增多的线粒体ROS 共同诱导线粒体膜通透性增加,释放Caspase-3、Caspase-9等凋亡蛋白,最终引发细胞凋亡。线粒体内钙超载和活性氧的堆积会导致线粒体内未折叠蛋白的堆积,继而诱发线粒体应激反应。线粒体未折叠蛋白反应是线粒体功能的一个主要稳态机制[11],当错误折叠的蛋白质在线粒体内积累时,线粒体未折叠蛋白反应被激活[12],通过增加线粒体应激侣伴分子HSP60 帮助蛋白质正常折叠,通过增加线粒体蛋白质量控制蛋白酶ClpP、LONP1 表达来维持线粒体内的蛋白稳态[13]。ClpP和LONP1 是线粒体基质蛋白酶,二者协同作用,以减弱蛋白毒性应激并保护线粒体[14],其抑制和过度激活均可引起呼吸链活性受损并导致肿瘤细胞死亡[15]。生物信息学分析显示,ClpP 的启动子区含有一个CHOP 的结构域,该位点对CHOP 在线粒体未折叠蛋白反应中的作用不可或缺,CHOP 是参与调控线粒体应激反应的上游关键分子[16],其过表达可通过线粒体途径诱导细胞凋亡[17]。本研究通过慢病毒转染方式对小鼠黑色素瘤B16 细胞系进行CDC25C 基因沉默后,检测线粒体应激相关分子的表达,结果显示LONP1、ClpP 表达显著升高,说明下调CDC25C 表达诱导B16 细胞发生了线粒体应激反应以重建线粒体内蛋白质稳态。
当伴侣蛋白和蛋白水解酶的作用无法克服蛋白毒性应激水平时,线粒体将启动内在的细胞凋亡途径[18]。细胞启动凋亡时,线粒体内促凋亡因子细胞色素C 从线粒体间隙释放,在细胞质中活化前体Caspase-9,随后与Caspase-9结合裂解活化Caspase-3,最终导致细胞凋亡[19]。本研究结果显示,下调CDC25C表达后,B16细胞线粒体凋亡通路相关分子Caspase-3、Caspase-9 mRNA 和蛋白表达增加,表明CDC25C 表达下调诱导肿瘤细胞发生线粒体应激反应继而导致细胞凋亡。
综上所述,黑色素瘤细胞下调CDC25C 可能通过诱导细胞发生线粒体应激反应,从而引起线粒体途径的细胞凋亡。但细胞凋亡是多种因素共同作用的复杂结果,各种细胞器之间复杂的调控网络和细胞因子之间的调控关系起着重要作用。本实验仅探索了黑色素瘤细胞B16细胞基于线粒体途径凋亡调控的分子机制,对于黑色素瘤细胞凋亡是否存在其他凋亡通路调控尚需进一步研究。

