益生菌对幼鱼生长发育的影响及调控机制
张美玲, 董温昕, 杜震宇
(华东师范大学生命科学学院,上海 200241)
中国是世界水产养殖第一大国,据《中国渔业统计年鉴2021》报告,我国水产养殖总产量从1978年的233万t增加到2020年的5 224万t。然而,在水产养殖快速发展的同时,养殖鱼类疾病暴发的频率也有所增加,给养殖户带来了巨大的经济损失[1]。鱼类的生长发育大致可分为胚胎期、仔鱼、稚鱼、幼鱼和成鱼5个阶段。幼鱼阶段是鱼类养殖周期的最初阶段,根据鱼类物种不同,该发育时期持续的时间为1~3个月。与成鱼相比,幼鱼的免疫系统尚未发育完全,只能依靠先天性免疫系统防御入侵的病原体[2],这也导致养殖水体和活体饲料都可能成为致病菌的潜在载体,引发幼鱼较高的发病率和死亡率[3]。因此,提高幼鱼的免疫力是水产养殖成功的关键因素之一。
“益生菌”一词的使用始于20世纪70年代,它源于希腊语中的“生命”一词[4]。2001年,联合国粮食及农业组织和世界卫生组织将“益生菌”定义为“当摄入足够数量时,对宿主健康产生益处的活性微生物”[5]。近年来,随着益生菌概念的不断发展及其机制研究的不断深入,益生菌已被广泛用于水产养殖产业。由于具有安全有效的特点,益生菌作为抗生素的替代品在水产养殖尤其是鱼贝类幼体的养殖中展现出良好的前景[6]。通过水体添加或者饲料添加,益生菌能够抵达幼鱼肠道,与肠道菌群相互作用并调节幼鱼的生长发育和免疫功能(表1)。然而,益生菌对幼鱼健康的调控机制还需进行深入探索。本文旨在梳理近年来益生菌在鱼体胚胎期至成鱼前的发育阶段所发挥的有益作用,讨论益生菌在幼鱼养殖中的应用情况、存在的问题以及未来的发展方向。
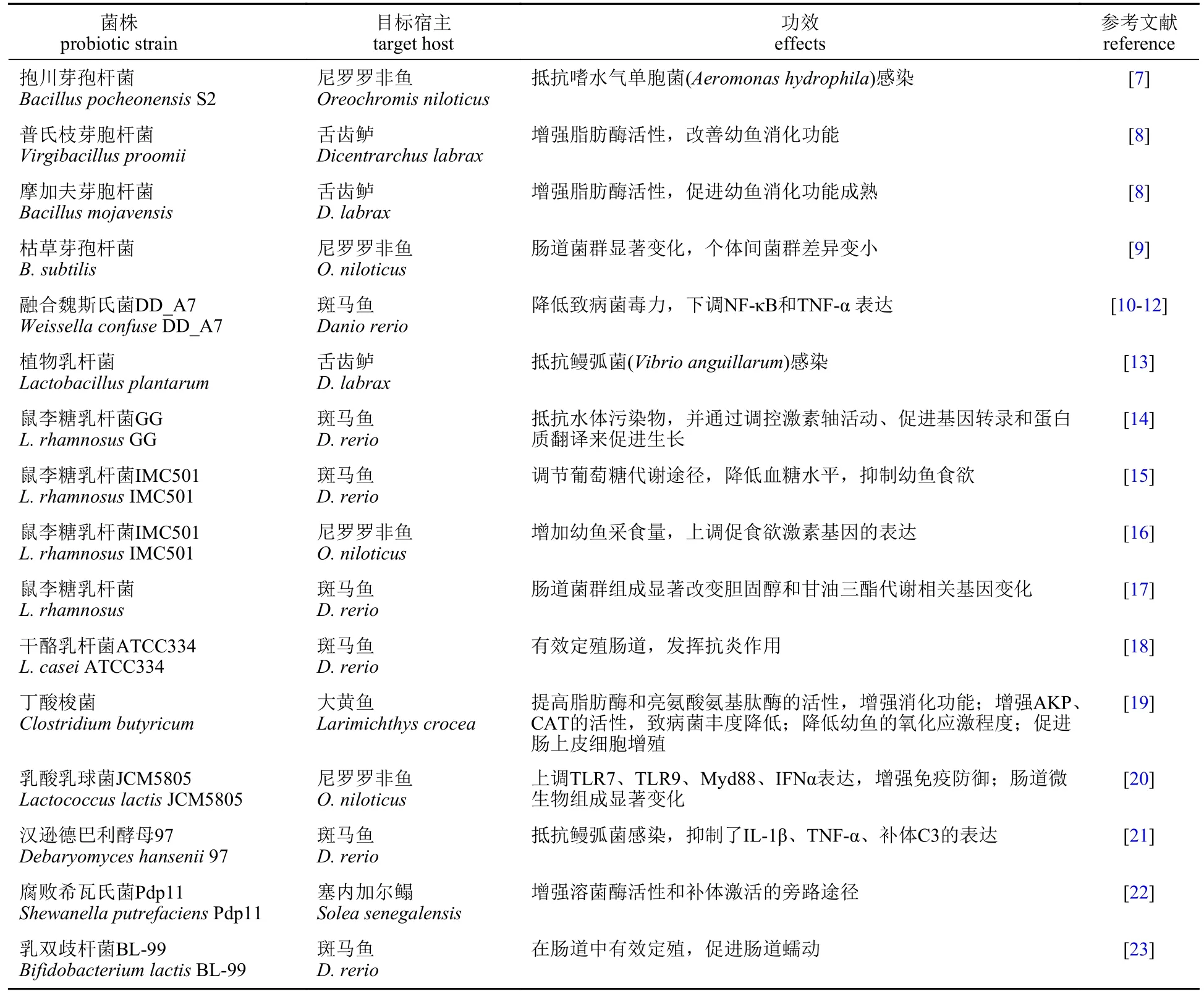
表1 近10年幼鱼养殖中的常用益生菌及其功效Tab. 1 Probiotics commonly used in juvenile fish farming in the past ten years and their effects
1 鱼类不同生长阶段的微生物组成
肠道微生物是鱼体的重要组成部分,与其他生物一样,肠道微生物的组成随着鱼体发育阶段的变化而变化[24-26]。但是与陆生动物不同的是,水体微生物对于幼鱼肠道菌群的定殖具有更加显著的影响。Bates等[27]发现在斑马鱼幼鱼中,水体中常见的气单胞菌属和假单胞菌属(Pseudomonas)是幼鱼肠道的优势物种。Xiao等[28]的研究中,12~20日龄的斑马鱼肠道中弧菌属和气单胞菌科(Aeromonadaceae)的丰度较高,累计占微生物总丰度的50%;27~42日龄,邻单胞菌属(Plesiomonas)占据优势;56~98日龄,斑马鱼肠道中鲸杆菌属(Cetobacterium)丰度显著增加至40%,而气单胞菌科下降至8.2%。这些结果说明斑马鱼的肠道微生物组成随着发育阶段的不同而出现差异,早期鱼肠道中以水体优势菌为主,而随着鱼体的营养摄取,斑马鱼肠道菌群产生演替[11]。最近的一项研究发现,斑马鱼肠道中微生物的相互作用和稳定性通常随着宿主的发育而增加,这可能是因为随着斑马鱼免疫系统的不断发育,肠道内微生物可定殖的空间增加,成年斑马鱼中微生物可用的营养物质更稳定等因素造成的[29]。目前该方面的研究主要关注鱼体不同发育阶段微生物的演替变化规律[28]。结合高通量测序技术以及相关性分析对不同发育阶段的鱼体肠道微生物进行大规模统计,有助于挖掘与鱼体发育密切相关的肠道微生物种群,而针对微生物在宿主发育中的调控作用还需更多证据。
2 益生菌对幼鱼生长发育及健康的影响
近年来的研究表明,益生菌对幼鱼生长发育及健康具有重要作用(图1),包括增强幼鱼的抗病力和免疫力、提高幼鱼抵抗水体污染物的能力、促进幼鱼对营养成分的摄取、调节幼鱼肠道菌群和增强肠道生理功能。
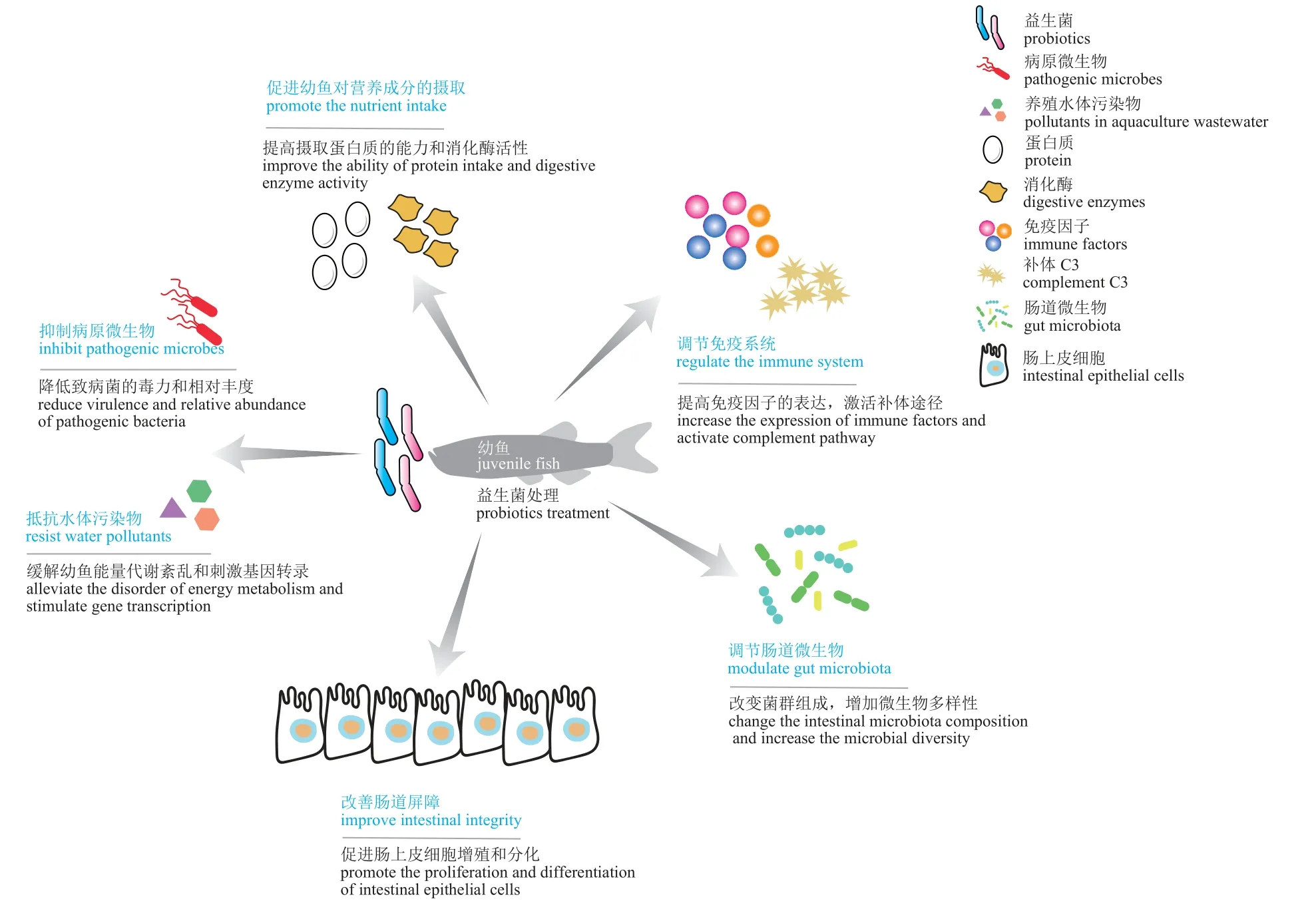
图1 益生菌对幼鱼生长发育及健康的影响Fig. 1 Influence of probiotics on the growth and health of juvenile fish
2.1 增强幼鱼的抗病力和免疫力
水产养殖中集约化程度的增加和水质的恶化导致病原体在养殖水体中迅速繁殖和传播,增加了鱼类患病的风险[30]。由于抗病性较差,幼鱼对于水环境中病原菌的感染更加敏感。大量研究表明,益生菌可以通过直接抑菌、降低致病菌毒力和增强宿主固有免疫等方式来提高幼鱼抗病力和免疫力,帮助幼鱼抵抗病原体感染。
Touraki等[13]将植物乳杆菌添加至饲料中饲喂舌齿鲈幼鱼,在鳗弧菌攻毒实验中,经植物乳杆菌处理的舌齿鲈幼鱼死亡率为14%,而未经益生菌处理的幼鱼死亡率高达54%,说明植物乳杆菌可以有效抵抗鳗弧菌的侵染。Samat等[7]发现抱川芽孢杆菌S2能在体外抑制无乳链球菌(Streptococcus agalactiae)和嗜水气单胞菌的生长。Dey等[10-11]的研究发现,融合魏斯氏菌DD_A7在体外具有抗菌和免疫刺激活性。用融合魏斯氏菌DD_A7对斑马鱼幼鱼进行12 h预处理可有效降低致病菌株大肠杆菌(Escherichia coli) O157:H7的毒力。目前的研究主要集中于评估不同益生菌在提高幼鱼抗病性方面的效果,但是对于益生菌发挥作用的关键效应分子及其抵抗病原体的具体分子机制还不明确,而益生效应分子或抗菌机制的解析将会对幼鱼养殖中抗菌策略的开发提供重要思路。
成鱼的免疫系统包括固有免疫和适应性免疫,二者协同作用以帮助鱼体抵抗病原菌的入侵[31]。在幼鱼发育的早期阶段,其适应性免疫系统尚未成熟,在此期间幼鱼主要依靠固有免疫系统作为抵抗病毒和细菌感染的第一道防线[32]。固有免疫系统通过模式识别受体识别包括脂多糖(LPS)、肽聚糖、核酸和鞭毛蛋白在内的微生物相关分子模式,诱导信号级联反应,产生细胞因子、趋化因子和其他效应分子,从而激活宿主的免疫反应[33]。已有多数研究表明,益生菌可以通过增强幼鱼的固有免疫应答来帮助幼鱼抵抗多种病原菌的侵染。研究者用融合魏斯氏菌DD_A7粉末对斑马鱼幼鱼进行12 h预处理,发现益生菌预处理使幼鱼中炎症反应相关基因NF-κB (nuclear factor-κB)和TNF-α (tumor necrosis factor-α)的表达显著下调[11]。Xia等[20]分别用低浓度和高浓度的乳酸乳球菌JCM5805连续处理罗非鱼幼鱼15 d,发现高浓度JCM5805处理组幼鱼在第5天和第10天时TLR9(toll-like receptor 9)、IRF7 (interferon regulatory factor 7)、MyD88 (myeloid differentiation primary response gene 88)和IFNα (interferon α)表达均显著增加,而在低浓度益生菌处理组,这些基因的表达未出现显著差异。在停止益生菌处理1个月后,各组之间上述基因的表达没有差异。这些结果说明,TLR -Myd88途径的激活和炎症因子的表达调控是益生菌增强幼鱼免疫防御的机制之一,而益生菌的添加浓度和添加时间直接影响益生菌的作用效果。Caruffo等[21]的研究中,用鳗弧菌感染斑马鱼幼鱼后,促炎细胞因子IL-1β (interleukin-1β)、TNF-α、补体C3 (complement 3)的表达显著上调,而益生菌汉逊德巴利酵母 97和解脂亚罗酵母(Yarrowia lypolitica) 242单独处理幼鱼后则有效抑制了IL-1β、TNF-α、补体C3的表达。Jurado等[22]发现接受益生菌腐败希瓦氏菌Pdp11处理的塞内加尔鳎幼鱼中溶菌酶的活性显著升高,且补体激活的旁路途径活性显著增强。溶菌酶活性的高低反映了鱼体先天性免疫应答的强弱,与鱼体的年龄、大小及营养状况等因素有关,同时溶菌酶对革兰氏阳性和革兰氏阴性菌也显示出不同的抗菌活性[34]。上述研究表明,固有免疫系统的激活是益生菌增强幼鱼免疫力的主要途径,同时补体途径等其他免疫相关通路也参与了益生菌对幼鱼免疫系统的调节,但是关于益生菌的添加对适应性免疫系统的发育和成熟是否存在长期的影响还鲜有报道。
2.2 提高幼鱼抵抗水体污染物的能力
水环境污染物也是影响幼鱼生长的一大因素,水环境中多种污染物对养殖动物的生长发育和健康造成了严重威胁[35]。近年来,研究表明益生菌的应用可有效提高幼鱼对水体环境污染物的耐受性。Liu等[14]将斑马鱼幼鱼暴露于水体污染物全氟丁烷磺酸(perfluorobutanesulfonate,PFBS),并用鼠李糖乳杆菌LGG处理幼鱼,结果显示益生菌处理的斑马鱼幼鱼的体长显著增加。通过蛋白质组学分析,研究者发现益生菌的添加可能缓解了PFBS引起的能量代谢紊乱,从而使能量更多地用于幼鱼生长。同样的,Hu等[35]通过代谢组和转录组分析,发现益生菌驱动了暴露于PFBS的斑马鱼幼鱼代谢谱的改变,其中,与DNA甲基化相关的代谢物下调,与DNA去甲基化相关的基因表达上调。DNA甲基化标记的丢失导致基因转录和蛋白质表达过程的增强,这可能是益生菌缓解PFBS发育毒性的机制。Sun等[36]则发现在PFBS暴露的情况下,益生菌可能通过调控下丘脑-垂体-甲状腺轴和下丘脑-垂体-肾间轴协同促进斑马鱼幼鱼的生长。
从现有的研究来看,微生物可以通过直接吸附或降解等方式来降低水体中污染物的浓度,从而保护幼鱼免受污染物胁迫。Mohite等[37]发现汉氏葡糖酸醋杆菌(Gluconoacetobacter hansenii)产生的细菌纤维素能够有效吸附铅、镉、镍等不可降解的潜在有毒元素(potentially toxic elements,PTEs)。革兰氏阳性益生菌如乳杆菌属、双歧杆菌属细菌的细胞壁具有多种官能团,能够提供去除PTEs的硫酸盐、磷酸盐、羧基和氨基等活性位点,这些官能团能与重金属离子结合,达到降低毒物浓度的效果,使这类细菌具有良好的PTEs去除能力[38]。另一方面,研究者发现枯草芽孢杆菌[39]和罗伊氏乳杆菌(L. reuteri)[40]对环境化学污染物双酚A具有较高的降解能力,有效降低培养基中双酚A的浓度。虽然益生菌对于水体污染物缓解的作用不大相同,但通过解析微生物中具有特异性污染物降解能力的元件,并利用合成生物学技术改造益生菌,对于扩大益生菌在幼鱼养殖中的应用范围有积极作用。
2.3 促进幼鱼对营养的摄取
益生菌的施用会对鱼类摄取营养的过程产生一定影响,在成鱼上,这些作用包括提高饲料消化率[41]、改善消化酶活性[42]、调控糖脂代谢[43]等。在幼鱼上的研究也表明,益生菌可以通过促进消化酶活性和摄食来增强幼鱼对饲料中营养成分的摄取,从而提高幼鱼的生长性能。幼鱼的肠道微生物组中有一些能够分泌纤维素酶、淀粉酶、蛋白酶、几丁质酶和脂肪酶等的微生物,这些酶在饲料分解利用中发挥关键作用[44]。Yin等[19]用含丁酸梭菌的饲料饲喂大黄鱼幼鱼,发现益生菌的补充显著提高了幼鱼脂肪酶和亮氨酸氨基肽酶的活性,表明益生菌有助于改善幼鱼的消化能力,促进幼鱼消化功能的成熟。Hamza等[8]的研究同样报道了两株益生菌(普氏枝芽胞杆菌和摩加夫芽胞杆菌)对舌齿鲈幼鱼胰蛋白酶、脂肪酶以及亮氨酸氨基肽酶活性的增强作用。
研究者以尼罗罗非鱼幼鱼为实验模型,将鼠李糖乳杆菌IMC 501添加在饲料中以饲喂幼鱼,结果表明,补充益生菌组的幼鱼采食量显著增加,同时促食欲激素的基因表达上调[16]。由于幼鱼体积较小,益生菌对于幼鱼营养摄入的研究证据也仅停留在幼鱼的采食量和基因表达等表观水平。Rawls等[45]通过光学显微镜和透射电镜对受精后6 d的斑马鱼进行了仔细的形态学观察,同时转录组分析表明微生物在肠道的定殖促进斑马鱼幼鱼法尼基二磷酸合酶(recombinant farnesyl diphosphate synthase,FDPS)和载脂蛋白B的表达,这也说明,微生物在斑马鱼幼鱼脂质代谢调控中发挥重要作用。目前关于益生菌促进幼鱼生长的分子机制研究还较少,但在黑腹果蝇(Drosophila melanogaster)上已有较为深入的研究。Storelli等[46]从果蝇肠道中分离到一株植物乳杆菌,将该菌添加到果蝇培养基中,发现植物乳杆菌能够促进果蝇幼虫对培养基中蛋白质的同化作用,从而增加支链氨基酸的水平,刺激雷帕霉素靶蛋白(target of rapamycin,TOR)的活性,进而通过上调类固醇激素蜕化激素(ecdysone,Ecd)和果蝇胰岛素样肽(drosophilainsulin like peptide,dILP)的表达来缩短果蝇幼虫羽化的时间、提高幼虫的生长速率。Matos等[47]通过转座子在植物乳杆菌中随机插入片段,发现植物乳杆菌细胞壁中磷壁酸的D-丙氨酰化对植物乳杆菌介导的促生长作用是不可或缺的。这些研究表明,益生菌能够通过促进饲料中营养素的同化和刺激生长轴的活性来促进动物幼年阶段的生长发育,其中,益生菌细胞壁组分对于益生菌的促生长作用非常重要。果蝇中的研究也说明,通过对益生菌进行的某些基因进行敲除或者过表达,对于揭示益生菌促进幼鱼生长发育的机制具有重要作用。
2.4 调节幼鱼肠道微生物
健康的肠道微生态是幼鱼正常生长发育的重要因素。大量证据表明,宿主-微生物相互作用也有可能成为幼鱼生存能力差、存活率低的主要原因[48-49]。益生菌的添加能够有效调节幼鱼的肠道微生物组成。Falcinelli等[17]的研究发现,与对照组相比,用鼠李糖乳杆菌处理斑马鱼幼鱼6 d后,其肠道微生物组成改变,厚壁菌门(Firmicutes)丰度增加,放线菌门(Actinobacteria)丰度降低。Yin等[19]的研究中,饲喂丁酸梭菌的大黄鱼幼鱼肠道微生物组成发生变化,其中丁酸梭菌的丰度大幅增加,而包括假单胞菌目(Pseudomonadales)在内的潜在致病菌的丰度显著降低,同时肠道菌群的α多样性显著降低,说明益生菌可以有效调节幼鱼肠道菌群,且益生菌引起的肠道菌群变化与幼鱼的生长和代谢密切相关。Giatsis等[9]的研究发现,暴露于枯草芽孢杆菌水体环境中7 d的罗非鱼幼鱼肠道菌群发生显著变化,且益生菌处理组罗非鱼幼鱼的个体间差异更小,说明在鱼类早期发育阶段施用益生菌有利于不同个体间肠道菌群的趋同。Xia等[20]发现施用108CFU/mL 乳酸乳球菌JCM5805的罗非鱼幼鱼肠道菌群与对照组相比存在显著差异,且在停用益生菌后该差异仍然存在,肠道菌群的变化通过TLR7/TLR9-Myd88信号通路使IFN-α的表达显著上调,最终增强了罗非鱼幼鱼的抗病能力。这些研究说明,益生菌能够引起幼鱼的肠道微生物组发生变化,这种变化可能持续一段时间并显著影响幼鱼的健康状态,同时益生菌还通过降低肠道致病菌丰度、调节免疫相关基因表达增强幼鱼的抗病能力。虽然通过高通量测序技术,可以较为直接地反映鱼肠道微生物的组成情况,但是针对肠道微生物功能的解析目前还需要开展大量的工作。我们要明确对于在门水平上的微生物变化只能作为参考,但难以得出明确的结论,微生物的功能解析要以菌株为单位;其次,微生物功能解析要关注因果性而不仅仅是相关性,所以无菌或限菌模型的构建以及单一变量下微生物的功能分析都是必要且重要的。
2.5 调节幼鱼肠道生理功能
肠道功能包括转运和消化食物、吸收营养、进行排泄等,因此肠道细胞的增殖和肠道功能的发育对机体的生长至关重要。脊椎动物消化道的发育受到肠道微生物组成的显著影响[50]。肠上皮细胞是肠道屏障的重要组成部分,研究证实,鱼类肠道微生物促进上皮细胞的分化和成熟。肠道微生物的缺失会导致幼鱼肠道发育受损,从而影响鱼体对营养的吸收和同化。Rawls等[45]证明斑马鱼幼鱼的肠道微生物强烈影响肠上皮细胞的更新和肠细胞的形态,定量5-溴脱氧尿苷标记显示受精后6 d的无菌斑马鱼肠上皮细胞的增殖率显著降低。同时,Bates等[27]的研究发现,肠道微生物的缺乏阻碍了斑马鱼肠道上皮细胞的分化和成熟,8日龄的无菌斑马鱼中肠道碱性磷酸酶(alk-aline phosphatase, AKP)的活性显著降低,且大豆凝集素(soybean agglutinin,SBA)和凝集素(Griffonia simplicifoliaisolectin B4)的表达模式失常,而这2种糖缀合物的正常表达是肠上皮成熟的标志之一。另外,研究者给受精后8 d的斑马鱼幼鱼饲喂辣根过氧化物酶(horseradish peroxidase,HRP)溶液以观察其对蛋白质的摄取能力,通过HRP染色表征斑马鱼对HRP的摄取情况,结果发现在无菌斑马鱼幼鱼肠道中几乎未观察到HRP染色,而微生物定殖的斑马鱼表现出正常的HRP吸收,说明肠道微生物对蛋白质大分子的摄取是必需的。Chen等[23]用108CFU/mL的乳双歧杆菌BL-99处理5日龄斑马鱼幼鱼,通过荧光立体显微镜观察便秘模型斑马鱼对荧光染料的排泄能力,发现BL-99的处理能够显著促进排泄受限的幼鱼的肠道蠕动。上述研究说明,肠道微生物不仅刺激肠细胞本身的分化和增殖,还会对肠道功能如摄取蛋白的能力、排泄能力造成影响。Padeniya等[51]将斑马鱼幼鱼置于含有19株活乳酸菌的益生菌溶液的培养皿中培养,发现益生菌处理后的斑马鱼幼鱼胃肠道的线粒体活性显著增加,反映了幼鱼初始代谢功能的发生和发展。Yin等[19]的研究发现,摄食了饲料中补充丁酸梭菌的大黄鱼幼鱼肠道绒毛和肠细胞的高度显著高于不加菌的对照组,同时肠上皮细胞增殖和分化相关基因如紧密连接蛋白基因zo-2和鸟氨酸脱羧酶odc的表达显著上调。这些结果说明,益生菌在有效黏附于幼鱼肠道的条件下,通过刺激肠上皮细胞增殖相关基因的表达促进肠上皮的增殖和分化,同时通过促进肠道蠕动、增强肠道代谢活动等机制来促进幼鱼肠道功能的发育。然而,目前关于益生菌如何影响肠道功能的研究大多局限在肠道消化酶活性以及炎症和肠道屏障等相关基因表达的检测。在研究方法和技术手段上,体内实验和体外实验对于益生菌的功能评价都是至关重要的。在成鱼上,尤斯室和异硫氰酸荧光素(fluorescein isothiocyanate , FITC)标记的葡聚糖已经用于在体外和体内检测鱼体的肠道通透性。在幼鱼中,荧光标记底物的使用及观察对于评价益生菌调节幼鱼肠道功能具有较强的可行性。
3 小结和展望
综上,在幼鱼阶段施用益生菌能够帮助其抵抗外界环境的压力、增加营养摄取、增强免疫力和抗病力、促进肠上皮细胞的分化和成熟以及调节肠道菌群的平衡。益生菌对幼鱼的影响是多方面的,但目前的相关研究更多地关注益生菌施用所引起的幼鱼表型的变化,而有关益生菌作用的分子机制还需更加系统和深入地研究。随着组学和生物信息学的快速发展,我们可以利用这些技术评估益生菌对幼鱼基因、代谢和肠道微生物的整体影响。除了在体实验,体外实验可能更有助于解析益生菌本身的功能。通过转座子诱变、基因敲除等手段对益生菌进行基因工程改造,从而获得某些细菌功能或组分缺陷的菌株,可能有利于明确益生菌中发挥益生作用的效应分子,这些研究手段的完善和分子机制的深入研究对幼鱼养殖实践中益生菌的施用和抗菌物质的开发至关重要。
目前已有大量研究证实益生菌对鱼类早期发育具有明显的促进作用,但是这些研究大多是在实验室水平证明了益生菌对幼鱼的有益影响。实际上,对于大规模幼鱼养殖实践中的益生菌施用还需考虑种类、剂量、效用持续时间等问题。例如,同一株益生菌在不同种鱼类中的作用可能不同,同一菌株不同浓度的添加可能对幼鱼的影响呈现出剂量效应。水体添加和饲料添加也会在很大程度上影响益生菌的施用效果。此外,不同益生菌联用可显著改善幼鱼的生长和存活率,但在大多数研究中,益生菌的复配是根据其体外抗菌活性进行选择的,这种施用策略可能限制了益生菌对幼鱼有益作用的最大化。
目前关于益生菌对幼鱼发育影响的研究主要关注其对鱼体的益生作用,但是益生菌的施用无疑会影响幼鱼生存环境中的微生物群落,这对整个养殖生态系统是否存在负面影响也值得关注,探索绿色、可持续的益生菌施用策略将有助于缓解其可能带来的生态环境失调。从长远来看,益生菌对幼鱼生长发育的有益作用会受到水产养殖业越来越多的关注,相关研究的持续深入对改善水产养殖中的幼鱼健康、提高鱼苗产量具有重要意义。
(作者声明本文无实际或潜在的利益冲突)

