异基因造血干细胞移植治疗ASXL1基因突变的骨髓增生异常综合征患者的效果
张玉培 谢新生 石雅洁 曹伟杰 郭荣 万鼎铭
郑州大学第一附属医院血液科(郑州 450000)
骨髓增生异常综合征(MDS)是一种克隆性造血恶性肿瘤,可引起形态学骨髓发育不良以及贫血、中性粒细胞减少或血小板减少,与急性髓系白血病(AML)风险增加相关。随着分子检测技术的发展,基因突变在MDS 的诊断、精确的预后评估中占据重要地位[1-3]。文献[4-6]报道ASXL1 在MDS患者中的突变频率为10% ~ 20%,且提示预后差,有研究分析了ASXL1+的MDS 患者的临床特征,但这类患者对不同治疗手段反应的研究较少,异基因造血干细胞移植(allo-HSCT)对这类患者的疗效目前尚未见报道。本研究旨在分析75 例ASXL1+MDS 患者的临床特征,通过比较化疗和移植的疗效,探讨allo-HSCT 治疗ASXL1+的MDS 患者的疗效及影响因素。以期为此类患者的临床诊疗提供参考。
1 资料与方法
1.1 研究对象 对2018 年6 月至2021 年12 月期间就诊于郑州大学附属第一医院的247 例MDS 患者进行回顾性分析,MDS 诊断、分类及疗效评价参照文献标准[7-10]。本研究经郑州大学附属第一医院伦理委员会批准(编号:2022⁃KY⁃1158-002)。所有患者均行二代测序(NGS)检测,检出ASXL1+75(30.4%)例。MDS-SLD 3 例,MDS-MLD 27 例,MDSEB-1 25 例,MDS-EB-2 20 例。
1.2 二代测序方法 初诊患者抽取骨髓液2 mL,应用AML/MDS 第二代测序芯片检测NPM1、FLT3、C-KIT、CEBPA、DNMT3A、IDH1、IDH2、TET2、EZH2、RUNXl、ASXLl、PHF6、TP53、SF3BI、SRSF2、U2AF1、ZRSR2、NRAS、CBL、SETBP1、ETV6、JAK2 等22 种基因突变情况。
1.3 治疗 根据患者的一般状况、血常规、外周血分类、基因突变、染色体、FISH 等检查结果制定,决策患者接受移植或化疗的主要依据为《骨髓增生异常综合征中国诊断与治疗指南(2019 年版)》。43 例接受去甲基化(地西他滨单药诱导)治疗或去甲基药物联合预激方案(地西他滨联合CAG/IAG)治疗,10 例接受对症支持治疗。22 例接受allo-HSCT,其中移植前接受对症支持治疗4 例,接受去甲基化治疗11 例,接受去甲基药物联合预激方案治疗7 例,移植前处于完全缓解的有12 例,移植前未缓解的有10 例。移植患者均采用改良Bu/Cy 方案进行预处理,单倍体供者及无关供者在移植时加用ATG;应用“短程甲氨蝶呤(MTX)+环孢素A(CsA)+吗替麦考酚酯(MMF)”预防移植物抗宿主病。移植后定期行骨髓穿刺术评估患者供受者嵌合状态和疾病状态。发生移植物抗宿主病时给予甲泼尼龙[1.0 ~ 2.0 mg/(kg·d)]等药物治疗。
1.4 研究终点和定义 随访截止日期为2023 年5 月31 日。总生存(OS):确诊日至末次随访或死亡;无进展生存(PFS):确诊日至复发、末次随访或死亡。粒细胞植入时间:回输后连续3 d 中性粒细胞绝对值≥ 0.5 × 109/L 的第1 天;血小板植入时间:未输注血小板情况下,回输后连续7 d 血小板≥ 20 × 109/L 的第1 天。
1.5 统计学方法 使用SPSS 26.0 统计学软件,GraphPad Prism 8.0、R 4.2.1 软件绘图。计量资料采用均数±标准差或M(P25,P75)表示,计数资料采用例(%)表示。分类资料比较用χ2检验、Fisher精确概率法,连续资料用Mann-WhitneyU检验,Kaplan-Meier 法绘制生存曲线,Log-rank 法作单因素分析,多因素分析用Cox 回归模型。以P< 0.05为差异有统计学意义。
2 结果
2.1 临床特征 75 例ASXL1+患者中,男50 例(66.7%),女25 例(33.3%),中位年龄50(40,57)岁。初诊时中位WBC 2.45 (1.80,3.30)× 109/L、PLT 38(23,76)× 109/L、Hb 71(57,88)g/L。中位骨髓原幼细胞比例为6.0(2.4,10.2)%。IPSS-R 评分:低危4 例(5.33%),中危17 例(22.67%),高危38 例(50.67%),极高危16 例(21.33%)。10 例接受对症支持治疗,43 例接受化疗,22 例接受allo-HSCT。移植组和化疗组对比发现,仅在中位年龄方面两组差异有统计学意义(P< 0.001)(表1)。
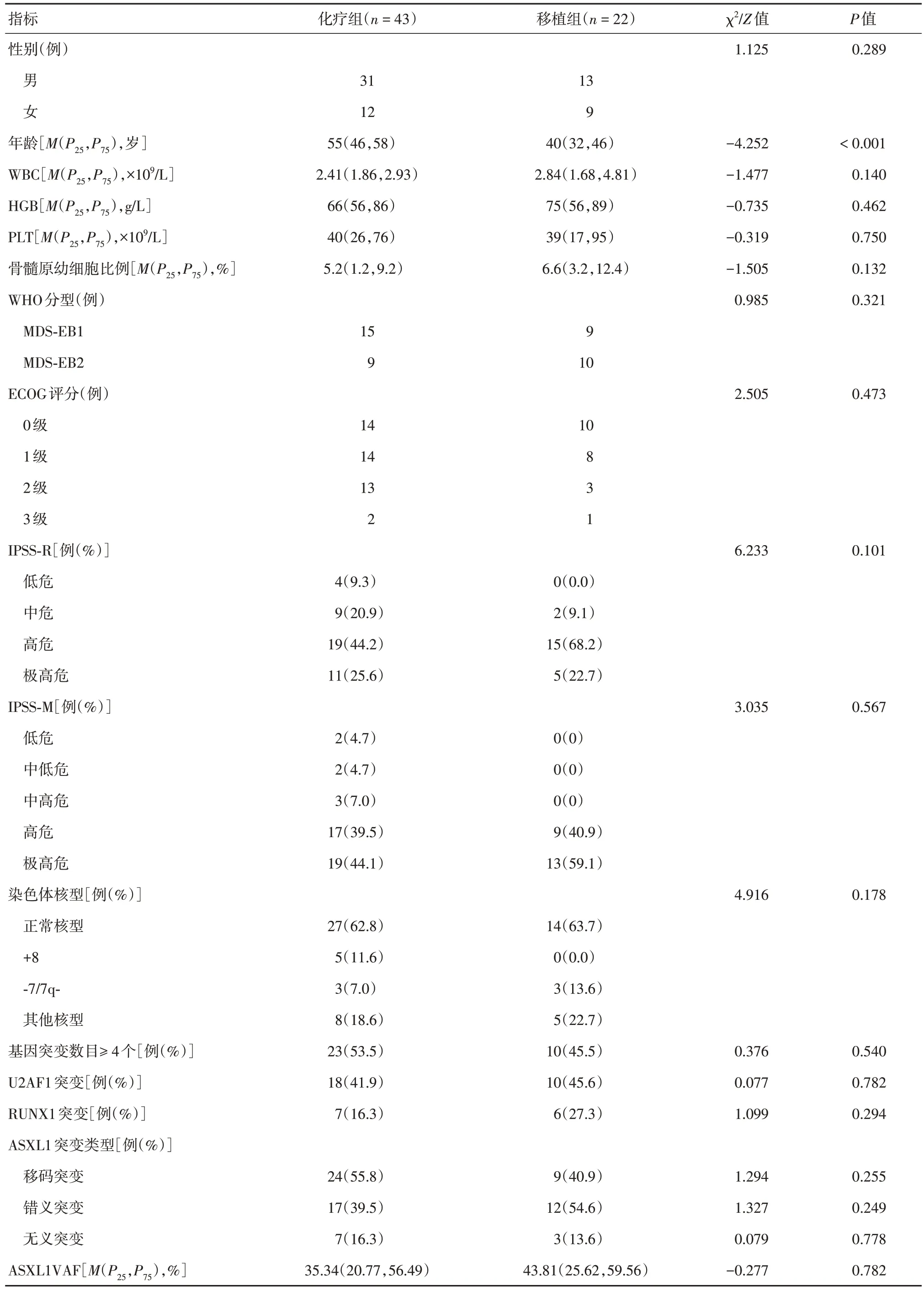
表1 75 例ASXL1 基因突变骨髓增生异常综合征患者临床特征Tab.1 Clinical features of 75 patients with ASXL1 gene mutation myelodysplastic syndrome
2.2 ASXL1+患者共突变检测 75 例ASXL1+患者中71 例(94.7%)同时检测到其他基因突变。与ASXL1+同时存在的突变率较高的基因为TET2(72.0%,54/75)、U2AF1(38.7%,29/75)、RUNX1(17.3%,13/75)、TP53(12.0%,9/75)、ETV6(9.3%,7/75)、SETBP1(8.0%,6/75)、PHF6(8.0%,6/75)、NRAS(6.7%,5/75)、CEBPA(6.7%,5/75)等(图1)。

图1 ASXL1+ MDS 患者基因突变谱Fig.1 Gene mutation spectrum of patients with ASXL1+ MDS
75 例ASXL1+的患者中检出 87 个ASXL1 突变位点均位于12 号外显子,包括41 例(47.12%)移码突变,35 例(40.23%)错义突变,11 例(12.64%)无义突变;c.1927dupG (pG642fs)移码突变19 例,c.1888_1910de1(pH630fs)移码突变9 例,其他12 个突变位点移码突变13 例。c.G1954A(pG652S)错义突变29 例,c.C3692T(pS1231F)错义突变4 例,其他2 个突变位点移码突变2 例。87 个突变位点的中位等位基因变异频率(VAF)为42.93(18.10,58.39)%。以ASXL1 基因VAF 值中位数为阈值分为ASXL1 高突变负荷组(ASXL1 VAF > 42.93%,化疗组21 例,移植组10 例)和ASXL1 低突变负荷组(ASXL1 VAF ≤ 42.93%,化疗组22 例,移植组12 例)。
2.3 生存分析 截至2023 年5 月31 日,整体中位随访时间为14.13(4.93,25.55)个月,移植组中位OS 时间16.76(5.73,28.38)个月,而化疗组中位OS时间13.03(3.00,22.61)个月。移植组2 年OS 及PFS 率较化疗组显著增加(P< 0.05)(图2)。移植组ASXL1 低突变负荷组2 年OS 及PFS 率较ASXL1高突变负荷组显著增加(OS:77.8%vs.30.8%,P=0.028;PFS:66.7%vs.30.8%,P= 0.055),化疗组ASXL1 低突变负荷组与ASXL1 高突变负荷组2 年OS 及PFS 率差异无统计学意义。

图2 移植组和化疗组患者的生存分析Fig.2 Survival analysis of patients in transplantation groups and chemotherapy groups
在22 例接受allo-HSCT 的ASXL1+患者中,诊断到移植的中位时间为6.27 个月,IPSS-M 评分为高危有9 例(40.9%),极高危13 例(59.1%),极高危患者的2 年OS 率及2 年PFS 率较高危患者显著降低(OS:30.8%vs.77.8%,P= 0.040;PFS:30.8%vs.66.7%,P= 0.100);RUNX1+6 例(27.3%),U2AF1+10(45.5%)例,RUNX1+患者较RUNX1-患者、U2AF1+患者较U2AF1-患者的2 年OS 率及2 年PFS 率均显著降低(P< 0.05,图3、4)。
美国是一个移民国家,在意识形态上深受唯意志论和自由主义的影响,强调发挥个人力量和承担个人责任,在不具有悠久历史与继承传统的情况下,其社会融合度和社会认同度比不上西欧的许多单一民族国家。不过,看似不具备福利国家条件的美国却是世界上最早实行系统的社会保障制度的国家[1]99。事实上,自从20世纪30年代以来,美国社会保障模式就地位和意义而言已经成为一种与欧洲社会保障模式并列的资本主义福利模式。笔者认为美国的社会保障制度经过一个漫长的发展过程后更加成熟完善,在西欧模式陷入低潮的今天,它或许能更好地给各国社会保障改革提供借鉴。
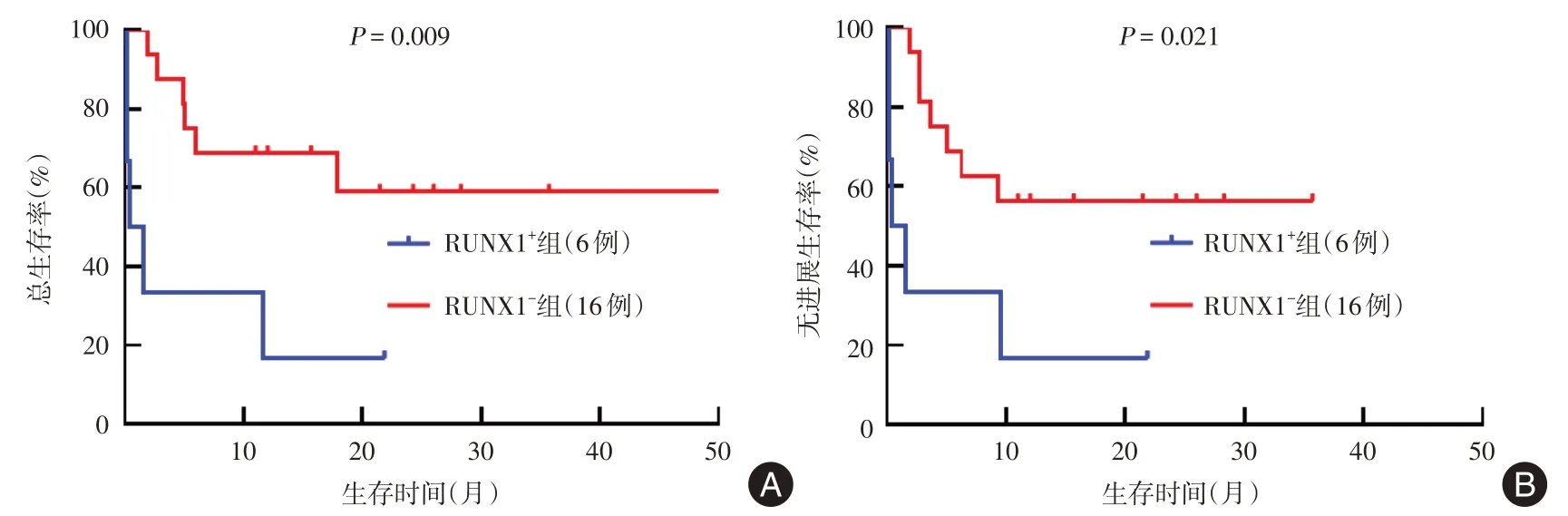
图3 移植患者中RUNX1+与RUNX1-患者的生存分析Fig.3 Survival analysis of RUNX1+ versus RUNX1- patients in transplant patients

图4 移植患者中U2AF1+与U2AF1-患者的生存分析Fig.4 Survival analysis of U2AF1+ versus U2AF1- patients in transplant patients
2.4 移植疗效及影响因素 接受allo-HSCT 的22例患者输注单个核细胞(MNC)中位数5.5(3.6,11.97) × 108/kg、CD34+细胞中位数5.79(2.50,16.98)× 106/kg。血小板、中性粒细胞中位植入时间分别为13(10,27)、12(9,19) d。5 例(22.7%)在移植后发生了急性GVHD(aGVHD),发生的中位时间及范围为移植后34(19,95) d,其中发生aGVHD 分度为Ⅲ度4例(18.2%),Ⅳ度1例(4.5%)。3例(13.6%)在移植后发生了慢性GVHD,发生的中位时间及范围为移植后272(179,350)d。
在ASXL1+患者接受allo-HSCT 的背景下进行单因素分析,P< 0.05 纳入多因素分析结果显示,ASXL1高突变负荷、U2AF1+为影响患者OS的危险因素。U2AF1+为影响患者PFS的危险因素(表2、3)。
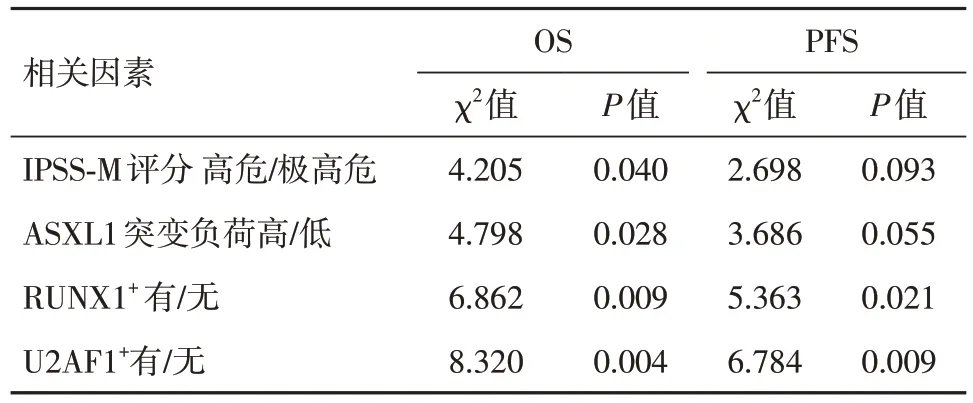
表2 22 例ASXL1 基因突变骨髓增生异常综合征移植患者预后影响因素的单因素分析Tab.2 Univariate analysis of prognostic factors in 22 transplant patients with ASXL1 gene mutation myelodysplastic syndrome

表3 22 例ASXL1 基因突变骨髓增生异常综合征移植患者预后影响因素的多因素分析Tab.3 Multivariate analysis of prognostic factors in 22 transplant patients with ASXL1 gene mutation myelodysplastic syndrome
3 讨论
克隆性造血是血液系统肿瘤发生必要而不充分条件,是恶性克隆多阶段、多步骤系列打击事件的起点和克隆起源,ASXL1 是克隆性造血和MDS患者中最常见的突变之一,ASXL1是果蝇附加性梳样1基因的人类同源物,位于染色体20q11上,编码多梳基团和胸腺复合体家族的染色质结合蛋白,通过与类固醇受体辅活化子-1 结合作为维甲酸受体的共激活因子,参与表观遗传调控并与其他共突变基因相互作用促进疾病发展[11-12]。其突变导致缺乏C 末端PHD 结构域的截短蛋白表达,使人类造血干细胞和造血祖细胞产生了一种MDS 样表型,损伤正常的集落形成,导致骨髓细胞成熟受损[13]。
有研究[14]表明ASXL1 突变通过抑制野生型ASXL1 与BAP1 相互作用,从而损害BAP1-ASXL1-FOXK1/K2 转录网络在调节靶基因和白血病细胞生长中的功能而导致髓系肿瘤发生,然而ASXL1如何调控特定靶基因以及ASXL1 的C 端截断如何促进髓系肿瘤的发生目前尚不清楚,且ASXL1 突变的患者中许多人都有多个驱动基因突变,这使得对单一突变的风险评估具有挑战性。因此尚需要大量进一步的研究揭示其神秘面纱。
ASXL1 在不同类型的骨髓恶性肿瘤患者中经常发生突变,通常与恶性髓系疾病的侵袭性行为和不良临床预后相关[15-16]。关于allo-HSCT 治疗ASXL1+的MDS 患者的疗效及预后影响因素的研究目前尚未见报道,本研究结果显示移植组2 年OS 及PFS 率较化疗组显著增加,allo-HSCT显著改善了ASXL1+MDS 患者的预后,ASXL1 高突变负荷、U2AF1+是影响移植后长期生存的危险因素。
分析ASXL1+患者基因突变谱发现,与ASXL1+同时存在的突变率较高的基因是TET2(72.0%)、U2AF1(38.7%)、RUNX1(13.3%),本研究结果与文献[18-19]报道相一致,ASXL1 突变常与表观遗传因子、剪接因子、转录因子突变共存,研究[5,20]表明,MDS 患者伴有U2AF1 基因突变往往提示预后不良及高转白风险,本研究在ASXL1+患者接受allo-HSCT 的背景下,U2AF1+的患者移植后2 年OS 率、PFS 率显著降低,提示存在此基因突变的MDS 患者预后更差。此外,本研究中提示ASXL1高突变负荷的患者allo-HSCT 后预后不佳。通过多因素分析发现,allo-HSCT 显著改善了ASXL1+MDS 患者的预后,ASXL1 高突变负荷、U2AF1+是影响移植疗效的独立危险因素。
MDS患者预后差异大,应进行分层化和个体化治疗,国际预后评分系统-分子风险评分(IPSS-M)[9]纳入了基因突变的指标,进行精确的预后风险评估,本研究对IPSS-M 评分进行预后分析,单因素分析发现移植组IPSS-M 评分为极高危患者OS 更低,纳入多因素分析后结果差异无统计学意义。考虑本中心二代测序检测22 种基因突变,IPSS-M 评分中部分基因突变指标未检测,导致IPSS-M 评分准确度下降。本研究也存在一些局限性。首先,本研究是回顾性研究,尽管移植组和化疗组两组患者除中位年龄外临床特征无明显的差异。其次,此研究是基于单中心的研究,样本量不大和不可避免的选择偏倚。第三,疾病不同亚型、患者经济条件等因素对研究的影响不能忽视。为了最终阐明allo-HSCT 治疗ASXL1+的MDS 患者的疗效及影响因素,尚需要进行大型、设计良好的前瞻性研究。
【Author contributions】ZHANG Yupei performed the study,ana⁃lyzed the data and wrote the article.SHI Yajie performed the experi⁃ments.CAO Weijie,GUO Rong and WAN Dingming revised the ar⁃ticle.XIE Xinsheng designed,revised and reviewed the article.All au⁃thors read and approved the final manuscript as submitted.

