茵陈蒿汤协同脐带间充质干细胞所释放的外泌体对急性肝衰竭及肝细胞焦亡的影响
谢丹 欧阳石
广州医科大学附属第五医院感染性疾病科,广东高校生物靶向诊治与康复重点实验室(广州 510515)
急性肝衰竭(acute liver failure,ALF)是指在既往没有慢性肝病的基础上突发出现大量肝细胞死亡所致的一系列临床综合征的总称,其发展过程迅速、预后较差,致死率较高(28 d 死亡率达32%),是肝病患者死亡的主要原因[1]。近年来研究表明ALF 的发生是由于致病因素(如病毒、细菌及药物等)作为损伤相关分子模式(damage associated molecular patterns,DAMPs)或病原体相关分子模式(pathogen associated molecular patterns,PAMPs),结合细胞表面的模式识别受体(pattern recognition receptor,PRR)后激活细胞内信号通路,切割半胱氨酸蛋白酶⁃1(cysteinyl aspartate specific proteinase,Caspase⁃1),其经过切割后变成Cleaved⁃Caspase⁃1,后者是前者的活化形式,组装成炎症小体,经过一系列蛋白的激活,最终在细胞膜上形成孔隙,引发细胞肿胀直至破裂,释放细胞内容物及炎症因子白介素(interleukin,IL)⁃1β、IL⁃18,进而趋化更多炎症细胞的聚集,加重炎症反应,这一过程被称为细胞焦亡[2]。细胞焦亡作为一种新型细胞死亡方式,在近年来被认为是ALF 中常见的死亡方式[3],并且越来越多的研究发现能通过抑制肝细胞焦亡达到缓解ALF 肝损的目的[4-5],因此被认为是ALF的潜在治疗手段之一。
随着现代生物技术的发展,干细胞移植称为治疗ALF 的新兴方式[6-8]。而人脐带来源的间充质干细胞(umbilical cord mesenchymal stem cells,ucMSCs)因低免疫原性、易获取被认为是最合适的移植来源。近年来,ucMSCs 无论在临床以及小鼠模型中均被证实具有减轻肝脏损伤,改善肝功能的作用[9⁃11]。深入研究发现ucMSCs 主要是通过旁分泌释放的细胞外囊泡,即外泌体(ucMSCs⁃exosome,ucMSCs⁃exo)来发挥相应的调控作用。外泌体是一种直径为30 ~ 150 nm 的双层膜囊状结构[12],具有稳定性、生物相容性、通透性等生物特性,被认为是细胞间传递信息的基本媒介[13]。已被证明ucMSCs⁃exo 所释放的IL⁃10 可以通过抑制肝细胞焦亡达到减轻ALF 的肝损,从而起到治疗的作用[14]。
ALF 在中医领域认为湿热蕴结是其始动病理因素且贯穿疾病全程,因此中医治疗ALF 常常以清热祛湿、凉血化瘀为治疗核心。茵陈蒿汤出自《伤寒杂病论》,由茵陈、大黄、栀子组成,具有清热利湿、疏利肝胆功效,因此在中医中常作为基础方用于ALF 的治疗[15]。而茵陈蒿汤是否能协同ucMSCs 及外泌体减少肝细胞死亡,尤其是肝细胞焦亡,从而达到缓解ALF 的肝损的能力尚未被探索,其次在ALF 中应用茵陈蒿汤协同ucMSCs⁃exo的中西医结合治疗手段也尚未被挖掘。因此,本研究拟通过探讨茵陈蒿汤联合ucMSCs 治疗ALF的作用,并进一步探讨ucMSCs⁃exo 发挥的抗肝细胞焦亡作用,为后续中西药结合应用于临床治疗ALF 提供实验依据。
1 材料与方法
1.1 动物/细胞 6 ~ 8 周龄SPF 级雄性C57BL/6小鼠50 只(广州锐格生物科技有限公司),操作符合中华人民共和国《实验动物管理条例》规定及伦理要求。人肝细胞株LO2细胞(武汉普赛诺生命科技有限公司);UcMSCs 在广州医科大学附属第五医院伦理委员会批准及孕妇的知情同意的情况下,脐带取自我院健康足月孕妇,并于2 h 内送至我院前沿医学交叉中心实验室进行ucMSCs 的提取及制备。本研究经广州医科大学附属第五医院伦理委员会伦理审批(No.KY01⁃2021⁃09⁃09)。
1.2 药物 茵陈蒿汤由茵陈18 g、栀子12 g、大黄6 g 构成。购自广州医科大学第五附属医院及药店,将中药颗粒混合搅匀,经过灭菌包装成袋状供实验中使用。
1.3 主要试剂及仪器 流式抗体CD34⁃PE、CD45⁃FITC、CD29⁃PE、CD90⁃PE、CD44⁃PE、CD73⁃PE、CD105⁃PE(美国eBioscience 公司);CD9 抗体、CD63 抗体、Caspase⁃1 抗体、Cleaved⁃Caspase⁃1 抗体(美国Santa Cruz 公司);IL⁃1β、IL⁃18 ELISA 试剂盒(美国Thermo Fisher 公司);D⁃氨基半乳糖(D⁃ga⁃lactosamine,D⁃GalN)、脂多糖(lipoplysaccharide,LPS)(美国Sigma 公司);倒置显微镜(日本Olym⁃pus 公司);透射电子显微镜(美国 Thermo Fisher 公司);光学显微镜(美国 Thermo Fisher 公司);全自动生化分析仪(德国Siemens 公司);超低温冰箱(美国Thermo scientific 公司);纳米颗粒追踪分析仪(Nanoparticles Tracking Analysis,NTA)(德国Particle Metrix 公司)。
1.4 UcMSCs 的分离培养和鉴定 分离无菌脐带中的华通胶,剪成大小约0.5 mm3的组织块,在含有体积分数为10%胎牛血清(fetal bovine serum,FBS)、100 U/mL 青霉素、100 mg/L 链霉素的DMEM/F12 培养液中培养7 d,达到80%贴壁后进行传代。取第3 ~ 4 代ucMSCs 细胞悬液100 μL,倒置显微镜下观察ucMSCs 细胞形态和分布,并在显微镜下计数。取ucMSCs 细胞悬液100 μL 在流式管中并分别加入人单克隆抗体CD34⁃PE、CD45⁃FITC、CD29⁃PE、CD90⁃PE、CD44⁃PE、CD73⁃PE、CD105⁃PE进行标记,流式细胞分析鉴定ucMSCs 的免疫表型,使用FlowJo 软件分析数据。
1.5 UcMSCs⁃exo 的提取和鉴定 收集第4 代ucMSCs 细胞培养上清液,使用PBS 反复离心重悬4 遍后,弃去上清液,其底部微量液体即为ucMSCs⁃exo。在室温静置2 min 后吸除多余液体,使用3%磷钨酸溶液负染5 min,再吸干多余染液后室温沥干至电镜下观察ucMSCs⁃exo 形态。离子水、PBS 各洗涤ucMSCs⁃exo 混悬液1 遍,用NTA 鉴定外泌体的粒径分布及浓度。Western blot 检测ucMSCs⁃exo表面标志物CD63 和CD9 的表达。
1.6 动物分组及造模方法 6 ~ 8周雄性的C57BL/6 小鼠(22 ± 3 g)50 只,饲养在20℃ ~ 25℃,(50 ±5)%相对空气湿度,每天更换饮用水、垫料及饲料,12 h 暗/光循环进行适应性喂养7 d。按照实验要求将随机小鼠分为模型组、茵陈蒿汤处理组、ucMSCs⁃exo 处理组、联合处理组及正常对照组,每组10只小鼠。除正常对照组外,各组均根据体质量经腹腔注射D⁃GalN(800 mg/kg)和LPS(10 μg/kg)建立小鼠肝衰模型。在此基础上,茵陈蒿汤处理组按照120 mg/20 g 剂量的茵陈蒿汤灌胃,连续给药3 d;ucMSCs⁃exo 组经鼠尾静脉注射100 μL ucMSCs⁃exo(1 μg/μL),连续注射3 d;联合治疗组则联合茵陈蒿灌胃和尾静脉注射ucMSCs⁃exo 干预3 d;模型组和正常对照组尾静脉注射同等剂量PBS,连续注射3 d;观察处理过程中各组小鼠体重、行为表现、转氨酶改变等,由于造模剂量原因,造模期间有3 只小鼠死亡。给药结束后12 h,颈椎脱臼处死小鼠,取血及肝组织用作后续实验。
1.7 茵陈蒿汤含药血清制备 茵陈蒿汤按原方生药量36 g(茵陈18 g,大黄6 g,栀子12 g)合煎剂40 mL 为成人每日量,换算成小鼠每日灌胃剂量约为380 mg/100 g,末次给药后12 h 取小鼠血清,用于后续体外实验。
1.8 细胞分组及造模方法 将人肝细胞株LO2细胞随机分为5 组:正常对照组、模型组、茵陈蒿汤处理组、ucMSCs⁃exo 组及联合处理组。除正常对照组外,其余组的LO2细胞均在100 ng/mL LPS共孵育37 ℃、5% CO2过夜后再使用5 mmol/L ATP 刺激60 min 构建ALF 细胞模型;茵陈蒿汤处理组在造模基础上加10%茵陈蒿汤含药血清干预;ucMSCs⁃exo 处理组在造模基础上加入ucMSCs 提取的外泌体(终浓度10 μg/mL);而联合处理组则在造模基础上加入茵陈蒿汤含药血清处理的 ucMSCs 提取的外泌体(终浓度10 μg/mL)。在光学显微镜下观察各组LO2细胞的形态及数量的变化。
1.9 检测指标及方法
1.9.1 ALT 和AST 的测定 收集小鼠眶后静脉血液1 mL,按照3 000 r/min,4 ℃离心10 min 后分离血清,通过全自动生化分析仪检测ALT、AST 血清水平。
1.9.2 肝组织苏木精-伊红(hematoxylin⁃eosin,HE)染色 将小鼠肝组织剥离后于25%甲醛、10 ℃环境中固定、脱水,并包埋于石蜡中,进行切片,对切片进行常规HE 染色,在光学显微镜下观察肝组织的病理学表现。
1.9.3 流式细胞分析仪检测LO2细胞凋亡率 通过A⁃FITC/A⁃PE 细胞凋亡试剂盒检测LO2细胞凋亡率,流式细胞分析仪检测各组细胞凋亡率。
1.9.4 Western blot 采集各组LO2细胞,提取蛋白后进行转膜、封闭、洗膜。再分别加入Cleaved⁃Caspase⁃1、Caspase⁃1 的抗体,在封闭液中在4 ℃条件下孵育过夜。第2 天于室温孵育二抗1 ~ 2 h 后应用1×TBST 洗涤PVDF 膜3 ~ 5 次,每次10 min。吸取适量发光液覆盖PVDF 膜,在ECL 发光仪上进行曝光可视化。
1.9.5 酶联免疫吸附试验(enzyme⁃linked immu⁃nosorbnent assay,ELISA) 按照ELISA 试剂盒说明书步骤测定IL⁃1β、IL⁃18 的表达水平。用酶标仪在450 nm 波长下测定吸光度(OD值)。
1.10 统计学方法 使用SPSS 26.0 统计学软件进行统计学分析。GraphPad 9.5 版进行相关绘图工作。计量数据以±s表示,符合正态分布采用独立样本t检验。多组间比较使用单因素方差分析(ANOVA)。P< 0.05 表示差异有统计学意义。
2 结果
2.1 动物的一般情况 正常对照组小鼠的活动正常,饮食、饮水及排便情况正常,皮毛光泽。而造模后的小鼠在造模后3 d 出现活动减少、反应迟钝、大便干结、饮食较少、体质量下降。经过不同药物组干预后,小鼠上述症状有所好转,其中联合治疗组小鼠症状改善最显著。
2.2 UcMSCs 及其外泌体的鉴定 倒置显微镜观察ucMSCs 的形态稳定均一,并可见到呈典型的长梭形及漩涡状排列(图1)。流式细胞仪检测P3代的ucMSCs 表面标记物CD29(99.9%)、CD90(100%)、CD44(100%)、CD73(100%)和CD105(99.5%)的表达量均在98%以上,而造血干细胞的表面标记CD34(1.89%)、CD45(7.14%)表达极低(图2)。通过透射电子显微镜观察提取的外泌体可见呈杯状或类圆形、双层膜的囊泡样结构(图3)。纳米颗粒跟踪分析鉴定其直径在50 ~ 100 nm,峰值在107 nm,总占比在99%,粒子数为4.6E+6/mL(图4A⁃B),并可见量测过程中的囊泡结构显现(图4C)。Weastern blot 鉴定外泌体表面标志物CD63、CD9 表达明显高于上清液(图4D,P< 0.05)。经上述鉴定所提取的为高纯度的ucMSCs 和外泌体,用于后续实验。
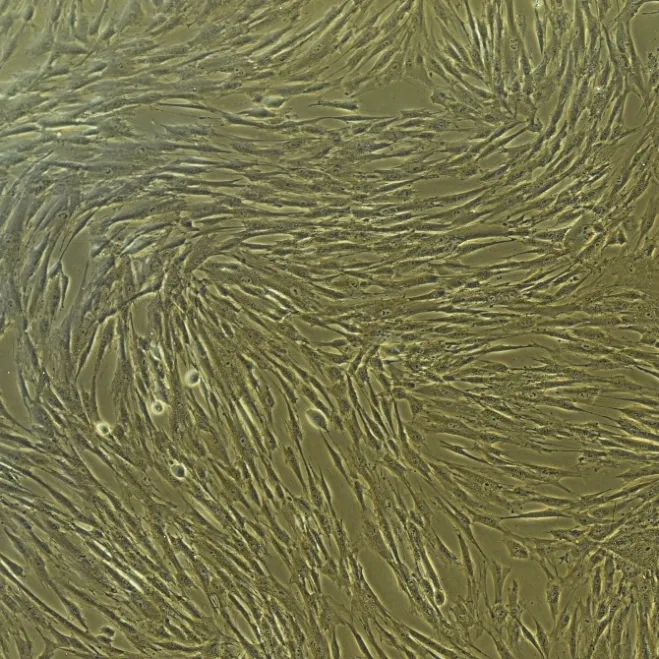
图1 无血清培养基培养的ucMSCs 形态学显微镜观(× 200)Fig.1 Morphological microscopic view of ucMSCs cultured in serum-free medium (× 200)
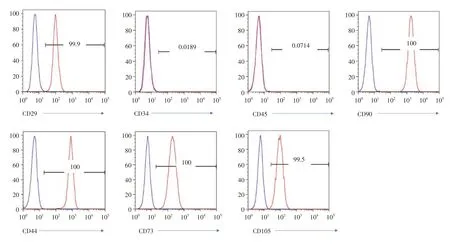
图2 UcMSCs 表面标记物表达情况Fig.2 UcMSCs surface marker expression
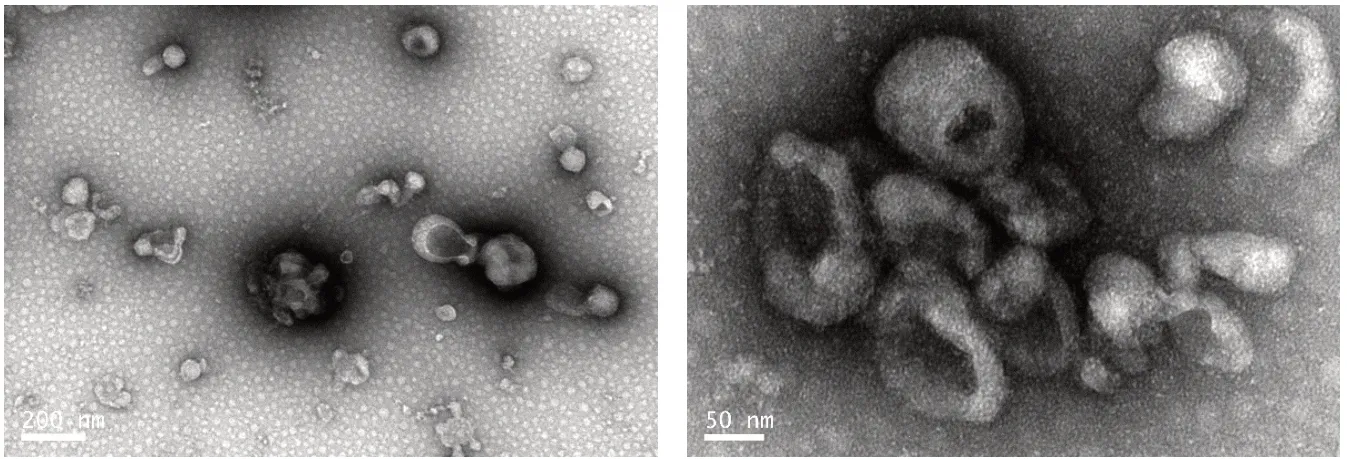
图3 透射电子显微镜下外泌体成像(左200 nm;右50 nm)Fig.3 Transmission electron microscopy imaging of exosomes (Left 200 nm; Right 50 nm)

图4 外泌体的鉴定Fig.4 Identification of exosomes
2.3 茵陈蒿汤联合ucMSCs⁃exo 对体外ALF 模型的影响 在光镜下观察不同处理组LO2细胞表现。正常对照组中肝细胞形态大小均一,呈多边形,分布均匀,分界清楚,胞内未见明显空泡样改变(图5A)。而模型组的LO2细胞体积变小,形态不规则,胞浆内有大小不等的圆形空泡,有气泡状突出物,细胞间分界不清晰(图5B)。而茵陈蒿汤治疗组及联合ucMSCs⁃exo 治疗组中仅有少量肝细胞损伤、坏死、空泡,其中联合组损伤最轻(图5C⁃D)。通过流式检测各组中肝细胞死亡率,其中模型组(7.99%)(图6B)和茵陈蒿汤治疗组(8.33%)(图6C)的肝细胞死亡率最高,而联合治疗组(4.33%)(图6D)死亡率显著下降(P< 0.05),并与正常对照组(4.08%)(图6A)相似。

图5 光学显微镜观察肝细胞形态(× 200)Fig.5 Hepatocyte morphology observed by light microscope (× 200)
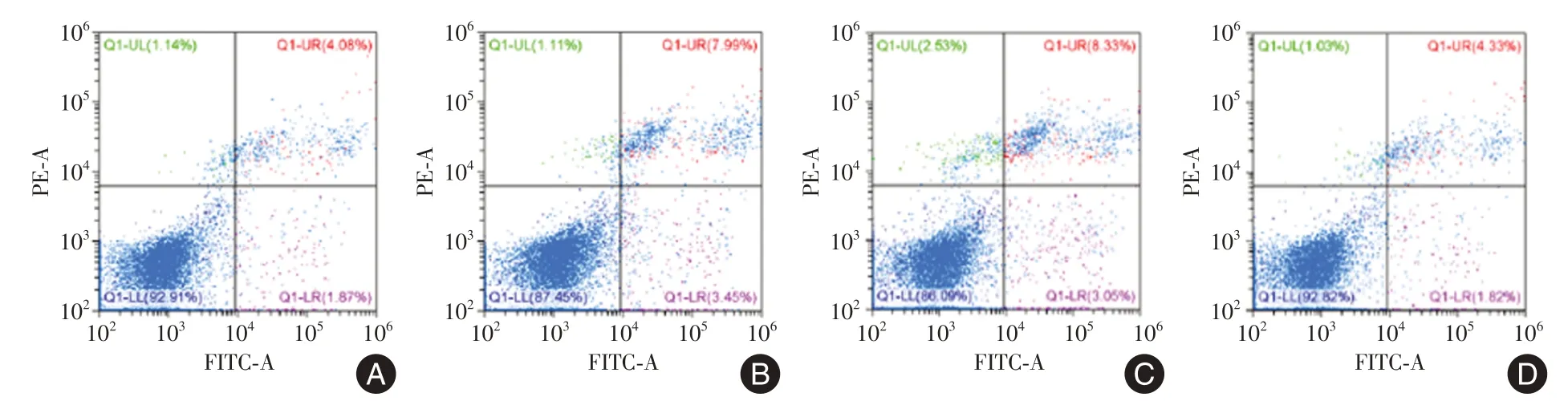
图6 流式检测肝细胞死亡率Fig.6 Flow assay for hepatocyte mortality rate
2.4 茵陈蒿汤联合ucMSCs⁃exo 对肝细胞焦亡的作用 通过Western blot 检测各组中焦亡相关蛋白Caspase⁃1 和Cleaved⁃Caspase⁃1 的表达水平。结果显示,与模型组(Model)相比,ucMSCs⁃exo 治疗组(ucMSCs)、茵陈蒿汤治疗组(Medicine)及联合治疗组(Combination)的Caspase⁃1 水平相较无明显差异(P> 0.05),而各组的Cleaved⁃Caspase⁃1 表达明显下降(P< 0.05)(图7A),其中联合治疗组下降的最显著。ELISA 检测各组IL⁃1β、IL⁃18 的表达情况。对比模型组,ucMSCs⁃exo 治疗组、茵陈蒿汤治疗组、联合治疗组的IL⁃1β、IL⁃18 表达水平均有相应的下降(P< 0.05),其中联合治疗组下降的最显著,抗肝细胞焦亡效果最佳(P< 0.05)(图7B)。

图7 各治疗组对肝细胞焦亡的影响Fig.7 Effect of each treatment group on hepatocyte pyroptosis
2.5 茵陈蒿汤联合ucMSCs⁃exo 对ALF 小鼠血清中ALT、AST 的影响 与模型组相比,ucMSCs⁃exo组、茵陈蒿汤组、联合组的ALT、AST 均显著下降(P< 0.05),其中联合组的ALT 及AST 水平下降的最多(P< 0.05)。但相较于正常对照组而言,各组的ALT、AST 均增高(P< 0.05)(图8)。

图8 肝衰造模后12 h 各处理组小鼠血清ALT、AST 表达情况Fig.8 Serum ALT and AST expression in mice in each treatment group 12 h after liver failure modeling
2.6 茵陈蒿汤联合ucMSCs⁃exo 对ALF 小鼠肝脏病理学的影响 通过HE 染色可见正常对照组小鼠肝小叶界限分明,肝细胞呈条索样排列,未见炎症细胞的浸润及坏死组织、胶原纤维的沉积(图9E)。而模型组的肝组织结构紊乱、破裂、缺失,肝窦、肝索分界不清,肝细胞大片变性坏死,可见深紫色炎症细胞的浸润及坏死的细胞碎片,符合ALF 小鼠模型的病理特点(图9A)。与模型组对比,茵陈蒿汤治疗组及ucMSCs 治疗组可见肝索样肝细胞排列,部分汇管区有深紫色炎症细胞的浸润,整体肝脏破坏程度轻于模型组(图9B⁃C)。而联合治疗组的肝索排列相对整齐,肝细胞坏死程度明显减少,存在散在少量坏死细胞,未见明显炎症细胞浸润(图9D)。
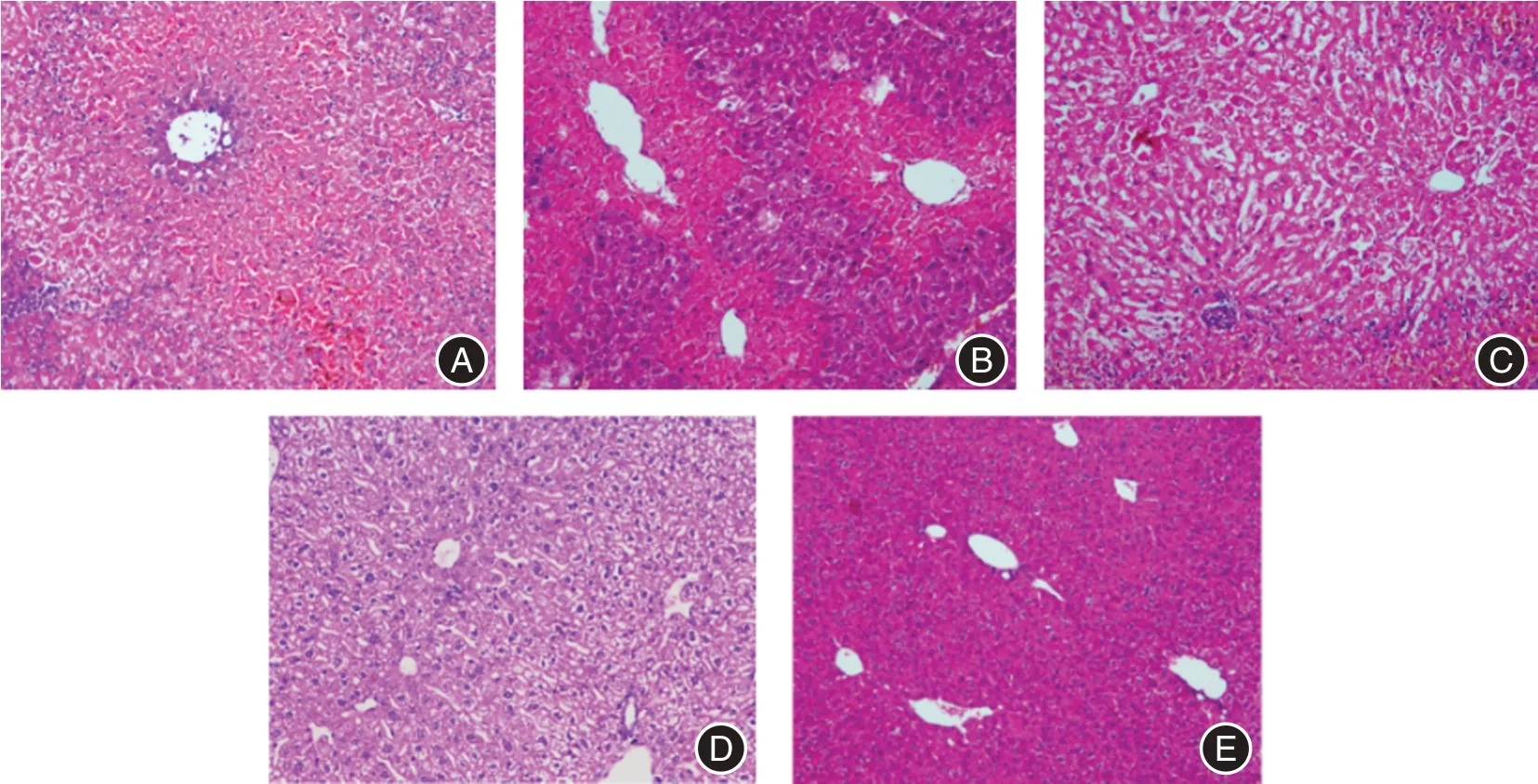
图9 不同处理组小鼠肝脏病理变化(× 200)Fig.9 Pathological changes of liver in different treatment groups(× 200)
3 讨论
茵陈蒿汤作为治疗湿热黄疸之主方[15],在现代医学研究中已被证实对ALF 具有一定的治疗效果[15-16]。现代药理学研究分析显示,茵陈蒿汤中的大黄其主要有效成分为蒽醌衍生物,能通过增强淋巴细胞的免疫功能及胆汁的排放,从而降低血清ALT、AST,起到治疗ALF 的作用[17]。另外茵陈的有效成分6,7⁃二甲氧基香豆素能够抑制血清中IL⁃6 和Toll 样受体4(Toll⁃like receptor 4,TLR4)的表达,抑制肝脏炎症,起到保肝作用[18]。因此茵陈蒿汤在拆分的药理学基础及整体应用均表现出抑制肝细胞凋亡、抗肝脏炎症、调整免疫状态的作用,从而发挥保肝作用,以达到治疗ALF 的效果。然而,根据ALF 的整个发病过程中所对应到的中医证候而言,其分布复杂,并且病情演变迅速,故单纯的中医治疗应用于ALF 的治疗仍存在一定的局限性。并且由于中药的成分特殊,作用机制复杂,在一定程度上也限制了中药的应用。而结合现代医学研究,应用干细胞及其囊泡作为中草药物载体不仅为中药应用提供了新的方向,也能为中药具体作用机制研究提供了新的思路。
此外,研究发现中药可以干预外泌体内生物活性物质的表达而改变其含量,在疾病发生发展或治疗中发挥作用。中药与外泌体间的调控作用主要分为4 种:中药改变外泌体释放的数量;中药改变外泌体内容物含量;中药介导外泌体结构改变;外泌体作为中药的载体[19]。因此作为中华民族优秀传统文化的瑰宝之一的中药,也跟随现代医学研究的发展和进步,被应用到干细胞外泌体治疗疾病的领域中[19]。因此应用中药作用于干细胞及其外泌体所发挥的协同作用在临床疾病治疗方面具有一定的可行性。
研究发现ucMSCs⁃exo 通过释放胰岛素样生长因子结合蛋白6(angiogenin,insulin⁃like growth factor⁃binding protein 6,IGFBP⁃6)至ALF 小鼠肝组织中,有效的提高了小鼠的生存率,并抑制肝细胞凋亡[20]。但是由于干细胞的多向分化性,单纯的干细胞及其外泌体容易受到复杂的宿主微环境的影响,塑造出不同的干细胞及其功能,导致治疗过程中不可控的风险大大增加[21⁃23]。而中药所作用的外泌体不仅能够改变外泌体内容物的含量及结构,还能作为中药的药物载体改变中药溶解度低、生物利用度低、作用过程长、毒副作用较明显等缺点,实现精准转运、靶向作用,能克服ucMSCs⁃exo 的不可控性风险,从一定程度上发挥协同治疗作用。
在本研究中,ALF 体外模型内可见茵陈蒿汤联合ucMSCs⁃exo 治疗组抑制肝细胞死亡的作用明显优于单一治疗组,且通过检测肝细胞焦亡相关蛋白Cleaved⁃Caspase⁃1 及焦亡相关细胞因子IL⁃1β、IL⁃18 的表达也显现出茵陈蒿汤及ucMSCs⁃exo 对肝细胞焦亡的抑制作用,其中联合治疗所发挥的协同效应所对应的治疗效果、抗肝细胞焦亡作用最显著。并且ALF 体内小鼠模型验证两者的协同作用。本研究应用的LPS/D⁃GalN 构建的ALF 小鼠模型被认为是造成温病热毒血瘀证的动物模型[24],且LPS/D⁃GalN 诱导的肝损小鼠模型也是公认的ALF 小鼠模型[25]。本研究从肝脏病理、血清学AST 及ALT 两方面对比均反映联合治疗组的抗肝损作用显著优于单一茵陈蒿汤或单一ucMSCs⁃exo 治疗组。
综上所述,本研究发现茵陈蒿汤联合ucMSCs⁃exo 能够抑制肝细胞焦亡,改善肝脏损伤,为茵陈蒿汤联合ucMSCs⁃exo 治疗ALF 提供理论和实验依据。
【Author contributions】XIE Dan performed the experiments and wrote the article.OUYANG Shi and XIE Dan revised the article.OUY⁃ANG Shi designed the study.OUYANG Shi reviewed the article.All authors read and approved the final manuscript as submitted.

