百香果酒发酵动力学及抗氧化活性研究
郝丽粉,叶晓芳,张静进,林 奇,包媛媛*
(云南农业大学 食品科学技术学院,云南 昆明 650201)
百香果(Passiflora edulis)又名西番莲、鸡蛋果,是西番莲科西番莲属的一种草质藤本植物,主要有紫果和黄果两大类[1]。目前,紫皮百香果(Passiflora edulisSims)是种植和销售最多的品种之一,其含有丰富的可溶性糖、有机酸、维生素等活性物质[2],果皮中富含果胶、粗纤维、多糖、黄酮和多酚类物质[3-4]。具有消炎[5]、镇静[6]、抗焦虑[7]、治疗失眠[8]等功效。果酒的酒精发酵是指果汁中的糖在酵母菌的一系列酶的作用下,通过复杂的化学变化,最终产生乙醇和二氧化碳的过程[9]。经发酵得到的百香果酒营养丰富,风味独特,酒精度低[10]。目前,国内关于百香果发酵酒的研究报道较多,杨玉霞等[11]以百香果全果为原料,经过响应面优化法确定百香果全果酒最适发酵条件,LIU R J等[12]采用气相色谱、电子鼻和感官评价相结合的方法对百香果酒的挥发性成分和香气特征进行研究。
发酵动力学是研究各种环境因素与微生物代谢活动之间相互作用随时间变化的规律。通过发酵动力学的研究,可以预先估计发酵液不同时间内物质含量,对出现的异常情况进行判断[13],对果酒工业化生产及控制具有现实意义。百香果酒发酵过程中,酒精的生成与酵母菌生长和底物糖消耗相对应。李雪等[14]研究仙人掌果酒发酵动力学及抗氧化性,结果表明,仙人掌果及其发酵果酒的抗氧化能力都比较高,说明仙人掌果发酵后仍能保持原有的抗氧化性能。张琪等[15]采用四种模型对沙棘果酒发酵过程中实验数据进行非线性拟合,建立发酵动力学模型,有利于工业化生产。目前,关于百香果果汁和百香果全果汁的发酵动力学及发酵过程中抗氧化活性变化规律的研究鲜有报道。
本研究采用Logistic模型、Boltzmann模型、SGompertz模型和DoseResp模型对总糖消耗、酒精生成和酵母菌数的变化进行非线性拟合,建立发酵动力学模型,对百香果酒发酵过程中总酚含量和总黄酮含量进行测定,并采用1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)法和Fe3+还原能力测定发酵过程中百香果果汁酒和百香果全果酒的抗氧化能力,分析生物活性成分与抗氧化能力的动态变化规律。以期为百香果酒的控制发酵提供理论基础,带动高原特色农业经济发展具有重要意义。
1 材料与方法
1.1 材料与试剂
紫皮百香果(可溶性固形物13.6%,总酸35.38 g/L,总糖55.76 g/L):采样于云南西双版纳;果酒专用酵母RW:安琪酵母股份有限公司;果胶酶(酶活3万U/g):山东隆科特酶制剂有限公司;焦亚硫酸钾(分析纯):浙江一诺生物科技有限公司;食用纯碱:南京甘汁园糖业有限公司;氢氧化钠、苯酚、亚硝酸钠、三氯乙酸(均为分析纯):天津市风船化学试剂科技有限公司。
1.2 仪器与设备
LB32T手持折光仪:广州市速为电子科技有限公司;A360紫外可见分光光度计:上海翱艺仪器有限公司;HH-8数显恒温水浴锅:常州国华电器有限公司;WPL-65BE恒温培养箱:天津市泰斯特仪器有限公司;SF-TDL-4A分析天平:上海菲恰尔有限公司;25×16血球板计数器:上海市求精生化试剂仪器有限公司。
1.3 方法
1.3.1 百香果酒加工工艺流程及操作要点
百香果→预处理→破壳取肉→酶解→过滤→混料→成分调整→酵母活化→主发酵→陈酿→百香果成品
预处理:挑选无病虫害、无霉变、颜色均匀的新鲜成熟百香果,流动清水漂洗2次,备用。
破壳取肉:切开百香果后取出果肉。
酶解:百香果果肉中添加0.22%果胶酶,50 ℃水浴3.5 h。
过滤:双层纱布过滤得百香果汁。
混料:考虑成本因素及原果汁太浓稠,按料液比1.0∶1.5(g∶g)混料。以果汁及无菌水的比例为1.0∶1.5(g∶g)加水获得果汁酒原料;以果皮与水料液比为1∶4(g∶g)加水打浆即为果皮浆,以果汁及果皮浆比例为1.0∶1.5(g∶g)加果皮浆获得全果酒原料。
成分调整:调整pH至3.5,果汁酒原料加入蔗糖至糖度为21.5%,全果酒原料加入蔗糖至糖度为20.6%,以利于发酵,添加4 mg/100 g焦亚硫酸钾,防止杂菌污染。
酵母活化:取适量果酒酵母,按料液比1∶9(g∶mL)加入无菌水,37 ℃水浴活化25 min。
主发酵:百香果果汁酒的酵母接种量为0.04%、初始糖度为21.5%、发酵温度为28.7 ℃、发酵时间为6 d;百香果全果酒的酵母接种量为0.03%、初始糖度为20.6%、发酵温度为25.5 ℃、发酵时间为5 d。
陈酿:陈酿即后发酵,采用虹吸法将酒液吸到另一干净容器内,除去发酵醪中的酒糟,同时吸到新容器后要尽量加满,以减少氧气对酒液的氧化作用,15 ℃低温后发酵2个月,即得百香果酒成品。
1.3.2 分析检测
总糖含量:采用苯酚-硫酸法测定[16];总酚含量:采用福林-肖卡(Folin-Ciocalteau)比色法测定[13];酒精度:按照GB 5009.225—2016《酒中乙醇浓度酒精计法》测定;总黄酮含量:采用NaNO2-AlCl3-NaOH分光光度法测定[17];酵母菌数量:采用血球计数板测定[18]。
1.3.3 抗氧化性能测定
DPPH自由基清除率:参考PENKOV D等[19]的方法测定。取0.2mL样液,加入7.8mLDPPH无水乙醇溶液(8μg/mL),混匀避光反应30 min,在波长517 nm处测定吸光度值。其计算公式如下:
式中:A1为样液与DPPH无水乙醇溶液的吸光度值;A2为样液与无水乙醇的吸光度值;A0为蒸馏水与DPPH无水乙醇溶液的吸光度值。
Fe3+还原能力:参考DIANTINI A等[20]的方法测定。取1 mL样液,加入0.2 mL磷酸盐缓冲溶液(0.2 mol/L、pH6.6)和0.5 mL1%铁氰化钾溶液,混匀,50 ℃条件下水浴20 min,取出后快速冷却,再加入1 mL10%三氯乙酸溶液,终止反应后取上清液1.5 mL,加入0.2 mL1%三氯化铁溶液和3 mL蒸馏水,混匀静置5 min,于波长700 nm处测定吸光度值。吸光度值越大说明还原能力越强。
1.3.4 数据处理与统计分析
所有试验重复3次,结果以“平均值±标准差”表示。应用Origin 9.0软件对基质消耗、产物生成、菌体生长情况建立动力学模型。选取合适的模型,进行非线性拟合,相关系数R2越大,拟合度越高,选取拟合度最高的模型对其进行定量描述。应用SPSS 22.0软件进行数据处理。
2 结果与分析
2.1 百香果果汁酒发酵过程中总糖含量、酒精度、酵母菌数量变化趋势
百香果果汁酒发酵过程中总糖含量、酒精度、酵母菌数量变化规律见图1。由图1可知,在酵母菌的生长过程中,0~60 h为对数生长期,伴随营养的储存和初级代谢产物的产生,微生物的生长速率与底物利用率成正比,生长曲线可以清晰的描绘出来[21]。60~84 h,酵母菌的生长速率减缓,其原因可能是,底物糖的消耗和产物酒精的积累;发酵时间为84 h时,酵母菌数达到最高值(3.35×108CFU/mL);发酵时间>84 h,酵母菌数量逐渐减少,酵母开始加入衰亡期。当发酵时间为0~96 h,总糖含量降低;当发酵时间>96 h时,总糖含量变化趋势趋于平稳,糖基本被消耗。当发酵时间在0~60 h范围内的延长,酒精度呈快速上升的趋势;当发酵时间>60 h,酒精度增加趋势趋于平稳,发酵时间为144 h时,酒精度达最大值,为10.2%vol。结果表明,在百香果果汁酒发酵过程中酒精的生成与酵母菌生长和底物糖消耗是相对应的。

图1 百香果果汁酒发酵过程中总糖含量、酒精度、酵母菌数量变化Fig.1 Change of total sugar content, alcohol content and yeast count during passion fruit juice wine fermentation
2.2 百香果果汁酒发酵动力学模型的建立
2.2.1 百香果果汁酒底物消耗动力学模型
总糖消耗拟合方程及其相关系数见表1。Boltzmann模型及DoseResp模型下总糖消耗拟合曲线见图2。

表1 总糖消耗拟合方程及其相关系数Table 1 Fitting equation of total sugar consumption and its correlation coefficient
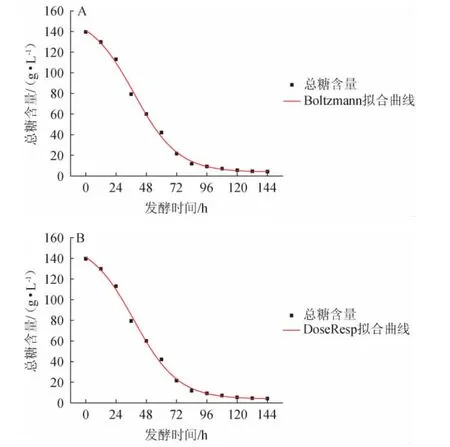
图2 Boltzmann模型(A)及DoseResp模型(B)下总糖消耗拟合曲线Fig.2 Fitting curve of total sugar consumption under Boltzmann model (A) and DoseResp model (B)
由表1可知,3个模型相关系数R2均>0.99,Boltzmann和DoseResp模型相关系数一致,均高于Logistic模型,说明这2种模型均能较好地反映百香果果汁酒发酵过程总糖含量的变化。由图2可知,发酵时间为0~96 h时,总糖消耗较快,表明百香果果汁酒主发酵即将结束;发酵时间>96 h,总糖消耗趋于稳定。Boltzmann和DoseResp模型下的总糖含量实测值和预测值基本吻合,说明该模型能较好地描述百香果果汁酒发酵过程中总糖的消耗过程。结论与李雪等[14]关于仙人掌果酒底物消耗趋势一致。
2.2.2 百香果果汁酒产物生成动力学模型
酒精生成拟合方程及其相关系数见表2。由表2可知,DoseResp模型拟合相关系数R2较高(0.998 41),可以较好地描述百香果果汁酒发酵过程中酒精生成的变化过程。DoseResp模型下酒精生成拟合曲线见图3。由图3可知,发酵时间为0~96 h,酵母菌快速生长繁殖,酒精生成速率加快;当发酵时间>96 h,酵母菌进入衰亡期,活力逐渐减弱[22],酒精度变化趋于稳定,发酵时间为144 h时,酒精度为10.2%vol。

表2 酒精生成拟合方程及其相关系数Table 2 Fitting equation of alcohol generation and its correlation coefficient

图3 DoseResp模型下酒精生成拟合曲线Fig.3 Fitting curve of alcohol generation under DoseResp model
2.2.3 百香果果汁酒菌体生长动力学模型
由图1可知,酵母菌在84 h后开始进入衰亡期,因此对0~84 h范围内的酵母菌生长情况进行非线性曲线拟合,酵母菌数量拟合方程及其相关系数见表3。由表3可知,对比3个模型的拟合度,DoseResp模型拟合相关系数最高,相关系数R2为0.997 96。因此,选择DoseResp模型来拟合百香果果汁酒发酵过程中的酵母菌数量变化过程。DoseResp模型下酵母菌生长拟合曲线见图4。由图4可知,发酵时间为0~84 h,酵母菌数逐渐增加,发酵时间为84 h时,酵母菌数达到最高值,为3.35×108CFU/mL。

表3 酵母菌数量拟合方程及其相关系数Table 3 Fitting equation of yeast number and its correlation coefficient

图4 DoseResp模型下酵母菌生长拟合曲线Fig.4 Fitting curve of yeast growth under DoseResp model
2.3 百香果全果酒发酵过程中总糖含量、酒精度、酵母菌数量变化趋势
百香果全果酒发酵过程中总糖含量、酒精度、酵母菌数量变化规律见图5。由图5可知,发酵时间为0~24 h,酵母菌数量从0.84×108CFU/mL增长至1.17×108CFU/mL;发酵时间为24~72 h,酵母菌快速增长,总糖含量快速下降;发酵时间为72 h时,酵母数量达到最高值3.29×108CFU/mL;当发酵时间>72 h,酵母菌数量逐渐减少。发酵时间为0~72 h,总糖含量快速下降,酒精度快速上升;当发酵时间>72 h,总糖含量及酒精度变化趋于平稳。酒精是酵母菌厌氧发酵消耗糖类代谢而生成的产物,随着发酵时间的延长酒精度呈现上升的趋势。结果表明,在百香果全果酒发酵过程中,酒精的生成与酵母菌生长和总糖消耗是相对应的。
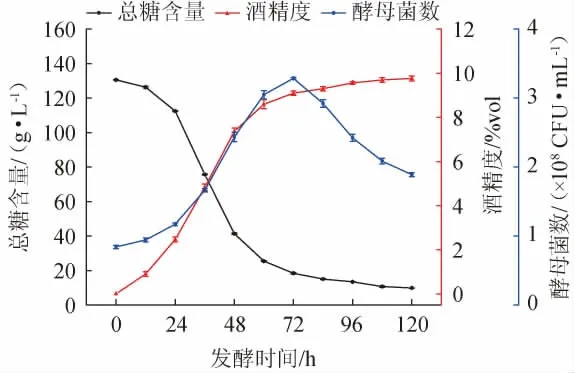
图5 百香果全果酒发酵过程中总糖含量、酒精度、酵母菌数量变化Fig.5 Change of total sugar content, alcohol content and yeast count during passion fruit whole fruit wine fermentation
2.4 百香果全果酒发酵动力学模型的建立
2.4.1 百香果全果酒底物消耗动力学模型
总糖消耗拟合方程及其相关系数见表4。由表4可知,Logistic模型拟合相关系数最高,R2为0.999 41,故选用Logistic模型拟合总糖消耗曲线结果见图6。由图6可知,在百香果全果酒发酵过程中,总糖含量测定值和模型预测值基本吻合。发酵时间为0~84 h,总糖含量快速下降;当发酵时间>84 h,总糖含量变化趋于平稳,与酵母菌生长和酒精生成相互对应。

表4 总糖消耗拟合方程及其相关系数Table 4 Fitting equation of total sugar consumption and its correlation coefficient

图6 Logistic模型下总糖消耗拟合曲线Fig.6 Fitting curve of total sugar consumption under Logistic model
2.4.2 百香果全果酒产物生成动力学模型
酒精生成拟合方程及其相关系数见表5。由表5可知,DoseResp模型能较好地描述百香果全果酒发酵过程中酒精生成的动态变化,其相关系数为0.998 82。DoseResp模型下酒精生成拟合曲线见图7。由图7可知,发酵时间为0~72 h,酒精度逐渐增加;当发酵时间>72 h,酒精度变化趋于平稳;发酵时间为120 h,酒精度达最高值,为9.8%vol。百香果全果酒发酵过程中酒精生成动力学模型的预测值和实测值的相对误差较小,表明该模型能较好地反映随发酵时间酒精度的变化情况。

表5 酒精生成拟合方程及其相关系数Table 5 Fitting equation of alcohol generation and its correlation coefficient
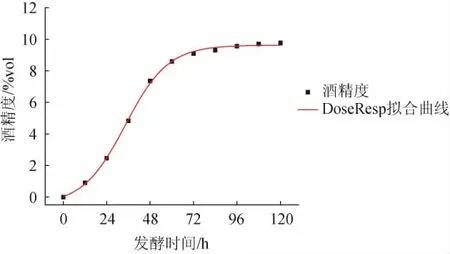
图7 DoseResp模型下酒精生成拟合曲线Fig.7 Fitting curve of alcohol generation under DoseResp model
2.4.3 百香果全果酒菌体生长动力学模型
由图5可知,酵母菌在24~60 h呈对数生长期,故对0~72 h时期的酵母菌体生长情况进行非线性拟合。酵母菌数量拟合方程及其相关系数见表6。由表6可知,DoseResp模型拟合相关系数最高,R2为0.999 54,故选用DoseResp模型对百香果全果酒发酵过程酵母生长情况进行描述。DoseResp模型下酵母菌生长拟合曲线见图8。由图8可知,酵母菌在0~24 h增长缓慢;当发酵时间为24~60 h,酵母菌快速增长;当发酵时间>72 h,酵母菌数变化趋于平缓。

表6 酵母菌数量拟合方程及其相关系数Table 6 Fitting equation of yeast number and its correlation coefficient

图8 DoseResp模型下酵母菌生长拟合曲线Fig.8 Fitting curve of yeast growth under DoseResp model
2.5 百香果果汁酒及全果酒发酵动力学对比分析
百香果果汁酒和全果酒酒精度分别为10.2%vol、9.8%vol。未发酵时,果汁酒、全果酒中酵母菌数量分别为0.62×108CFU/mL、0.84×108CFU/mL,说明百香果果皮中含有少量的天然酵母。发酵时间为0~24 h,果汁酒总糖消耗量比全果酒多,因为果汁酒体系中酵母快速生长,而全果酒体系中酵母菌数量增长缓慢,这是由于紫皮百香果果皮中含有丰富的木犀草素、芹菜素、白杨素、槲皮素等为苷元的黄酮碳苷和氧苷类物质,其中牧荆素、木犀草素和槲皮素等苷元类黄酮具有消化酶抑制能力,在一定程度上抑制了酵母的活性[23]。发酵时间>24 h,果汁酒、全果酒体系中酵母菌数分别在84 h、72 h时达到最高值,酵母菌数量多则消耗更多的糖分[24]。在一定程度上加快发酵速率,但果汁酒体系中总糖含量较高,因此全果酒发酵周期较果汁酒短,果汁酒酒精度较全果酒略高。
2.6 百香果酒发酵过程中抗氧化活性物质与抗氧化能力的变化
百香果酒发酵过程中抗氧化活性物质与抗氧化能力的变化见表7。

表7 百香果酒发酵过程中抗氧化活性物质与抗氧化能力的变化Table 7 Changes of antioxidant active substances and antioxidant ability during passion fruit wine fermentation
由表7可知,随着发酵的进行,果汁酒和全果酒中总酚和总黄酮含量、DPPH自由基清除率和Fe3+还原能力均呈现先上升后下降的趋势,呈峰型变化。果汁酒中总酚和总黄酮含量均在24 h时达到最高值,分别为9.31 μg/mL、7.38 μg/mL,DPPH自由基清除率和Fe3+还原能力在48 h时达到最高值。由于发酵前期产生的酒精有利于酚类物质和花色苷的溶出[25],黄酮化合物易溶于乙醇,而DPPH自由基清除能力的变化主要与多酚类物质含量的变化有关[26]。发酵时间延长,总酚及总黄酮含量、DPPH自由基清除率和Fe3+还原能力开始下降,下降的原因可能是体系中糖减少,酵母的代谢产物与酚类、黄酮类物质发生反应,生成衍生物,造成抗氧化活性物质减少[14],影响DPPH自由基清除率和Fe2+还原能力。
全果酒中总酚和总黄酮含量均在24 h时达到最高值,分别为18.89 μg/mL、10.97 μg/mL,DPPH自由基清除率和Fe3+还原能力在48 h时达到最高值。0~24 h时,酚类和黄酮化合物受酒精增加及微生物发酵的作用下含量不断增加[27]。发酵时间>24 h,可能是黄酮化合物不稳定,发生自身分解及氧化导致黄酮含量下降[28],从而影响抗氧化能力。
未发酵和发酵结束后的果汁酒、全果酒中总酚和总黄酮含量、Fe3+还原能力差异显著(P<0.05),DPPH自由基清除率不显著(P>0.05),可能由于在发酵过程中酵母菌大量生长繁殖、物质代谢转化造成了抗氧化成分的损失,导致抗氧化活性物质含量下降[29]。全果酒的总酚和总黄酮含量、DPPH自由基清除率和Fe3+还原能力均高于果汁酒,由于紫百香果皮中含有大量多糖、黄酮及酚类等营养物质[30],全果酒抗氧化能力高于果汁酒。
3 结论
采用Boltzmann模型、DoseResp模型、Logistic模型能较好地对果汁酒和全果酒发酵过程中总糖消耗、酒精生成和酵母菌生长数据进行非线性拟合,拟合系数R2均>0.99,表明所选拟合模型能较好地模拟发酵过程及描述其发酵动力学特征。随着发酵的进行,果汁酒和全果酒中总酚和总黄酮含量、DPPH自由基清除能力和Fe3+还原能力均呈现先上升后下降的趋势,发酵过程中抗氧化性呈峰型变化。经过发酵后得到的果汁酒和全果酒保留了较高的抗氧化性能,全果酒抗氧化性能优于果汁酒。通过对百香果酒发酵动力学及抗氧化活性的研究,探索最佳工艺技术及参数条件,为百香果酒的规模化生产提供一定的技术基础。

