窖泥中酯化菌的筛选鉴定及协同发酵条件优化
龚虎程,王 宇,罗 静,张家旭,田树林,边名鸿,高 健,韩保林*
(1.四川轻化工大学 生物工程学院,四川 宜宾 644005;2.成都蜀之源酒业有限公司,四川 成都 611335)
中国白酒是世界六大蒸馏酒之一,不仅在国内闻名,同时在国外也享有一定的地位[1-2]。其中浓香型白酒具有绵甜甘冽、香味协调、尾净香长等风味特点,年产量占据我国白酒市场的70%以上,在国内白酒行业处于领先地位,深受人们的喜爱[3]。泥窖发酵是浓香型白酒最典型的特征,是区别于其他香型白酒的关键所在,窖泥的质量也成为决定其品质的关键因素之一[4-5]。窖泥由特殊土质、麸曲粉、黄水、己酸菌液、酒尾等构成,含有丰富的细菌、古菌和真菌微生物资源,是浓香型白酒生产酿造的基础[6-8]。窖泥内部的酯化菌能够代谢产生酯化酶,从而将乙醇与小分子有机酸如己酸、乙酸、乳酸、丁酸等酯化缩合生成相应的乙酯类化合物,增加浓香型白酒主体香成分,发挥生香的作用[9-10]。
微生物会根据自身的生长特性来选择适宜的条件进行生长、代谢、繁殖,在窖泥的特殊环境下,大多数霉菌会被逐渐淘汰,而细菌则会逐渐成为窖泥微生态环境中的主体部分[11]。并且窖内复杂的微生态环境表明,一系列的生香反应不是单个菌株作用的结果,而是多种微生物协同作用完成的。当前已有一些学者对窖泥中酯化菌和协同发酵进行了研究,并且表明细菌是窖泥中主要的酯化菌[12-13]。赵志军等[14]优化酯化菌的产酶条件,最终获得最优的工艺,并且酯化酶活力明显提升。卫春会等[15]研究发现,传代富集能够增加酯类物质的含量和数量,并且利于厌氧酯化菌的筛选。黄治国等[16]研究发现,将3株酯化菌复配发酵能显著提升己酸乙酯和丁酸乙酯的含量。郭燕等[17]探究酵母菌和酯化菌的混菌协同发酵,最终获得最优的工艺条件,并且己酸乙酯和丁酸乙酯的含量明显提升。
本研究以40年窖泥为研究对象,分离筛选酯化酶活力较高的细菌,利用形态学观察和分子生物学技术对筛选菌株进行鉴定。将筛选菌株与异常威克汉姆酵母(Wickerhamomyces anomalus)JM-4协同发酵,以酯化酶活力为评价指标,通过单因素试验及正交试验优化协同发酵条件,并采用顶空固相微萃取结合气质联用(headspace solid phase microextraction gas chromatography mass spectrometry,HSSPME-GC-MS)技术分析发酵产物挥发性化合物。以期为改良衰退窖泥、养护窖池和人工窖泥的培养提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料和菌株
窖泥:无菌操作采集于宜宾、邛崃两个知名酒企40年窖池上层(距窖口50 cm)、中层(窖池中部)、下层(距窖底50 cm)窖泥,无菌袋中立即混匀于干冰中贮存运回实验室-20 ℃保存待用。
异常威克汉姆酵母(Wickerhamomyces anomalus)JM-4:筛选自邛崃某知名酒企大曲,本实验室-20 ℃保藏。
1.1.2 试剂
牛肉膏、蛋白胨(均为生化试剂):天津市致远化学试剂有限责任公司;葡萄糖、氯化钠、硫酸铵、七水硫酸镁、七水硫酸亚铁、磷酸氢二钾、磷酸二氢钾、氢氧化钠、无水乙醇、聚乙烯醇1788、革兰氏染液、三丁酸甘油酯(均为分析纯)、酵母粉、琼脂粉(均为生化试剂):成都市科隆化学品有限公司。
1.1.3 培养基
水琼脂培养基:水琼脂20 g/L。121 ℃高压蒸汽灭菌20 min。
液体培养基:牛肉膏5 g/L,蛋白胨10 g/L,氯化钠5 g/L。121 ℃高压蒸汽灭菌20 min。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)固体培养基:酵母粉10 g/L,蛋白胨20 g/L,葡萄糖20 g/L,琼脂20 g/L。121 ℃高压蒸汽灭菌20 min。
YPD液体培养基:YPD固体培养基不添加琼脂。
筛选培养基:牛肉膏5 g/L,蛋白胨10 g/L,氯化钠5 g/L,琼脂粉20 g/L,加入三丁酸甘油酯1%。121 ℃高压蒸汽灭菌20 min。
发酵培养基:牛肉膏20 g/L,葡萄糖20 g/L,磷酸氢二钾1 g/L,硫酸铵1 g/L,七水硫酸镁1 g/L,氯化钠0.5 g/L,七水硫酸亚铁0.01 g/L,调pH至7.0。121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
SPX-250BE生化培养箱:上海力辰邦西仪器科技有限公司;CP124C电子天平:美国OHAUS公司;Stab MiniL摇床:上海润度生物科技有限公司;MX-S混匀仪:北京大龙兴创实验仪器有限公司;SW-CJ-2FD超净工作台:苏州苏洁净化设备有限公司;DHG-9140A烘箱:上海一恒科学仪器有限公司;TG16.5高速离心机:上海卢湘仪离心机仪器有限公司;TOUCH BGLN光学显微镜:宁波天宇光电科技有限公司;DGL-50B灭菌锅:江苏登冠医疗器械有限公司。
1.3 方法
1.3.1 菌种分离与纯化
分别称取两个窖泥样品各10 g于100 mL无菌生理盐水中充分振荡混匀,取上清液以10倍梯度稀释法逐级稀释,得到10-1~10-7菌悬液。不同稀释度的菌悬液于筛选培养基上涂布,35 ℃倒置培养48 h,观察选取具有透明圈的菌落,之后进行分离、纯化和保藏。
1.3.2 菌种鉴定
形态学鉴定:待纯化菌株长出后,按照《常见细菌鉴定手册》对菌株进行形态学观察和革兰氏染色[18-19]。
分子生物学鉴定:将纯化后的菌株送至成都擎科生物科技股份有限公司进行测序。测序结果提交至美国国家生物信息中心(national center of biotechnology information,NCBI)的GenBank数据库中,与已知模式菌株的16S rDNA基因序列进行基本局部比对搜索工具(basic local alignment search tool,BLAST)同源性比对,选取同源性较高的菌株,采用MEGA X软件中的邻接(neighbor joining,NJ)法构建系统发育树[20]。
1.3.3 种子液、发酵液及粗酶液的制备
将筛选菌株CY-1、CY-2、SY-3分别挑取一环接种于液体培养基中,于35 ℃、150 r/min条件下将活细胞培养至106CFU/mL,得到菌株CY-1、CY-2、SY-3种子液;将菌株JM-4挑一环接种于YPD液体培养基中,于30 ℃、100 r/min条件下将活细胞培养至106CFU/mL,得到菌株JM-4种子液。将菌株CY-1、CY-2、SY-3和JM-4种子液按照体积比1∶1∶1∶1混合,制备得到混菌种子液[17]。
将菌株CY-1、CY-2、SY-3、JM-4种子液和混菌种子液分别以5%的接种量接种于100 mL发酵培养基中,于35 ℃、150 r/min条件下培养48 h,得到发酵液。
发酵液在4 ℃、10 000 r/min条件下离心10 min,除去沉淀,留取上清液即得粗酶液,4 ℃保存。
1.3.4 筛选菌株的透明圈直径及酯化酶活力测定
将已灭菌的水琼脂培养基倒至培养皿下层约10 mL,待其凝固;之后在凝固的培养基表面垂直放上牛津杯轻轻加压,使其与培养基接触无空隙;再将筛选培养基倒在底层培养基上,待其凝固后,取出牛津杯,即形成孔洞。向孔洞内接种0.1 mL酶液(种子液离心上清液),室温扩散30 min,培养皿正面向上置于35 ℃培养48 h,观察培养孔周围透明圈大小。参照刘延波等[21]的测定方法测定筛选菌株单菌发酵及混菌(菌株CY-1、CY-2、SY-3和JM-4种子液按照体积比1∶1∶1∶1)协同发酵的粗酶液中酯化酶活力,每组3个平行,同时做空白对照。
1.3.5 协同发酵条件优化
(1)单因素试验
探究混菌(菌株CY-1、CY-2、SY-3和JM-4种子液按照体积比1∶1∶1∶1)协同发酵接种量(1%、3%、5%、7%、9%);初始pH值(3、4、5、6、7);发酵时间(24 h、36 h、48 h、60 h、72 h)对酯化酶活力的影响。
(2)正交试验
在单因素试验的基础上,以接种量(A),初始pH值(B)及发酵时间(C)为影响因素,酯化酶活力为考察指标,通过L9(33)正交设计进行协同发酵条件优化正交试验,正交试验因素与水平见表1。

表1 协同发酵条件优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for conditions optimization of synergistic fermentation
1.3.6 发酵产物挥发性化合物测定
通过HS-SPME-GC-MS测定单菌发酵和混菌协同发酵产物挥发性化合物[22-23]。
样品前处理:取5 mL发酵液于15 mL顶空瓶中,再加入2 g NaCl和10 μL 2-辛醇(82.2 μg/mL)。样品先于50 ℃平衡15min,然后插入萃取针顶空萃取30min,之后进样解吸3min。
气相色谱条件:DB-WAX色谱柱(60 m×250 μm×0.25 μm);升温程序为:35 ℃保持4 min,然后以2 ℃/min升温到60 ℃不保持,再以6 ℃/min升温到180 ℃保持15 min;进样口温度230 ℃;高纯氦气(He)为载气,不分流进样,流速0.9 mL/min。
质谱条件:离子源温度和连接线温度均为230 ℃,四级杆温度为150 ℃;电子电离(electronic ionization,EI)源,电子能量为70 eV;采集模式为全扫描,质谱范围20~550 amu。
定性定量方法:采用美国国家标准技术研究所(national institute of standards and technology,NIST)05a.L标准谱库的GenBank数据库进行基本局部比对搜索工具(basic local alignment search tool,BLAST)同源性比对,选择匹配度均≥80(最大值100)的特征离子进行定性分析,并鉴定结果。以体积分数60%乙醇配制成质量浓度为82.2 μg/mL的2-辛醇作为内标,于5 mL发酵液中加入10 μL 2-辛醇,通过测定样品中挥发性化合物峰面积与2-辛醇峰面积之比以及内标在样品中的最终浓度来计算挥发性化合物的含量。
1.3.7 数据分析
所有数据利用SPSS 20.0软件进行方差分析,采用Origin 2022软件作图。
2 结果与分析
2.1 酯化菌的分离筛选及鉴定结果
2.1.1 筛选菌株形态学鉴定
通过稀释平板涂布法和透明圈法从40年窖泥中共筛选到3株酯化菌,分别编号为CY-1、CY-2和SY-3,其菌落形态、细胞形态和特征描述结果见表2。

表2 筛选菌株的菌落、细胞形态及特征描述Table 2 Colony and cell morphology and characterization description of screened strains
2.1.2 筛选菌株分子生物学鉴定
筛选菌株委托成都擎科科技股份有限公司进行测序,测序结果提交至美国国家生物信息中心(NCBI)的GenBank数据库进行BLAST同源性比对,结果表明,菌株CY-1与阿氏芽孢杆菌(Priestia aryabhattai)同源性达到100%;菌株CY-2与地衣芽孢杆菌(Bacillus licheniformis)同源性达到99%;菌株SY-3与暹罗芽孢杆菌(Bacillus siamensis)同源性达到99%。因此,菌株CY-1被鉴定为阿氏芽孢杆菌(Priestia aryabhattai);菌株CY-2被鉴定为地衣芽孢杆菌(Bacillus licheniformis);菌株SY-3被鉴定为暹罗芽孢杆菌(Bacillus siamensis)。同时对三株菌株构建系统发育树,结果见图1。

图1 基于16S rDNA基因序列筛选菌株的系统发育树Fig.1 Phylogenetic tree of screened strains based on 16S rDNA gene sequence
2.2 筛选菌株产酯化酶活力测定结果
筛选菌株单菌发酵及混菌协同发酵的粗酶液酯化酶活力测定结果见图2。

图2 筛选菌株单菌发酵及混菌协同发酵产酯化酶活力测定结果Fig.2 Determination results of esterification enzyme activity of single and synergistic fermentation of screened strains
由图2可知,单菌中酵母菌JM-4的酯化酶活力最大,为36.44 U/mL,而筛选得到的3株酯化菌粗酶液中菌株CY-1的酯化酶活力最大,为35.44 U/mL,菌株SY-3和CY-2的粗酶液中酯化酶活力稍低于CY-1,分别为32.78 U/mL和31.22 U/mL,酯化酶活力结果与透明圈结果相一致,说明实验结果可靠。此外,混菌协同发酵的酯化酶活力为42.89 U/mL,明显高于单菌发酵。
2.3 混菌协同发酵条件优化单因素试验
2.3.1 接种量对酯化酶活力的影响
由图3可知,酯化酶活力随混菌接种量的增加呈先上升后下降的趋势。当接种量为1%~5%时,酯化酶活力随之增高;当接种量为5%时,混菌协同发酵液的酯化酶活力达到最大,为44.22 U/mL,并且显著高于其他水平(P<0.05);当接种量>5%之后,酯化酶活力有所下降。因此,确定最适的接种量为5%。
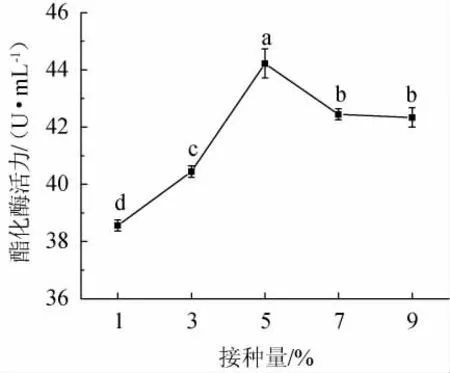
图3 不同混菌接种量对酯化酶活力的影响Fig.3 Effect of different mixed strains inoculum on esterification enzyme activity
2.3.2 初始pH值对酯化酶活力的影响
由图4可知,酯化酶活力随初始pH值的增加呈先上升后下降的趋势。当初始pH值为3~5时,酯化酶活力随之增高;当初始pH值为5时,混菌协同发酵液的酯化酶活力达到最大,为50.78 U/mL,并且显著高于其他水平(P<0.05);当初始pH值>5之后,酯化酶活力有所下降。因此,确定最适的初始pH值为5。

图4 不同初始pH值对酯化酶活力的影响Fig.4 Effect of different initial pH value on esterification enzyme activity
2.3.3 发酵时间对酯化酶活力的影响
由图5可知,酯化酶活力随发酵时间的增加呈先上升后下降的趋势。当发酵时间为24~48 h时,酯化酶活力随之增高;当发酵时间为48 h时,混菌发酵液的酯化酶活力达到最大,为52.11 U/mL,并且显著高于其他水平(P<0.05);当发酵时间>48 h之后,酯化酶活力有所下降。因此,确定最适发酵时间为48 h。

图5 不同发酵时间对酯化酶活力的影响Fig.5 Effect of different fermentation time on esterification enzyme activity
2.4 混菌协同发酵条件优化正交试验结果
在单因素试验的基础上,以接种量(A),初始pH值(B)及发酵时间(C)为考察因素,酯化酶活力为考察指标,通过3因素3水平L9(33)正交设计进行协同发酵条件正交试验,正交试验结果与分析见表3,方差分析结果见表4。
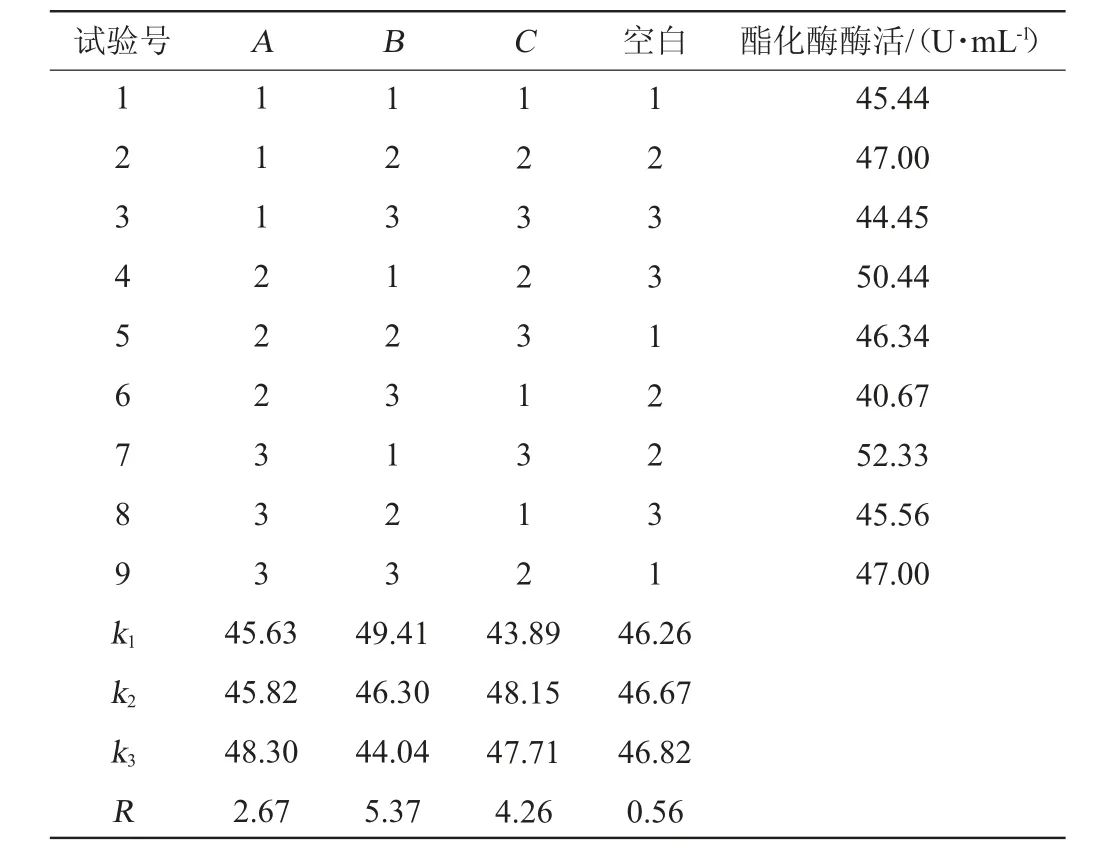
表3 协同发酵条件优化正交试验结果与分析Table 3 Results and analysis of orthogonal experiments for conditions optimization of synergistic fermentation

表4 正交试验结果方差分析Table 4 Variance analysis of orthogonal experiments results
由表3可知,对混菌协同发酵粗酶液酯化酶活力影响最大的因素是初始pH值,其次是发酵时间和接种量。通过极差分析得到最优协同发酵组合为A3B1C2,即接种量6%、初始pH值为4.5、发酵时间48 h。在此优化条件下进行3次平行验证试验,酯化酶活力为52.67 U/mL。
由表4方差分析结果可知,影响混菌协同发酵液酯化酶活力因素顺序为初始pH(B)>发酵时间(C)>接种量(A),与极差分析结果一致。此外,3个因素对酯化酶活力均具有显著影响(P<0.05)。
2.5 挥发性化合物测定结果
采用HS-SPME-GC-MS技术对菌株CY-1、CY-2、SY-3、JM-4单菌发酵和混菌协同发酵产物中挥发性化合物进行测定,结果见表5。由表5可知,所有样品共检出37种挥发性化合物,菌株CY-1、CY-2、SY-3和JM-4单菌发酵粗酶液中分别共检出11种、10种、9种和17种挥发性化合物,混菌协同发酵最优条件下粗酶液中共检出17种挥发性化合物。结果表明,混菌协同发酵挥发性化合物含量有所提升,在酸类物质中尤为明显,同时生成单菌发酵不具备的对白酒起助香作用的化合物,其中己酸乙酯含量最高,并且其是浓香型白酒的主体挥发性化合物[24]。此外,己酸乙酯和辛酸乙酯的前体物质己酸和辛酸在最优发酵条件下产生,说明混菌协同发酵能够促进己酸和辛酸的生成。混菌协同发酵同样能够提升2,3-丁二醇和3-羟基-2-丁酮的含量,有研究表明这两种化合物在白酒中能够发挥促进产生浓厚、优良风味的作用[25-27]。

表5 单菌发酵及混菌协同发酵产物挥发性化合物测定结果Table 5 Determination results of volatile compounds fermentation products by single strain fermentation and mixed strains synergistic fermentation
3 结论
本试验从窖泥中筛选到3株具有产酯化酶能力的细菌,经形态学观察及分子生物学鉴定,菌株CY-1被鉴定为阿氏芽孢杆菌(Priestia aryabhattai);菌株CY-2被鉴定为地衣芽孢杆菌(Bacillus licheniformis);菌株SY-3被鉴定为暹罗芽孢杆菌(Bacillus siamensis)。将这3株筛选菌株与异常威克汉姆酵母(Wickerhamomyces anomalus)JM-4进行等比例混菌协同发酵,以酯化酶活力为评价指标,通过单因素及正交试验确定最优协同发酵条件为接种量6%、初始pH值为4.5、发酵时间48 h。在此优化条件下,混菌协同发酵液酯化酶活力为52.67 U/mL,相较于优化前提升了22.80%。此外,混菌协同发酵后挥发性化合物含量明显增加,说明协同发酵对风味物质的形成具有积极作用。

