蓝莓酵素复合菌种发酵工艺优化及品质分析
杨彬彦,党 娅,3*,黎坤怡
(1.陕西理工大学 生物科学与工程学院,陕西 汉中 723000;2.陕西省果业管理局秦巴山区蓝莓研究所,陕西 汉中 723000;3.陕西省资源生物重点实验室,陕西 汉中 723000)
蓝莓是抗氧化性最高的水果之一,富含活性酶和各种酚类物质,包括花色苷、黄酮醇和原花青素[1]。然而,由于蓝莓容易受到机械损伤、微生物腐烂和水分流失的影响,因此极易变质,导致保质期短[2]。为了解决这些问题,将蓝莓鲜果进行益生菌发酵用于生产蓝莓酵素,可提高食品保质期、营养及感官品质,并去除食品基质中的不良化合物[3]。
随着人们养生意识的增强,酵素因其较高的营养价值和保健功能逐渐出现在大众的视野中[4]。酵素是指以动物、植物、菌类等为原料,经微生物发酵制得的含有特定生物活性成分的产品[5]。蓝莓浆果经过微生物发酵不仅可以提高蓝莓浆果的利用率,还能提高原料营养多样性和生物活性[6-7]。而益生菌发酵菌种对蓝莓酵素的品质和口感密切相关。益生菌的定义为“当摄入足够量时,为宿主提供健康益处的活的微生物”[8]。基于乳酸菌的发酵有助于提高食物的营养价值和消化率,控制潜在感染,还与功能性生物活性物质有关[9]。植物乳杆菌(Lactobacillus plantarum)是最常用于发酵植物性食品的菌种[10]。干酪乳杆菌(Lactobacillus casei)可以产生各种活性酶,将原料基质转化为功能性成分[11]。酵母菌能够促进乳酸菌等有益菌群繁殖,抑制病原微生物生长,提高食物消化率及增强人体免疫力[12]。利用益生菌在水果基质中发酵比乳制品更复杂,并且生长受其他微生物和发酵条件的影响,例如pH、温度、时间等[13-14]。目前,已有关于发酵菌种制备蓝莓酵素的研究报道[15-16]。LI S J等[17]从水果中筛选出植物乳杆菌和发酵乳杆菌,发现其在蓝莓汁中具有良好的发酵能力,活菌数超过10.0 lg CFU/mL,同时提高了酚类含量和抗氧化能力。白琳等[18]利用植物乳杆菌、乳酸片球菌、嗜酸乳杆菌、副干酪乳杆菌、鼠李糖乳杆菌发酵蓝莓果汁,均匀设计确定其最佳接种体积比例分别为22.45%、42.86%、14.29%、16.33%、4.10%,响应面优化最佳发酵工艺为发酵时间36 h,发酵温度37 ℃,初始接种量5.5×106CFU/mL,初始总可溶性固形物(total soluble solid,TSS)含量为11°Bx,发酵后蓝莓酵素的超氧化物歧化酶(superoxide dismutase,SOD)活力达87.45 U/g。李虹甫等[19]选择植物乳杆菌J26对蓝莓果汁在发酵温度37 ℃、发酵时间24 h、发酵剂接种量3%的条件下进行发酵,活菌数可达1×109CFU/mL。然而,我国的蓝莓酵素还处于初步阶段,其生产研究和产业化都不完善[20-23]。此外,发酵工艺还存在原料利用率低;发酵参数变化复杂、难以控制且发酵周期较长;营养成分损失大、成本高、品质低、效率差等问题。
本研究以蓝莓为主要原料,以酵母菌、植物乳杆菌(Lactobacillus plantarum)、干酪乳杆菌(Lactobacillus casei)为发酵菌种制备蓝莓酵素,以SOD酶活性为考察指标,首先通过均匀设计试验确定复合菌种的最佳体积接种比例;其次通过单因素试验,考察发酵时间、发酵温度、初始总可溶性固形物含量及料液比对超氧化物歧化酶(SOD)活力的影响;最后通过响应面试验获得最佳发酵工艺条件。以期生产具有高抗氧化能力的新型发酵非乳制饮料,为生产品质优良、营养丰富的蓝莓酵素提供理论依据和技术支持,提高蓝莓的利用率和附加值。
1 材料与方法
1.1 材料与试剂
新鲜蓝莓:产自陕西汉中;葡萄酒果酒专用酵母:安琪酵母股份有限公司;白砂糖:西安沣东新城永胜食品厂;植物乳杆菌(Lactobacillus plantarum)21809、干酪乳杆菌(Lactobacillus casei)6104:中国工业微生物菌种保藏管理中心;果胶酶(30 000 U/g)、纤维素酶(100 000 U/g)、半纤维素酶(50 000 U/g):山东隆科特酶制剂有限公司;MRS肉汤培养基:北京奥博星生物技术有限公司;总超氧化物歧化酶(T-SOD)测定试剂盒:南京建成生物工程研究所;冰乙酸(分析纯):成都市科隆化学品有限公司;无水乙醇(分析纯):天津市富宇精细化工有限公司;氯化钠(分析纯):天津市天力化学试剂有限公司。
1.2 仪器与设备
T6紫外可见分光光度计:北京普析通用仪器有限公司;DSX-18L高压蒸汽灭菌锅:上海博讯医疗生物仪器有限公司;TDZ4A-WS台式低速离心机:湖南湘仪实验室仪器开发有限公司;HH-4数显恒温水浴锅:上海浦东物理光学仪器厂;NR-EW63WXA-H冰箱:中国海尔公司;CP114电子天平:奥豪斯仪器(常州)有限公司;PHS-3C pH计:上海仪电科学仪器有限公司;JYL-C50T打浆机:九阳股份有限公司;DH3600BⅡ电热恒温培养箱:天津市泰斯特仪器公司;SW-CJ-2FD洁净工作台:苏州安泰空气技术有限公司;手持式折光仪:艾普计量仪器有限公司。
1.3 方法
1.3.1 蓝莓酵素加工工艺流程及操作要点
蓝莓预处理→清洗、打浆→酶解→调整糖度→灭菌→接种→发酵→静置→过滤→蓝莓酵素成品
操作要点:
酵母菌活化:将葡萄酒果酒专用酵母用10倍蒸馏水搅拌均匀至溶解,放置在30~35 ℃恒温水浴锅中活化30 min,当出现大量泡沫即表明活化完毕,取出备用。植物乳杆菌(干酪乳杆菌)活化:将斜面保藏的植物乳杆菌(干酪乳杆菌)在MRS肉汤培养基中活化,两次继代培养后,36 ℃条件下静置培养48 h,备用。
将冷冻的蓝莓(-20 ℃)在4 ℃解冻后清洗晾干,用榨汁机破碎得到蓝莓果浆,在55 ℃条件下加入0.8%的果胶酶、纤维素酶、半纤维素酶(2∶1∶1)酶解3 h[18]。酶解结束后向蓝莓果浆中加入一定量的白砂糖,调整初始TSS含量为12°Bx。采用巴氏杀菌法杀菌(85 ℃、15 min)。将活化完成的酵母菌、植物乳杆菌及干酪乳杆菌接种发酵(采用血球计数板在显微镜下计数保证菌种的活菌数达到109CFU/mL,体积比为0.1%、2%、0.47%),在31 ℃发酵40 h,4 ℃条件下静置2 h、使用纱布对其过滤,获得蓝莓酵素成品。
1.3.2 复合菌种接种量优化均匀设计试验
根据成福等[24-25]的方法进行3因素8水平的试验设计。均匀设计试验中,以SOD酶活性、pH值为响应值,以3种复合菌种(酵母菌、植物乳杆菌、干酪乳杆菌)的接种体积比例为影响因素。在温度为31 ℃,初始TSS含量为12 °Bx,料液比为1∶5的条件下发酵40 h,均匀设计试验因素与水平见表1。

表1 复合菌种接种量优化均匀设计试验因素及水平Table 1 Factors and levels of uniform design tests for inoculum optimization of mixed strains
1.3.3 发酵条件优化单因素试验
固定各菌种初始接种量为109CFU/mL,参考上述工艺固定其他指标,考察发酵时间(32 h、36 h、40 h、44 h、48 h)、发酵温度(28 ℃、31 ℃、34 ℃、37 ℃、40 ℃)、料液比(1∶4、1∶5、1∶6、1∶7、1∶8(g∶mL))、初始TSS含量(9°Bx、10°Bx、11°Bx、12°Bx、13°Bx)4个因素对SOD酶活力的影响。
1.3.4 发酵条件优化响应面试验
在单因素试验结果的基础上,以SOD酶活(Y)为响应值,根据Box-Behnken中心组合试验设计原理,选择发酵时间(A)、发酵温度(B)、初始TSS含量(C)、料液比(D)4个因素为自变量,采用4因素3水平的响应面试验,优化蓝莓酵素发酵的最佳工艺条件。发酵条件优化响应面试验因素与水平见表2。

表2 发酵条件优化响应面试验因素与水平Table 2 Factors and levels of response surface tests for fermentation conditions optimization
1.3.5 分析检测
pH值的测定:采用pH计;SOD酶活力的测定:采用SOD酶试剂盒;总可溶性固形物含量的测定:采用折光计法;乳酸菌活菌数的测定:参照GB 4789.35—2016《食品微生物学检验乳酸菌检验》。总花色苷含量的测定:采用pH示差法[26]。酒精度的测定:参照GB 5009.225—2023《酒中乙醇浓度的测定》;总酚含量的测定:采用福林酚法[27]。
1.3.6 数据处理
试验均重复3次,结果以“平均值±标准差”表示,采用SPSS 24.0软件进行统计分析和处理,Origin 2021进行绘图,Design-Expert 13.0进行响应面分析。
2 结果与分析
2.1 复合菌种接种量优化均匀设计试验结果与分析
均匀设计试验优化复合菌种接种量的结果与分析见表3。
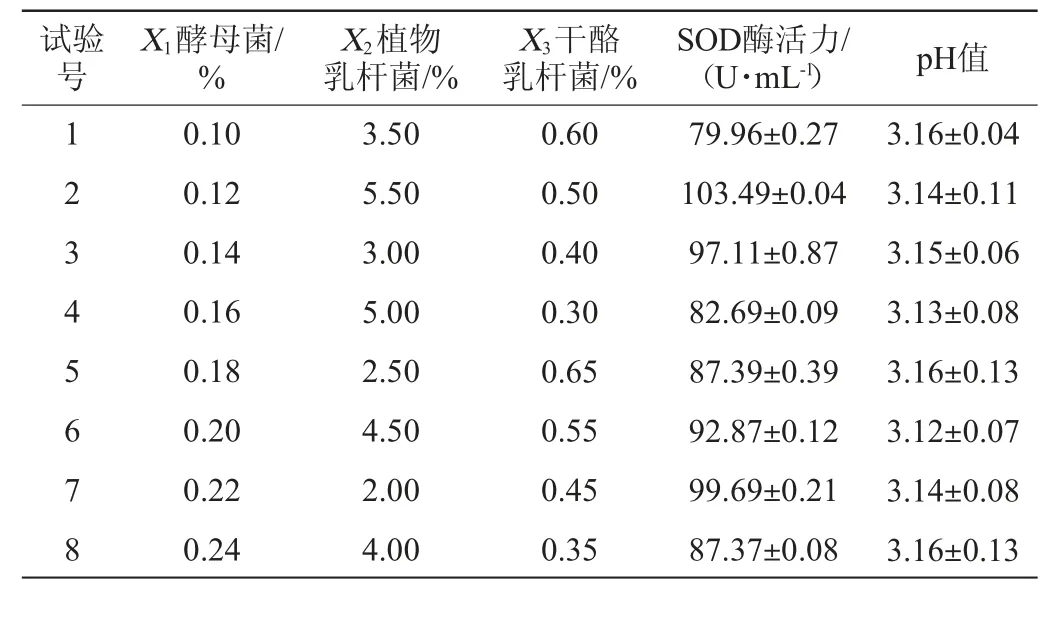
表3 复合菌种接种量优化均匀设计试验结果与分析Table 3 Results and analysis of uniform design tests for inoculum optimization of mixed strains
由表3可知,在8组试验中,各组试验的pH值差异不明显,SOD酶活显示出较大不同。故以SOD酶活(Y)为响应值,运用SPSS 24.0软件建立二次多项式回归方程如下:
Y=18.756-32.227X2+561.391X3-8.976X1X2+4.393X22-587.476X3X2
对回归方程进行方差分析,决定系数R2=0.96,调整决定系数R2adj=0.92,F值为11.77,P值为0.01<0.1,达到极显著水平,证明该回归方程可以较准确地预测最佳接种量。运用Excel 2016预测蓝莓酵素的最佳接种量分别为酵母菌0.1%、植物乳杆菌2%、干酪乳杆菌0.47%,在此条件下,SOD酶活达105 U/mL。根据预测出的最佳条件进行3次平行验证试验,得出蓝莓酵素的SOD酶活为101 U/mL。
2.2 发酵条件优化单因素试验结果
发酵温度、发酵时间、初始可溶性固形物和料液比对蓝莓酵素SOD酶活力的影响见图1。
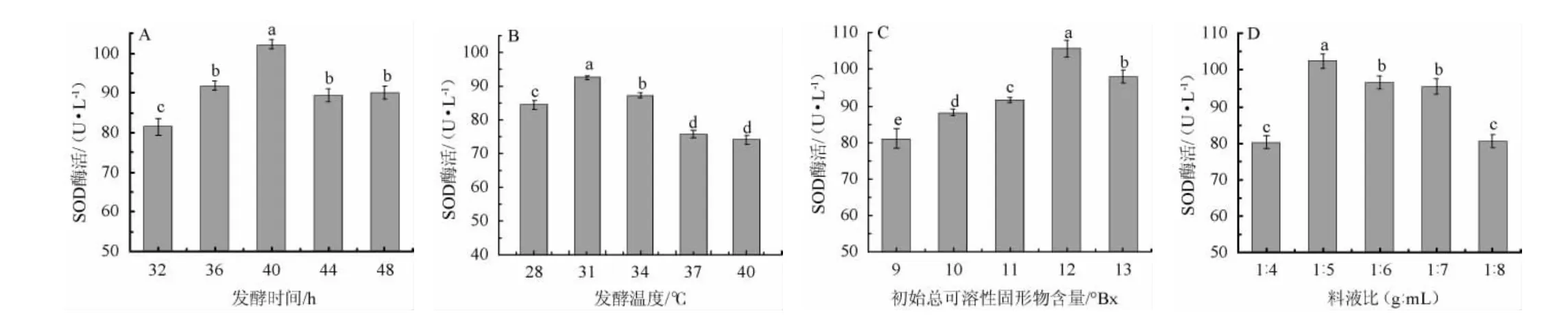
图1 发酵时间(A)、发酵温度(B)、初始总可溶性固形物含量(C)和料液比(D)对蓝莓酵素SOD酶活的影响Fig.1 Effects of fermentation time (A), temperature (B), initial total soluble solid content (C), and solid and liquid ratio (D) on SOD activity of blueberry Jiaosu
由图1A可知,随着发酵时间在32~40 h范围内延长,SOD酶活逐渐增加;发酵时间为40h时,SOD酶活达到最大,为102 U/mL;发酵时间>40 h,SOD酶活力降低。因此,确定最佳发酵时间为40 h。由图1B可知,随着发酵温度在28~31 ℃的升高,SOD酶活逐渐增加;发酵温度为31 ℃时,SOD酶活达最高值,为92 U/mL;当发酵温度高于31 ℃时,SOD酶活力逐步下降。因此,确定最佳发酵温度为31℃。由图1C可知,随着初始TSS含量的升高,SOD酶活力逐渐增加;当初始TSS含量为12°Bx时,SOD酶活力达最大值,为105 U/mL;当初始TSS含量>12°Bx时,SOD酶活力逐渐下降。因此,确定最佳初始TSS含量为12°Bx。由图1D可知,当料液比为1∶4、1∶5(g∶mL)时,SOD酶活力逐渐增加;当料液比为1∶5(g∶mL)时,SOD酶活达最高值,为102 U/mL;当料液比为1∶5、1∶6、1∶7、1∶8(g∶mL)时,SOD酶活逐渐下降。因此,确定最佳料液比为1∶5(g∶mL)。
2.3 发酵条件优化响应面试验结果与分析
在单因素试验结果的基础上,以SOD酶活(Y)为响应值,根据Box-Behnken中心组合试验设计原理,选择发酵时间(A)、发酵温度(B)、初始TSS含量(C)、料液比(D)4个因素为自变量进行4因素3水平的响应面试验,优化蓝莓酵素发酵的最佳工艺条件。发酵条件优化响应面试验设计及结果见表4,方差分析见表5。

表4 发酵条件优化响应面试验设计与结果Table 4 Design and results of response surface tests for fermentation conditions optimization

表5 回归模型方差分析Table 5 Variance analysis of regression model
通过Design-Expert 13.0软件对表4结果进行方差分析和二元多次回归拟合,获得SOD酶活与发酵时间、发酵温度、初始TSS含量、料液比的二次多项式回归方程如下:
Y=105.52-1.89A+1.29B+0.78C+0.39D-3.48AB+1.88AC+0.4AD-
1.93BC+0.14BD-1.91CD-12.13A2-8.93B2-11.08C2-6.33D2
由表5可知,该模型极显著(P<0.000 1),失拟项P值为0.472 7>0.05,即失拟项不显著,决定系数R2=0.991,调整决定系数R2Adj=0.983,说明此模型拟合效果良好,能够分析预测蓝莓酵素的发酵工艺参数。由P值可知,一次项A、B,交互项AB、AC、BC、CD,二次项A2、B2、C2、D2对结果影响极显著(P<0.01);一次项C对结果影响显著(P<0.05);其他项对结果影响不显著(P>0.05)。由F值可知,各因素对SOD酶活影响大小顺序为A>B>C>D。
响应面的等高线形状及响应面坡度可以反映自变量之间的交互影响,响应面坡面越陡,表明因素之间的相互作用越显著。由图2可知,发酵时间(A)与发酵温度(B)、发酵时间(A)与初始TSS值(C)、发酵温度(B)与初始TSS(C)、初始TSS含量(C)与料液比(D)之间存在交互作用,且这些因素的相互作用对SOD酶活力影响极显著(P<0.01)。

图2 各因素间交互作用对蓝莓酵素SOD酶活影响的响应曲面及等高线Fig.2 Response surface plots and contour lines of effect of interaction between various factors on SOD activity of blueberry Jiaosu
根据响应面试验结果得到蓝莓酵素的最佳发酵工艺条件为发酵时间41.43 h,发酵温度31.09 ℃,初始TSS含量12.04 °Bx,料液比1∶4.99(g∶mL)。在此优化条件下,蓝莓酵素的SOD酶活力预测值可达103.29 U/mL。为方便实际操作,将最佳发酵工艺条件修正为发酵时间41.5 h,发酵温度31 ℃,初始TSS含量12°Bx,料液比1∶5(g∶mL),在此条件下进行3次平行验证试验,得到SOD酶活实际值为103.01 U/mL,与预测值相差不大。
2.4 蓝莓酵素的品质评价
蓝莓酵素成品呈深紫红色,色泽均匀,果香浓郁,口感酸甜适宜,无外来杂质。制备的蓝莓酵素pH值为3.14,酒精度为0.2%vol,总酚含量为3.14 mg/mL,花色苷含量为26.06 mg/mL,乳酸菌活菌数为1.01×107CFU/mL,SOD酶活性为103.01 U/mL,符合行业标准QB/T 5323—2018《植物酵素》要求。
3 结论
该研究以蓝莓为主要原料,以酵母菌、植物乳杆菌、干酪乳杆菌为发酵菌种制备蓝莓酵素,确定酵母菌、植物乳杆菌、干酪乳杆菌三种菌株的最佳接种体积比分别为0.1%、2%、0.47%,蓝莓酵素的最佳发酵工艺条件为发酵时间41.5 h,发酵温度31 ℃,初始总可溶性固形物含量12°Bx,料液比1∶5(g∶mL)。在此优化条件下,蓝莓酵素的SOD酶活力可达103.01 U/mL,pH值为3.14,酒精度为0.2%vol,总酚含量为3.14 mg/mL,花色苷含量为26.06 mg/mL,乳酸菌活菌数为1.01×107CFU/mL。本研究开发出一款具有高SOD酶活力的蓝莓酵素产品,今后可进一步研究酵素制品对人类健康的益处。

