乳腺癌易感基因联合癌抗原125动态监测在预测晚期上皮性卵巢癌病人铂敏感性及预后中的价值
韩姗姗,马玲
作者单位:蚌埠医学院第一附属医院肿瘤妇科,安徽 蚌埠233000
上皮性卵巢癌(EOC)在所有卵巢原发恶性肿瘤中所占的比例约为90%,约75%的EOC 病人诊断时已为晚期,预后极差[1-2]。大约20%的EOC病人对一线化疗不敏感,且约80%的晚期卵巢癌病人在2年内会出现复发并对化疗越来越耐药[3]。因此,能在治疗早期识别出对化疗药物耐药或易复发的高危病人,进行个体化分级管理,对改善预后有重要作用。
血清癌抗原125(CA125)是EOC 病人临床中最常用的监测疾病进展、评估治疗反应和复发的生物标志物[4]。血清CA125水平可用于预测上皮性卵巢癌病人的生存[5],不同时期血清CA125 的水平也被报道为晚期EOC 病人铂敏感性及预后的预测指标[6]。然而CA125单独应用于卵巢癌的诊断检测和预后中时缺乏特异度和灵敏度,特别是在卵巢癌的早期阶段。乳腺癌易感基因(BRCA)突变导致的同源重组缺陷是EOC 中铂敏感性的关键决定因素[7]。大量研究证明BRCA突变的EOC病人对铂类化疗药物和聚二磷酸腺苷核糖聚合酶(PARP)抑制剂的反应更好[8],其预后也优于无BRCA突变的病人[9]。
目前,尚无明确的生物学指标可用于预测EOC病人对铂类化疗药物的灵敏度。基于BRCA 和血清CA125与EOC病人铂敏感性和预后的相关研究,本研究进一步探究胚系BRCA 联合治疗早期血清CA125动态检测对预测晚期EOC病人铂敏感性的价值,及在判断晚期EOC病人预后中的作用。为晚期EOC病人选择个体化的治疗方案提供一定的指导作用。
1 资料与方法
1.1 一般资料符合以下纳入标准的病人:(1)2017年1月至2020年1月在蚌埠医学院第一附属医院确诊并行全面分期手术或满意肿瘤细胞减灭术的EOC病人;(2)已于我院行胚系BRCA 基因检测;(3)术后采用TC(紫杉醇+卡铂)或TP(紫杉醇+顺铂)方案静脉化疗,早期病人化疗3~6 个疗程,晚期病人6~8 个疗程;(4)在诊断时和每个化疗周期均监测血清CA125水平;(5)有完整的临床资料并可随访。病人或其近亲属知情同意,本研究符合《世界医学协会赫尔辛基宣言》相关要求。
胚系BRCA 基因检测采用的是新一代高通量测序法,检测位点包括全编码区及外显子-内含子连接区、部分内含子和UTR 区热点突变。采用美国医学遗传学与基因组学学会和美国分子病理学会序列变异解读标准与指南(2015 版)[10]和BRCA1∕2 数据解读中国专家共识(2021 版)[11]作为变异分类解读的标准与规范。BRCA 的变异分为5 类∶1 类为良性变异;2 类为可能良性变异;3 类为意义未明变异;4类为可能致病性变异;5类为致病性变异。目前第3类变异的生物学行为尚不清楚,因此本研究中1~3类均被认定为BRCA 野生型,只有4类和5类的结果被认定为BRCA突变型。
肿瘤无进展生存期(PFS)的定义是从初始治疗到病情进展(复发)或最后一次随访的时间。初治铂敏感性是对术后辅助化疗的反应,在化疗结束后间隔<6个月内出现复发定义为铂耐药;间隔>6个月发生复发定义为铂敏感。血清CA125的正常值范围为≤35 U∕mL。治疗早期血清CA125 正常化定义为第4周期辅助化疗前血清CA125水平降至正常值范围。
1.2 统计学方法将收集到的数据采用SPSS 26.0软件和GraphPad 8.0.2 软件进行统计分析。比较胚系BRCA 与临床病理特征之间的关系采用χ2检验。计算曲线下面积(AUC)值等用于评估胚系BRCA 和治疗早期动态监测血清CA125水平在预测初始铂敏感性中的效能,AUC≥0.70 表示诊断效能较高,0.61~0.69 表示有一定诊断效能,0.51~0.60 表示诊断效能较差。通过Kaplan-Meier 法绘制晚期EOC 病人PFS的生存曲线图,使用log-rank检验进行组与组之间生存曲线的比较,多重比较以Bonferroni校正对阈值进行调整。通过Cox回归模型分析影响晚期EOC病人PFS的独立预后因素。P<0.05为差异有统计学意义。
2 结果
2.1 胚系BRCA1/2 突变具体情况在符合纳入标准的151 例EOC 病人中,胚系BRCA 的总突变率为28.5%,其中37 例(24.5%)为BRCA1 突变,6 例(4.0%)为BRCA2突变。
胚系BRCA1 突变型病人中有34 例突变的基因亚区位于外显子区(exon),其中包括exon11(21例),exon24(5 例),exon2(2 例),exon7(2 例),exon16(2例),及exon22、exon15、exon5、exon20、exon21 各1例。胚系BRCA2突变的基因亚区均位于外显子区,包括exon11(3 例),exon14(2 例)和exon23(1 例)。胚系BRCA1∕2 外显子突变中存在3 种类型的突变,其中移码突变所占比例最高为62.5%(25∕40),无义突 变 占32.5%(13∕40)、错 义 突 变 占5%(2∕40)。BRCA1突变型病人中另有3例突变的基因亚区位于内含子区(intron),分别为intron21、intron16、intron2,均为剪接突变。
在BRCA1 突变型病人中发现有6 种重复的突变位点。其中有5 例病人的突变位点均为c.981_982delAT。4 例病人的突变位点均为c.5470_5477delATTGGGCA。c.4065_4068delTCAA、c.1504_1508delTTAAA、c.335delA 及c.3770_3771delAG 位点各有2例。在BRCA2突变病人中发现有1种重复的突变位点,2 例病人的突变位点为c.5576_5579delTTAA。
2.2 胚系BRCA 与EOC 病人临床病理特征的关系BRCA 突变组病人确诊年龄<55 岁的比例(65.1%)高于野生组(30.6%)(P<0.001)。高级别浆液性癌在BRCA 突变组中占88.4%,在BRCA 野生组中占54.6%(P<0.001)。一线初始治疗后,BRCA 突变组中93.0%的病人铂敏感,BRCA 野生组中71.3%的病人铂敏感,(P=0.008)。BRCA 突变组中有HBOC 家族史的病人17 例(39.5%),BRCA 野生组中有16 例(14.8%)(P=0.001)。在具有HBOC 家族史的33例病人中BRCA突变检出率高达51.5%。
本研究将治疗前血清CA125 水平分为阴性组和阳性组、低水平表达组与高水平表达组分别与胚系BRCA 进行分析。结果显示,胚系BRCA 突变状态与治疗前血清CA125 水平之间有统计学相关性(P=0.029)。胚系BRCA 突变组病人治疗前血清CA125 阳性的比例及高水平表达的比例均较胚系BRCA野生组高。见表1。
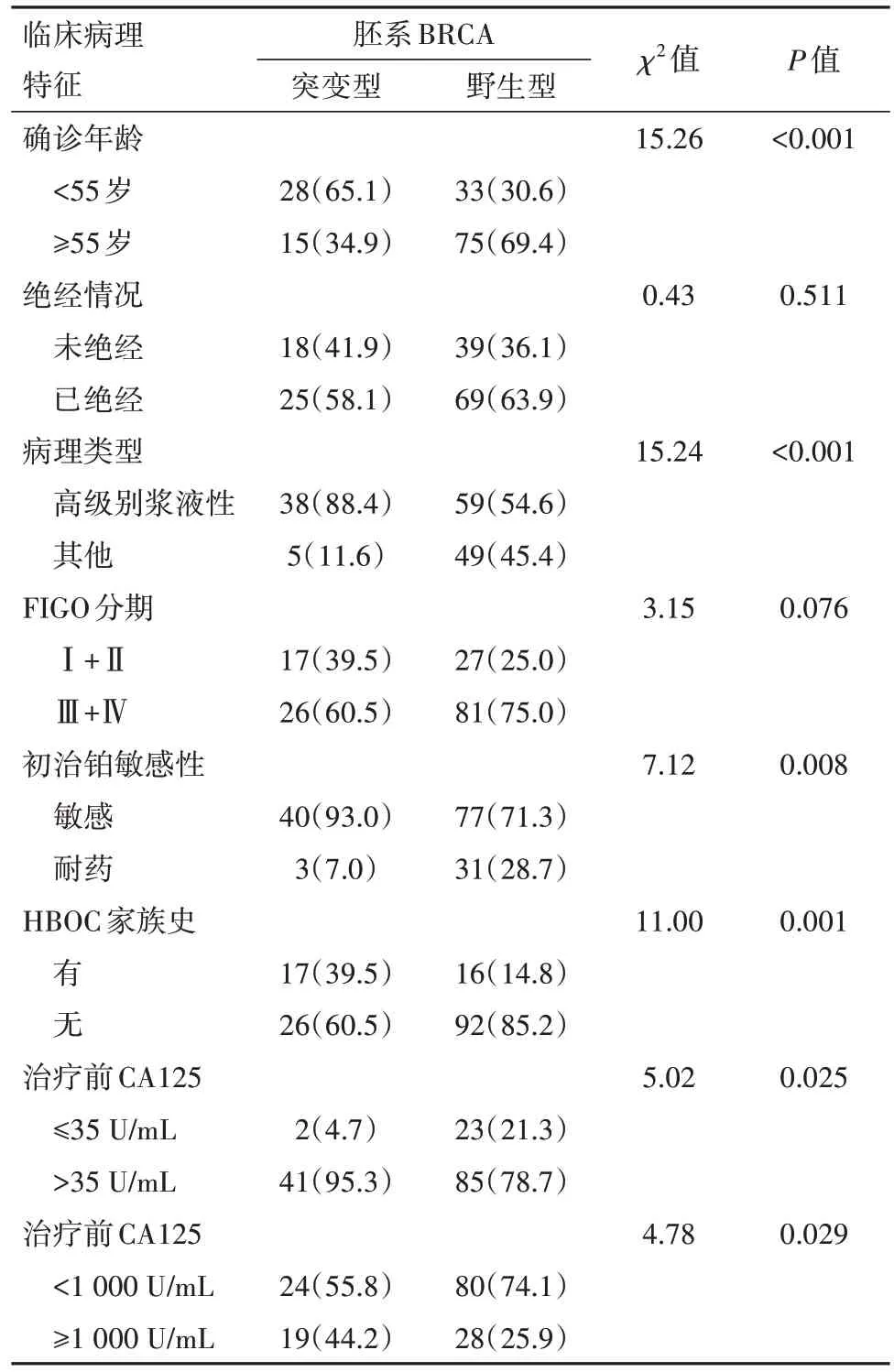
表1 上皮性卵巢癌151例胚系BRCA与临床病理特征情况∕例(%)
2.3 胚系BRCA、血清CA125 动态监测对晚期EOC 病人初治铂敏感性的预测价值在107 例晚期(FIGOⅢ、Ⅳ期)EOC病人中,74例病人铂敏感,33例病人铂耐药。治疗前血清CA125、术后血清CA125、第二周期化疗后CA125、第三周期化疗后CA125 在预测初治时铂敏感性的AUC 分别为0.56、0.66、0.70、0.64。第一周期化疗后血清CA125 水平预测初治铂敏感性的AUC 为0.76,灵敏度为72.7%,特异度为78.4%。胚系BRCA 预测初治铂敏感性的AUC为0.63,灵敏度为93.9%,但特异度仅为32.4%。
将胚系BRCA 与第一周期化疗后血清CA125水平串联,即当BRCA为野生型并且第一周期化疗后血清CA125 未正常为阳性结果时,其对预测初治铂敏感性的AUC为0.79。胚系BRCA 与第一周期化疗后血清CA125 水平并联,即符合BRCA 野生型或第一周期化疗后血清CA125未正常两者其中一项为阳性结果时,其对预测初治铂敏感性的AUC为0.59。
胚系BRCA 与第一周期化疗后血清CA125水平串联,对初治铂敏感性的预测效能较两者单独应用时均有提高,灵敏度为72.7%,特异度为78.4%,约登指数为0.59。见表2。

表2 胚系BRCA、治疗早期血清CA125对晚期上皮性卵巢癌107例初治铂敏感性的预测效能
2.4 胚系BRCA、第一周期化疗后血清CA125与晚期EOC 病人PFS 的关系使用Kaplan-Meier 生存曲线对晚期EOC 病人的PFS 分析显示,BRCA 突变组病人的中位PFS 为29 个月,野生组病人的中位PFS 为23 个月,两组间PFS 生存曲线差异有统计学意义(P=0.049)。第一周期化疗后CA125≤35 U∕mL组病人的中位PFS 为27 个月,显著高于第一周期化疗后CA125>35 U∕mL组病人的中位PFS为14.5个月(P=0.039)。
在胚系BRCA 与血清CA125 的联合分析中,四组生存曲线之间差异有统计学意义(P=0.002)。且BRCA 野生型+第一周期化疗后CA125>35 U∕mL 组病人的PFS 显著低于其他组,与BRCA 突变型+第一周期化疗后CA125≤35 U∕mL 组、BRCA 突变型+第一周期化疗后CA125>35 U∕mL 组、BRCA 野生型+第一周期化疗后CA125≤35 U∕mL组之间的生存曲线分别比较,均差异有统计学意义(P=0.013、0.007、0.003)。
2.5 EOC病人PFS的单因素及多因素Cox回归分析在EOC 病人PFS 的单变量分析中,确诊年龄、FIGO分期、残留病灶、病理类型、胚系BRCA、术后血清CA125 水平、第一周期化疗后血清CA125 水平及HBOC 家族史等因素均与PFS 相关。多因素Cox 回归分析的结果显示,EOC 病人PFS 的独立预后因素包括:FIGO 分期[HR=3.07,95%CI:(1.55,6.10),P=0.001]、残留病灶[HR=1.96,95%CI:(1.15,3.34),P=0.013]、病理类型[HR=0.53,95%CI:(0.31,0.90),P=0.019]及第一周期化疗后血清CA125水平[HR=1.68,95%CI:(1.02,2.76),P=0.040]。但胚系BRCA 并非EOC病人PFS的独立预后因素(P=0.064)。见表3。
3 讨论
目前,许多新的治疗方法包括血管内皮生长因子抑制剂、PARP 抑制剂和免疫治疗药物等,已被证实可以显著改善EOC 病人的PFS。尤其对于BRCA突变病人,PARP 抑制剂在一线及二线维持治疗方面已有显著的成效。
据报道,BRCA 在高级别浆液性癌中突变率高达20%~25%,子宫内膜样癌中突变率<10%,但在透明细胞癌及其他组织类型中极低[12]。有研究认为CA125的水平越低,肿瘤的病理分级越低,分化越接近于正常的组织[13]。血清CA125 高水平表达则与高级别浆液性癌密切相关[14]。本研究中,BRCA 突变组中高级别浆液性癌占88.4%。血清CA125 高水平表达提示病人BRCA 突变的风险增加。血清CA125 高水平表达、BRCA 突变、高级别浆液性卵巢癌三者间可能存在某种相关的发病机制,具体有待进一步研究。
BRCA 突变时,BRCA 蛋白失去正常功能,也使得铂类药物对细胞DNA 双链结构的破坏性增强[15-16],故BRCA 突变的EOC 病人对铂类化疗药物的反应率更高。本研究中,在一线初始化疗后,BRCA 突变组病人铂敏感的比例显著高于BRCA 野生组病人铂敏感的比例。胚系BRCA 单独用于预测晚期EOC 病人初治铂敏感性时,其灵敏度较高,为93.9%,但特异度仅为32.4%。血清CA125是一线或二线化疗后疾病进展的准确预测因子[17]。本研究中,第一周期化疗后血清CA125 预测晚期EOC 病人初治铂敏感性的AUC 为0.76。两种生物标志物串联后预测效能提高,AUC为0.79,其灵敏度未明显下降,且特异度有明显提高。检测胚系BRCA 及一线化疗期间监测血清CA125 值可能有助于早期发现上皮性卵巢癌病人中铂耐药的高危病人。
大多数研究已证实携带BRCA突变的EOC病人具有生存优势。血清CA125 水平也与EOC 病人的预后明显相关,治疗前CA125 阴性EOC 病人的预后好于CA125 阳性病人[18]。与第4 周期化疗前血清CA125 仍未达到正常化的EOC 病人相比,第1 周期化疗后血清CA125 值降至正常水平的EOC 病人预后显著改善[19]。本研究的生存分析发现,在晚期EOC 病人中,BRCA 突变型较野生型病人的PFS 延长,第一周期化疗后血清CA125 正常较未正常病人的PFS 明显延长。两者联合分析显示,BRCA 突变型的病人,无论其第一周期化疗后血清CA125 是否正常,预后均较好。而BRCA 野生型且第一周期化疗后CA125 未正常组的病人在晚期EOC 病人中的PFS 是最差的。胚系BRCA 与第一周期化疗后CA125 两者结合可更精确的判断预后,快速筛选出易复发的EOC病人。
综上所述,胚系BRCA 联合治疗早期血清CA125 动态监测对晚期EOC 病人预测铂敏感性及判断预后有一定的价值。胚系BRCA 野生型且第一周期化疗后血清CA125 水平未正常的EOC 病人提示铂耐药及易复发的风险高。两者联合检测可为EOC 病人在治疗的早期阶段选择更加合适有效的治疗方案提供一定的指导作用,为铂耐药及易复发的EOC病人争取提高生存率的机会。

