盐酸环丙沙星的微生物限度检查方法学验证
周东方,朱菊红*,董秀玉,朱飞松
(1.浙江华润三九众益制药有限公司,浙江 丽水 323000;2.东阳市医疗保障中心,浙江 东阳 322100;3.浙江孚诺医药股份有限公司,浙江 东阳 322100)
0 引言
微生物限度检查法系指检查非规定灭菌制剂及其原料、辅料受微生物污染程度的方法。检查项目包括需氧菌总数、霉菌数和酵母菌总数、控制菌检查[1]。盐酸环丙沙星为第三代喹诺酮类抗菌药物[2],可通过抑制细菌DNA 的合成和复制使细菌死亡,导致在日常进行微生物限度检查时实验结果存在干扰和数据不准确。因喹诺酮类抗生素具有强烈的抑菌性,可采用改变培养基pH,供试液加入镁离子或钙离子,薄膜过滤加离心方法都能有效中和喹诺酮类制剂产品的抑菌性[3-7]。改变培养基pH 对需氧菌、霉菌和酵母菌生长有影响,不利于日常准确检测盐酸环丙沙星受污染程度。盐酸环丙沙星溶于水,为了减少实验和人为误差,本次试验在不改变各项试剂性质的条件下用最少的步骤进行盐酸环丙沙星的微生物限度检查,采用加大稀释倍数,加入中和剂(氯化钙、硫酸镁),薄膜过滤法三者结合对其抑菌性进行中和后进行微生物限度计数、控制菌检查方法适用性试验,证实采用的方法可有效消除其抑菌性,计数方法适用性回收率在50%~200% 范围内,控制菌(大肠埃希菌) 适用性试验满足要求。
1 实验部分
1.1 仪器
BHC-1300IIA2 生物安全柜(苏洁医疗器械);LMQ.C-100E 立式灭菌器(山东新华医疗);XG1.D 脉动真空灭菌柜(山东新华医疗);FD260 热风循环烘箱(德国binder 宾得);mL203T/03 电子天平(梅特勒托利多);FE28pH 计(梅特勒托利多);HTY-305S 微生物限度检测仪(浙江泰林生物);LRH-250F 生化培养箱(上海一恒科学仪器);HYC-940 医用冷藏箱(青岛海尔);DW-86W100 医用低温保存箱(青岛海尔)。
1.2 药品
盐酸环丙沙星(批号:D2112006,浙江国邦药业有限公司)。
1.3 试验菌种
金黄色葡萄球菌[CMCC(B)26 003]、枯草芽孢杆菌[CMCC(B)63 501]、铜绿假单胞菌[CMCC(B)10 104]、白色念珠菌[CMCC(F)98 001]、黑曲霉[CMCC(F) 98 003]、大肠埃希菌[CMCC(B)44 102]。购于中国食品药品检定研究院,传代为第2 代,菌液使用为第3 代。注:下列正文中菌种名称采用菌种编号代替。
1.4 培养基与试剂
胰酪大豆胨琼脂培养基(TSA)、沙氏葡萄糖琼脂培养基(SDA)、胰酪大豆胨液体培养基(TSB)、麦康凯液体培养基(MCB)、麦康凯琼脂培养基(MCA)、pH 值为7.0 氯化钠蛋白胨缓冲液(SCP)以上干粉培养基均购于北京三药科技有限公司;硫酸镁(化学纯,国药集团),氯化钙(化学纯,国药集团)。下列正文中培养基名称采用培养基通用缩写代替。
1.5 菌液、培养基、溶液制备
将金黄色葡萄球菌、大肠埃希菌、铜绿假单胞菌、白色念珠菌、黑曲霉和大肠埃希菌制备参照《中国药典》2020 版通则1105、1106“菌种及菌液制备”进行新鲜浓菌液的制备。将浓菌液逐步进行稀释,使其最后的菌液计数结果不大于100 cfu/mL,菌液在2~8 ℃保存,在24 h 内有效。
培养基的制备参照说明书进行配制与灭菌,按照《中国药典》 2020 版通则1105 项下“表1 试验菌液的制备和使用”中的“计数培养基适用性检查”规定,接种不大于100 cfu 的菌液至TSB 或TSA 平板或SDA平板中;用相应的对照培养基替代被检培养基进行同法操作。将所有培养物在表1 规定条件下培养,每天计数,计数结束后把被检固体培养基上的菌落平均数与对照培养基上的菌落平均数的比值在0.5~2.0 范围内,表示结果满足要求,该培养基可在进行后续试验中使用。
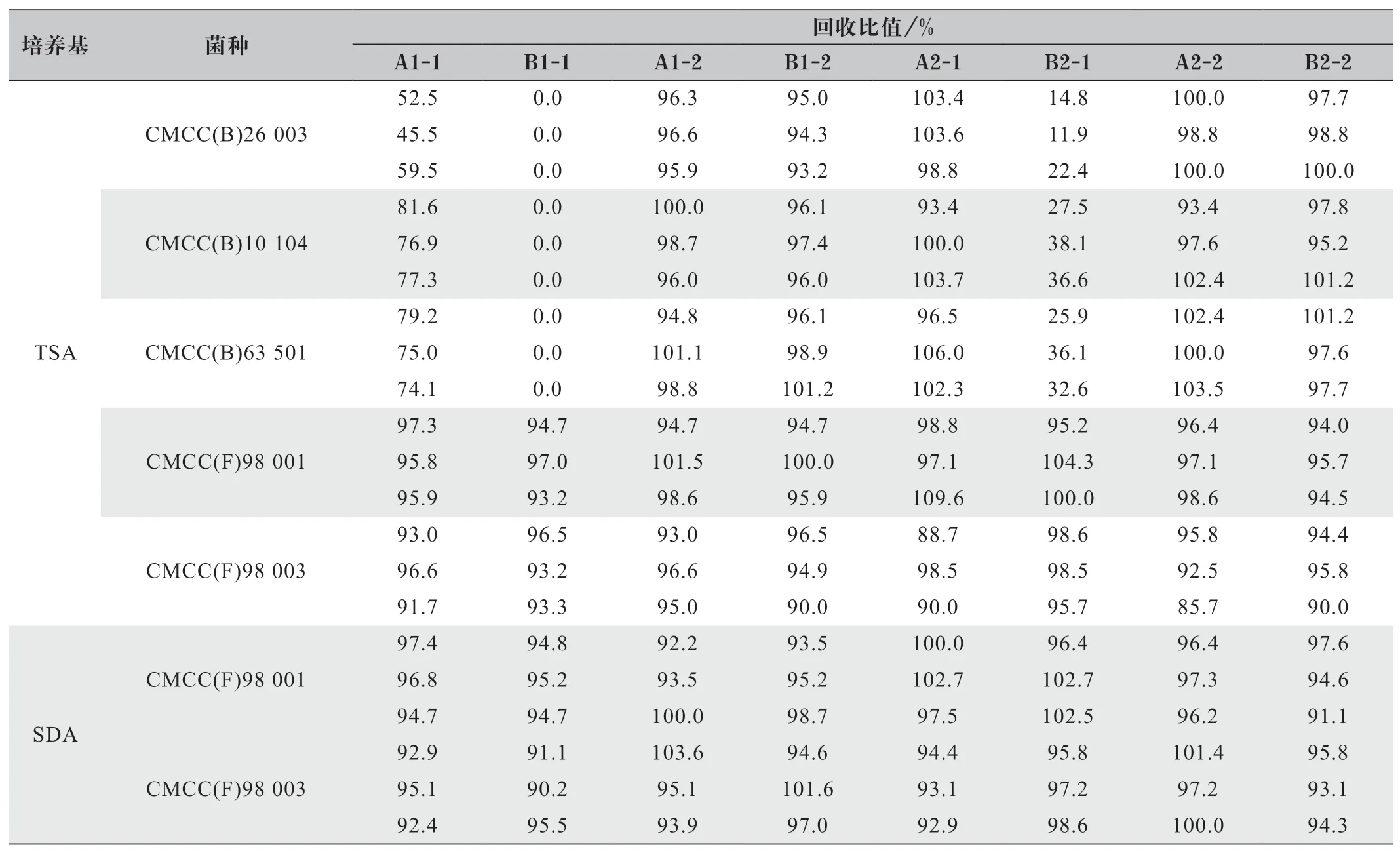
表1 微生物限度计数方法适用性回收率
无菌0.5 g/mL 硫酸镁溶液配制方法:称取20 g硫酸镁,加40 mL 纯化水使溶解,过滤,去除杂质,置100 mL 蓝盖瓶中,121 ℃湿热灭菌15 min,冷却备用。
无菌0.6 g/mL 氯化钙溶液配制方法:称取24 g氯化钙,加40 mL 纯化水使溶解,过滤,去除杂质,置100 mL 蓝盖瓶中,121 ℃湿热灭菌15 min,冷却备用。
1.6 供试液的制备
(1) 称取供试品约10 g 至无菌质均袋中,加0.5 g/mL 硫酸镁溶液5 mL 和温度不超过45 ℃的SCP 至100 mL,混合均匀,制成1∶10 供试液,再取1∶10 供试液30 mL 至无菌锥形瓶中,加0.5 g/mL硫酸镁溶液5 mL,加SCP 至300 mL,制成1∶100 供试液,待用。
(2) 称取供试品约10 g 至无菌质均袋中,加0.6 g/mL 氯化钙溶液5 mL 和温度不超过45 ℃的SCP 至100 mL,混合均匀,制成1∶10 供试液,再取1∶10 供试液30 mL 至无菌锥形瓶中,加0.6 g/mL氯化钙溶液5 mL,加SCP 至300 mL,制成1∶100 供试液,待用。
2 结果与讨论
2.1 微生物限度计数方法适用性试验
2.1.1 试验样品溶液的制备
(1) 试验组:取5 支无菌试管,分别加入A 供试液9.9 mL,再分别加入表1 中菌液0.1 mL(含菌量为500 ~1 000 cfu),混匀待用(每1 mL 供试液中含不大于100 cfu 菌量)。
(2) 供试品对照组:取1 支无菌试管,加入A 供试液9.9 mL 和0.1 mLSCP,混匀待用。
(3)菌液对照组:取5 支无菌试管,分别加入SCP 9.9 mL,再分别加入表1 中菌液0.1mL(含菌量为500~1 000 cfu),混匀待用(每1mL 缓冲液中含不大于100 cfu 菌量)。
(4) 中和剂对照组:取5 支无菌试管,分别加入0.5 g/mL 硫酸镁溶液9.9 mL,再分别加入表1 中菌液0.1 mL(含菌量为500~1 000 cfu),混匀待用(每1 mL溶液中含不大于100 cfu 菌量)。
(5) 阴性对照组:取SCP 1 mL 注入薄膜过滤器的滤膜上,同法操作。
(6)取B 供试液同法进行试验。
(7)回收率计算公式:
2.1.2 检测
(1) 操作步骤:在薄膜过滤器上放置孔径为0.45 μm 的无菌滤膜,扣入无菌滤杯,在无菌滤杯中加入10 mL SCP 润湿滤膜,滤过。分别取上述混合后供试液(中和剂)1 mL 注入滤膜上,用SCP 冲洗,每次冲洗量为100 mL,分别冲洗5 次、7 次,过滤后,取出滤膜,菌面朝上贴于TSA 平板和SDA 平板上,每种菌平行制备两个平皿,倒置在培养箱中培养。
(2)培养基和培养条件
①TSA 培养时间:CMCC(B)26 003、CMCC(B)10 104、CMCC(B)63 501 菌株在30~35 ℃培养时间不超过3 d,CMCC(F)98 001、CMCC(F)98 003 菌株在30~35 ℃培养时间不超过5 d。
②SDA 培养时间:CMCC(F)98 001、CMCC(F)98 003 菌株在20~25 ℃培养时间不超过5 d。
2.1.3 结果要求
结果要求:试验组菌落数减去供试品对照组菌落数的值与菌液对照组菌落数的比值应在50%~200%范围内,中和剂对照组与菌液对照组菌落数的比值应在50%~200% 范围内,阴性对照组应无菌落生长。实验结果如表1、图1 和图2 所示。
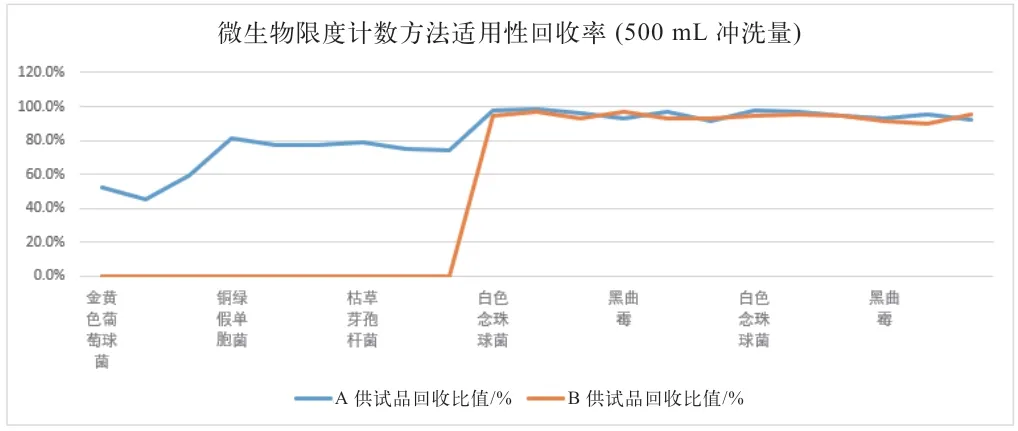
图1 500 mL 冲洗量回收率对比
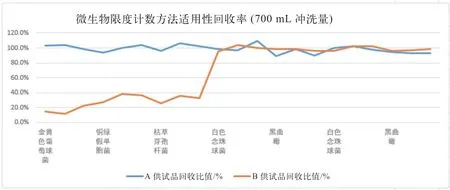
图2 700 mL 冲洗量回收率对比
由表1、图1 和图2 可直观地看到使用0.5 g/mL硫酸镁溶液作为中和剂,冲洗500 mL 时,金黄色葡萄球菌回收率有一次小于50%,不符合药典要求;铜绿假单胞菌和枯草芽孢杆菌的回收率在75%~82%之间,相比700 mL 冲洗量,回收率偏低。
使用0.6 g/mL 氯化钙溶液,冲洗量在500 mL 和700 mL 时,金黄色葡萄球菌、铜绿假单胞菌和枯草芽孢杆菌的回收率均低于50%,不符合药典要求。所以0.5 g/mL 硫酸镁溶液冲洗500 mL 和0.6 g/mL 氯化钙溶液无法完全中和盐酸环丙沙星抑菌性。
2.2 控制菌检查方法的适用性试验
2.2.1 增菌培养
(1)试验组:取A 供试液100 mL 于薄膜过滤器的滤膜上,滤过,用SCP 冲洗,每次冲洗量为100 mL,分别冲洗5 次、7 次,在最后一次冲洗液中加入1 mL不大于100 cfu 的大肠埃希菌菌液,过滤,取出滤膜,接种至200 mL TSB 培养基中,置培养箱(30~35 ℃)中培养18~24 h。
(2) 阳性对照组:取SCP 100 mL 注入薄膜过滤器的滤膜上,加入1 mL 不大于100 cfu 的大肠埃希菌菌液,过滤,用SCP 冲洗,同法操作。
(3) 供试品组:取A 供试液100 mL 于薄膜过滤器的滤膜上,同法操作。
(4)中和剂、阴性对照组:分别取100 mL 中和剂(0.5 g/mL 硫酸镁溶液) 和SCP 按照供试品组同法操作。
2.2.2 选择和分离
取上述TSB 培养物,轻摇混匀,各取1 mL 分别接种100 mL MCB 中,置培养箱(42~44 ℃)中培养24~48 h。取MCB 培养物分别划线接种至MCA 平板上,置培养箱(30~35 ℃)中培养18~72 h。
2.2.3 B 供试液操作方法
取B 供试液同A 供试液方法进行相同操作。
2.2.4 结果要求
试验组、阳性对照应检出大肠埃希菌,供试品组、中和剂组、阴性对照组不得检出大肠埃希菌。实验结果如表2 所示。
2.2.5 试验结果
A 供试液:使用0.5 g/mL 硫酸镁溶液作为中和剂,500 mL 和700 mL 时控制菌大肠埃希菌检测均能满足要求;B 供试液:使用0.6 g/mL 氯化钙溶液作为中和剂,试验组在冲洗量为500 mL 时未能检测出对应的大肠埃希菌,在冲洗量为700 mL 时可以检出。表明使用0.6 g/mL 氯化钙溶液作为中和剂,在500 mL时盐酸环丙沙星的抑菌效力没有完全除去,如果使用0.6 g/mL 氯化钙溶液作为中和剂,控制菌大肠埃希菌的检测,冲洗量要在700 mL 及以上。
2.3 讨论
2.3.1 供试液的制备方式
因喹诺酮类有较强的抑菌能力,本方法学采用加0.6 g/mL 氯化钙溶液和0.5 g/mL 硫酸镁溶液分别进行中和,用薄膜过滤法进行微生物限度计数方法学适用性试验。结果显示加0.6 g/mL 氯化钙溶液5 mL可中和一定的抑菌性,但需氧菌总数计数回收率低于50%,无法满足药典要求。若加大中和量,两者反应生成的螯合物在薄膜上形成阻断,影响薄膜孔径,对试验结果存在干扰,此现象在进行中和剂量选择试验时发现,故未进行后续适用性试验。
2.3.2 冲洗次数的确认
本研究对薄膜过滤的冲洗次数进行了验证,当冲洗次数为5 次时,微生物计数检查中的需氧菌总数有个别菌类回收率小于50%;控制菌检查使用0.6 g/mL氯化钙溶液时,冲洗5 次试验组无法检出对应的菌,不满足药典要求。
3 结语
本试验利用0.5 g/mL 的硫酸镁溶液中的镁离子与盐酸环丙沙星结构中3、4 位的羧基和酮羰基形成螯合物,中和其抑菌能力,采用薄膜过滤法,用pH 值为7.0 氯化钠-蛋白胨缓冲液冲洗过滤,可以有效地进行盐酸环丙沙星微生物限度计数和控制菌检测;利用0.6 g/mL 氯化钙溶液中的钙离子中和其抑菌能力,采用薄膜过滤法,可以有效地进行控制菌检测。
本试验方法的建立,提供了消除盐酸环丙沙星本身抑菌作用的方法,试验结果满足《中国药典》 2020 版通则1105、1106、1107 要求,可为喹诺酮类的微生物限度检查方法的研究提供借鉴思路。

