超声联合超声微泡介导的药物递送策略在肿瘤治疗中的研究进展
张敏洁,张小杉,施依璐,陈启,段莎莎,赵海玥,王雅晳*
1.内蒙古医科大学附属医院超声科,内蒙古 呼和浩特 010050;2.宁夏医科大学临床医学院,宁夏 银川 750004;*通信作者王雅晳 ttwangyaxi@163.com
化疗是恶性肿瘤的主要治疗方法,随着精准医疗的快速发展,新型靶向药物的出现改变了肿瘤治疗模式,开辟了靶向治疗时代。靶向递送系统以其低剂量选择性浓集的优越性减少非目标靶组织的积聚、毒副作用及耐药反应[1]。靶向治疗不仅能精准地“杀灭肿瘤”,而且能降低肿瘤进展风险,从而延长患者的生存期。本文对超声波生物效应、超声微泡的特征及超声靶向微泡破坏(ultrasound-targeted microbubble destruction,UTMD)技术在肿瘤治疗中的研究进展进行综述。
1 超声波的生物效应
超声是一种应用广泛、经济有效、非侵入性及实时安全的临床诊疗方法,已应用于解剖学、分子成像学和治疗学等诸多学科[2]。低频超声可利用由微泡组成的超声造影剂进行诊断和治疗,超声波与超声造影剂联合使用可发生不同的生物效应,主要为空化效应、热效应和声孔效应[3]。
1.1 超声波空化效应 空化效应是指微泡在超声波作用下产生周期性振荡、膨胀、坍塌或收缩以致内爆炸等一系列动力学过程[4]。根据微泡振荡幅度可分为2种振荡效应:①稳态空化,即在较低超声强度(0.3~3 W/cm2)下,因微泡稳定的振荡而引起,导致微泡收缩和扩张,在周围介质中诱导微流流动,通过机械推或拉与血管壁相互作用,增加内皮细胞之间的间隙,从而促进药物外渗[5-6];②惯性空化,又称瞬态空化,即在较高的超声强度(>3 W/cm2)下,由高压波触发导致微泡破裂,从而在周围介质中以冲击波、微喷流甚至自由基的形式产生强大的机械应力,导致附近的细胞膜穿孔,动态微泡运动和流体运动可以对周围组织施加机械力,从而产生可逆的细胞膜渗透,有助于药物进入组织[5-6]。
1.2 超声波热效应 当超声波照射组织时,组织中的分子出现振动而相互摩擦,超声波的能量会被组织吸收而转化为热能,这一组织吸收产热的过程称为超声波热效应[4]。因超声波的照射,辐照区域温度短暂升高,增加了细胞膜磷脂双分子层的流动性及通透性,从而有助于药物入胞。
1.3 超声波声孔效应 声孔效应主要依赖超声波空化效应产生的微气液流,在较高的压力(>100 kPa)下,气泡动力学变得猛烈,足以在细胞膜和血管壁表面上产生孔隙,而停止超声波辐照时,孔隙也会随之消失,这种瞬时、可逆的超声-微泡诱导的渗透性增强效应称为声孔术,一旦孔隙形成,便允许被输送的药物直接进入细胞质[3,6]。
2 超声微泡
超声微泡通常作为超声造影剂,通过改变组织的声学特性提高图像分辨率。根据微泡大小,超声微泡可分为微米级超声微泡和纳米级超声微泡,统称为超声微泡,其中纳米级微泡直径<1 μm[7]。尽管它们很小,但散射截面比红细胞的散射截面大9个数量级,这种高效的散射使心肌和其他器官,包括肝、脑和肾的灌注量得以量化[8]。气核是微泡最重要的部分,决定了微泡的回声能力,即微泡暴露在超声波频率下压缩、振荡并反射回特征回波的能力,当超声换能器或探头捕捉到反射回波时,即会产生独特的超声图像[6]。
与传统的超声微泡相比,纳米泡更小、稳定性更高、循环时间更长[9]。通过表面修饰,可负载治疗性基因或药物,通过增强的渗透性和保留效应在目标组织中蓄积,用于成像和治疗[10]。随着纳米泡材料的发展和制备方法不断优化,出现了一系列新型超声纳米材料[11],显著提高药物和基因的传递效率,拓展了超声微泡的适用范围。此外,超声微泡还具有增强组织和细胞膜通透性的能力,可增加细胞对药物的摄取,因此超声波驱动的微泡是极具潜质的药物输送方法[8]。
3 超声靶向微泡促进药物释放治疗肿瘤方面的进展
随着生物医学的发展,微泡可作为一个多功能平台将各种治疗性药物输送到疾病部位[9]。UTMD是一种高效、安全的新兴技术,可有效增强药物在靶区域的作用效果,其机制主要依赖空化效应、热效应和声孔效应,通过超声场刺激靶区内携带药物的气泡,使其膨胀和坍塌,从而释放药物[12]。图1为UTMD技术示意图。UTMD介导的药物传递系统具有以下优点[7]:①良好的安全性;②非侵入性;③通过超声成像和微泡传递药物,实现了对目标组织诊断和治疗的一体化;④具有明显的卫生经济学优势,与CT和MRI等其他医学成像方法相比,超声检查成本相对较低;⑤靶向性好,通过抗原-抗体或配体-受体的特定结合,微泡可有效聚集到靶器官或组织上,使药物发挥更好的药理作用,同时减少药物对非靶组织的毒性;⑥作用时间长,超声照射靶组织后,可通过空化效应、热效应和声孔效应促进微泡入胞,延长了其在目标组织中的停留时间。基于以上优势,近年来这项技术尤其在肿瘤治疗方面得到广泛研究[2,13]。
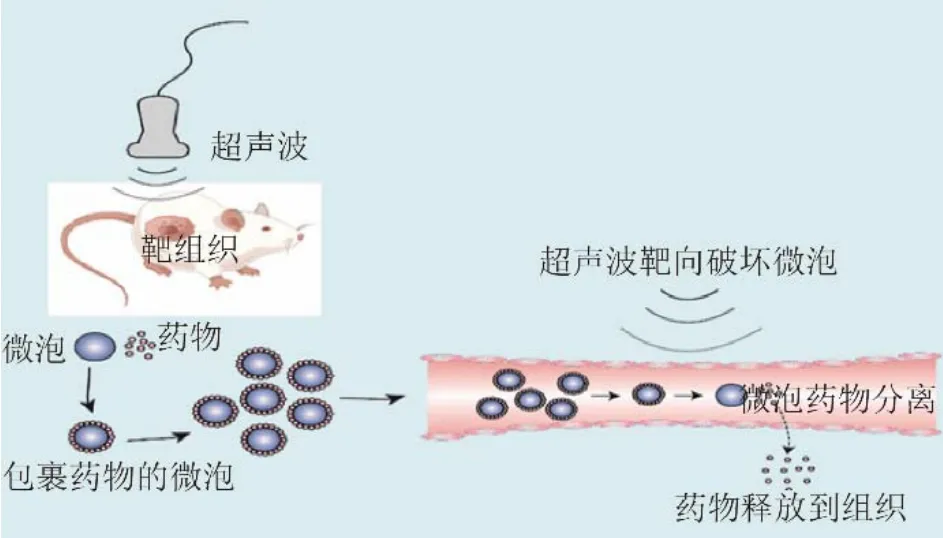
图1 UTMD技术示意图。在UTMD作用下,包裹药物的微泡可以透血管屏障进入靶组织
3.1 UTMD打开血-脑屏障用于治疗脑肿瘤 在脑肿瘤治疗中,特别是胶质母细胞瘤,克服血-脑屏障将药物输送到肿瘤部位是目前治疗本病中面临的主要挑战。近年来,研究者致力于开发新的方法将治疗剂量的药物输送到大脑中用于癌症治疗。Tran等[14]研究证实UTMD能有效增加血-脑屏障的渗透性,从而促进治疗性抗体在肿瘤组织中的渗透。Amate等[15]采用小鼠双侧皮下移植瘤模型,研究UTMD对抗肿瘤单克隆抗体摄取的影响。超声前经尾静脉注射抗体和微泡,并对唯一的单侧肿瘤进行超声靶向治疗,结果显示超声作用侧的抗体浓度显著高于非超声作用侧肿瘤的抗体浓度。
3.2 UTMD在肝癌中的应用 肝细胞肝癌是一种侵袭性很强的恶性肿瘤,通常对传统化疗耐药。由于肝细胞肝癌倾向于高度血管化,使超声介导的微泡破坏成为一种非常有用的治疗药物输送方法[5]。因此,诸多研究探索了UTMD技术对肝细胞肝癌的疗效促进作用[16]。Kang等[17]将载有多西紫杉醇脂质微泡用于兔VX2原位肝癌模型的治疗,并使用UTMD促进脂质微泡在肿瘤组织中的渗透和释放,结果显示与未使用超声微泡治疗的对照组相比,实验兔的生存时间延长了13.2 d,提高了实验兔的生存期。Eisenbrey等[18]为研究UTMD联合经动脉放射栓塞术(transarterial radioembolization,TARE)治疗肝细胞肝癌的安全性和疗效,将TARE治疗的肝细胞肝癌患者随机分为两组,分别进行TARE或TARE联合UTMD治疗,最终UTMD联合TARE的方法具有可行性,在该研究的患者中具有较好的安全性,并且可以改善患者的治疗反应。
3.3 UTMD在乳腺癌中的应用 UTMD治疗乳腺癌的主要挑战是将药物渗透到致密的乳腺组织中。在乳腺癌肿瘤(2LMP)荷瘤小鼠中,Sorace等[19]利用超声介导的微泡破坏(1.0 MHz换能器,脉冲重复周期为5 s)增强化疗药物紫杉醇的输送,与无超声辐照的单纯化疗相比,超声微泡联合化疗可使癌细胞死亡增加约50%。董虹美等[20]观察超声辐照微泡造影剂对米托蒽醌杀伤人乳腺癌细胞MCF-7作用的影响,测定用药各组细胞内米托蒽醌的含量,发现给予超声辐照微泡造影剂组细胞含量明显高于对照组,表明低频超声辐照可促进化疗药物进入肿瘤细胞内,增强化疗药物对肿瘤细胞的杀伤作用,而低频超声辐照微泡可进一步增强该效应。Tang等[21]通过建立体内乳腺癌模型和体外培养乳腺癌干细胞探讨UTMD介导的SOCS3基因疗法对乳腺癌干细胞生物学特性和上皮间质转化的影响,结果显示UTMD介导的SOCS3基因疗法的治疗效果更好,进一步为UTMD介导的乳腺癌的基因治疗提供了依据。
3.4 UTMD技术在卵巢癌中的应用 通过手术尽可能切除高危组织是提高卵巢癌治疗成功率的有效策略。然而,晚期卵巢癌的手术治疗常会导致严重的术后并发症,且对患者生存产生负性影响[22]。因此,有学者开始探索UTMD在卵巢癌治疗中的疗效。Xu等[23]合成一种靶向微泡剂,用于UTMD介导的针对人卵巢癌OVCA-433细胞Livin基因治疗的shRNA,结果显示超声介导的靶向微泡可以提高shRNA-Livin在卵巢癌细胞中的转染率,证实UTMD是一种有效的抑制卵巢癌细胞增殖和诱导细胞凋亡的治疗策略。
3.5 UTMD技术在眼部肿瘤中的应用 眼科超声是眼科临床的标准成像技术之一,在眼部疾病诊断中发挥重要作用,UTMD在眼部肿瘤中的治疗也已得到广泛探索[24]。超声微泡主要通过以下机制对眼部肿瘤进行治疗:①打开血-视网膜屏障,使载有治疗药物的微泡进入肿瘤组织中;②促进肿瘤细胞对微泡的摄取,并使药物从微泡中释放而发挥抗肿瘤作用。Lee等[25]利用UTMD促进视网膜母细胞瘤细胞Y79对阿霉素的摄取,从而显著增强了阿霉素对视网膜母细胞瘤细胞Y79的杀伤作用。
UTMD除在上述肿瘤治疗中得到广泛研究外,在甲状腺癌[26]、骨骼肌[27]、心肌缺血-再灌注损伤[28]和血管平滑肌疾病[29]等其他肿瘤和非肿瘤疾病治疗中也有研究和探索。
4 总结与展望
近年来,随着计算机高速成像技术的应用,超声引导下的微泡和颗粒声穿孔的诊疗一体化技术得到长足发展,这些技术为超声微泡介导的药物靶向渗透和释放在肿瘤等疾病治疗中的应用奠定了良好的基础,同时引导了更多新型多功能试剂的开发和研发。循着当代医疗减毒增效的个体化精准治疗理念与方向,超声介导的局部药物靶向递送得到广泛探索和深入地临床前研究,并取得了极具应用前景和转化价值的结果,尤其在化疗、免疫治疗、基因治疗和声动力学等肿瘤综合治疗中具有明显优势。
因此,针对多年来新基因和药物治疗领域面临的一系列挑战和缺陷,尤其是药物或治疗性基因输送的有效性和安全性问题,超声微泡及UTMD技术的深入发展无疑为此类问题的解决提供了有效方案。

