12~18 岁孤独症谱系障碍患者皮层下脑结构改变
徐滢莹,孙秉玺,吉兆正,苏醒,李雪*,刘靖*
1.北京大学第六医院放射科,北京大学精神卫生研究所,国家卫生健康委员会精神卫生学重点实验室(北京大学),国家精神心理疾病临床医学研究中心(北京大学第六医院),北京 100191;2.北京大学第六医院儿童心理卫生中心,北京大学精神卫生研究所,国家卫生健康委员会精神卫生学重点实验室(北京大学),国家精神心理疾病临床医学研究中心(北京大学第六医院),北京 100191; *通信作者 刘靖 ljyuch@bjmu.edu.cn;李雪 lixue@bjmu.edu.cn
孤独症谱系障碍(autism spectrum disorder,ASD)是一种于儿童早期起病的神经发育障碍,核心症状为社交交流和社交互动缺陷,受限的、重复的行为模式、兴趣或活动。ASD患病率日益增高,常呈长期、慢性、终生性病程,是导致青少年精神残疾的最主要疾病。目前,ASD的病因和发病机制尚未明确,治疗方法疗效欠佳,积极探讨其病因和发病机制对探讨更加有效的治疗方法、改善患者预后具有重要意义。
影像学技术是探讨ASD病因和发病机制的重要方法。ASD患者存在脑发育异常,包括皮层灰质和皮层下结构的发育异常,其纹状体、额叶和颞叶皮层中与认知和情感相关的区域也存在形态改变[1]。但目前对于不同年龄段ASD的脑结构发育特征研究尚不充分。青少年时期是大脑发育的关键时期,且皮层下脑结构的异常可能与ASD核心症状密切相关[2-3],而目前关于青少年ASD皮层下脑区结构特点及其发育特征尚未明确。部分研究显示青春期ASD患者皮层下脑结构可能具有不同的发育模式[3-6]。本研究拟探索12~18岁ASD患者皮层下脑结构的特点,并对异常脑区随年龄的变化特点进行分析。
1 资料与方法
1.1 研究对象 ASD组:招募2013年3月—2021年1月北京大学第六医院的ASD患者。纳入标准:①由2名青少年精神科副主任及主任医师根据美国精神障碍诊断与统计手册第5版ASD诊断标准[7]诊断为ASD;②年龄12~18岁;③右利手。排除标准:①使用学龄期儿童情感障碍和精神分裂问卷诊断共患其他精神障碍;②严重躯体疾病、神经系统疾病及脑外伤;③曾使用任何精神药物;④体内有金属植入物,包括不可取出的假牙;⑤其他原因不能配合完成检查。
正常对照组:招募2016年6月—2020年1月的普通中小学学生。纳入标准:①年龄12~18岁;②右利手。排除标准:①目前或既往患精神障碍;②严重躯体疾病、神经系统疾病及脑外伤;③曾使用任何精神药物;④体内有金属植入物,包括不可取出的假牙;⑤其他原因不能配合完成检查。
共纳入ASD 102例、正常对照42例。本研究经本院伦理委员会批准[〔2013〕伦审第(10)号、〔2016〕伦审第(19)号、〔2016〕伦审第(23)号、〔2017〕伦审第(49)号]。受试者和家长均同意参加本研究,共同签署知情同意书。
1.2 仪器与方法 采用2台GE Discovery 750 3.0T MRI,8通道相控阵头线圈。受试者平卧,固定头部。扫描参数,第一台3D T1 SPGR:TR 4.78 ms,TE 2.02 ms,翻转角15°,扫描范围24 mm×24 mm,矩阵240× 240,层厚1.0 mm;第二台3D T1 SPGR:TR 6.7ms,TE 3.1 ms,翻转角12°,扫描范围25.6 mm×25.6 mm,矩阵246×246,层厚1.0 mm。
1.3 数据后处理 采用freeSurfer 7.4(https://www.freesurfer.net/)软件进行数据预处理。通过去颅骨、偏置场校正和灰白质分割获得结构MRI数据,配准获取脑部测量数据。基于MNI标准空间定义的分割模板可将灰质和深部核区域的不同脑区进行分割。使用Aseg分割模板提取、测量皮层下结构的体积,包括尾状核、壳核、苍白球、丘脑、海马、杏仁核、伏隔核和胼胝体。
1.4 统计学方法 使用SPSS 25.0软件。符合正态分布的计量资料以±s表示,组间比较采用独立样本t检验;不符合正态分布的计量资料以M(Qr)表示,组间比较采用Mann-WhitneyU检验。计数资料以例数表示,组间比较采用χ2检验。ASD组与正常对照组皮层下脑区的体积比较采用协方差分析,控制年龄、性别、总灰质体积及幕上体积。按照12~13岁、14~15岁和16~18岁进一步分组,采用方差分析比较存在组间差异的脑区体积在各组受试者不同年龄段间的差异。采用协方差分析,控制性别、总灰质体积及幕上体积,比较存在组间差异的脑区在各个年龄段的两组受试者间的差异。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 ASD组和正常对照组年龄、性别、总灰质体积及幕上体积差异均无统计学意义(P均>0.05),见表1。
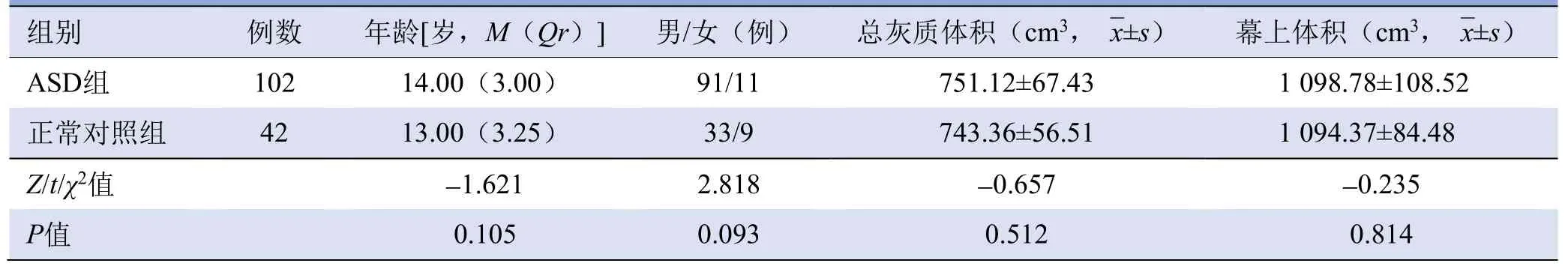
表1 ASD组与正常对照组一般资料比较
2.2 12~18岁ASD组和正常对照组皮层下脑区体积比较 ASD组右侧尾状核、右侧苍白球、左侧海马以及胼胝体前部体积均大于正常对照组,差异有统计学意义(P均<0.05),见表2、图1。两组间其余皮层下脑区差异均无统计学意义(F=0.093~3.861,P均>0.05)。
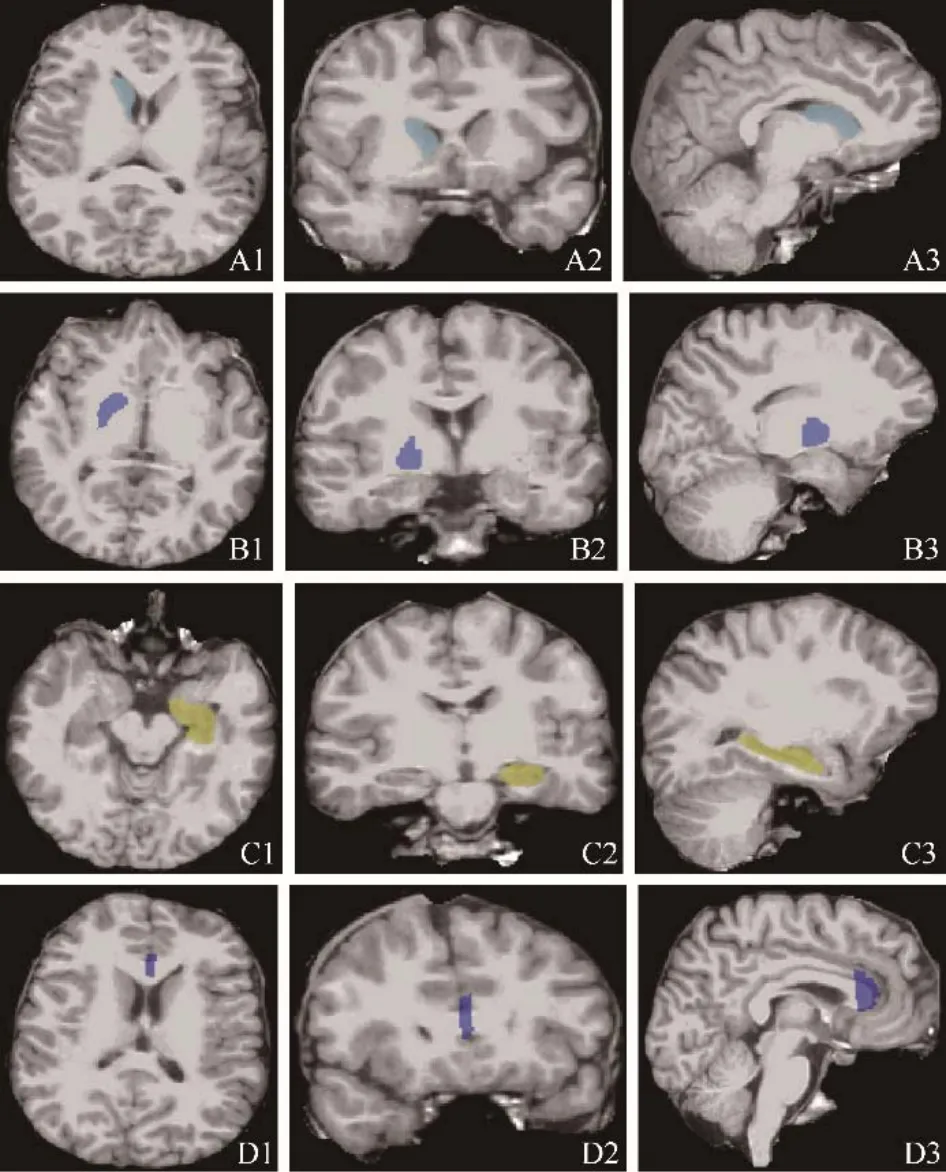
图1 12~18岁ASD组较正常对照组皮层下体积增大的脑区。A.右侧尾状核;B.右侧苍白球;C.左侧海马;D.胼胝体前部;1.轴位;2.冠状位;3.矢状位
表2 ASD组与正常对照组皮层下存在差异的脑区体积比较(cm3,±s)

表2 ASD组与正常对照组皮层下存在差异的脑区体积比较(cm3,±s)
组别例数右侧尾状核右侧苍白球左侧海马胼胝体前部ASD组 102 4.13±0.58 2.31±0.26 4.45±0.43 0.86±0.20 0.83±0.17 F值 4.522 5.955 7.191 5.326正常对照组42 3.96±0.51 2.19±0.24 4.22±0.33 P值0.035 0.016 0.008 0.022
2.3 不同年龄段受试者存在组间差异脑区的体积比较正常对照组不同年龄组间胼胝体前部的体积差异有统计学意义(P=0.01),而ASD组不同年龄组间胼胝体前部的体积差异无统计学意义(P>0.05),见表3。两组右侧尾状核、右侧苍白球、左侧海马在不同年龄段的受试者间差异无统计学意义(右侧尾状核:ASD组F=0.610、对照组F=2.325;右侧苍白球:ASD组F=0.037、对照组F=0.060;左侧海马:ASD组F=1.491、对照组F=1.264;P均>0.05)。
表3 两组内不同年龄段受试者间胼胝体前部体积比较(cm3,±s)
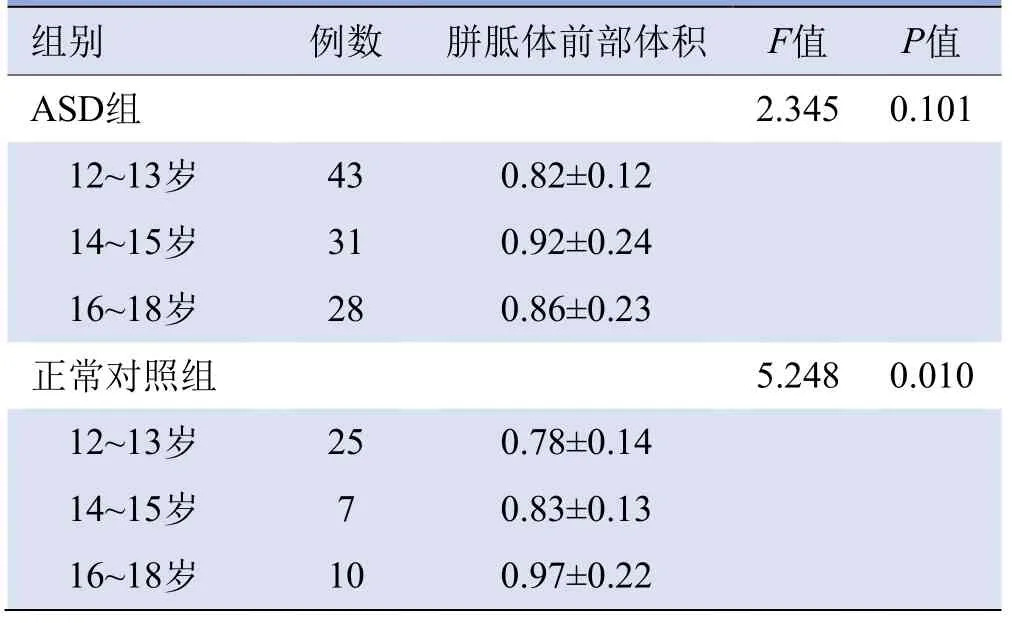
表3 两组内不同年龄段受试者间胼胝体前部体积比较(cm3,±s)
组别例数胼胝体前部体积F值P值ASD组 2.345 0.101 12~13岁43 0.82±0.12 14~15岁31 0.92±0.24 16~18岁28 0.86±0.23正常对照组 5.248 0.010 12~13岁25 0.78±0.14 14~15岁7 0.83±0.13 16~18岁10 0.97±0.22
2.4 不同年龄段的两组受试者胼胝体前部体积比较胼胝体前部体积在各个年龄段的两组被试间差异无统计学意义(P>0.05),见表4。其中,12~13岁、14~15岁两组比较P均<0.1,且14~15岁两组比较P接近0.05。
表4 不同年龄段的两组受试者间胼胝体前部体积比较(cm3,±s)
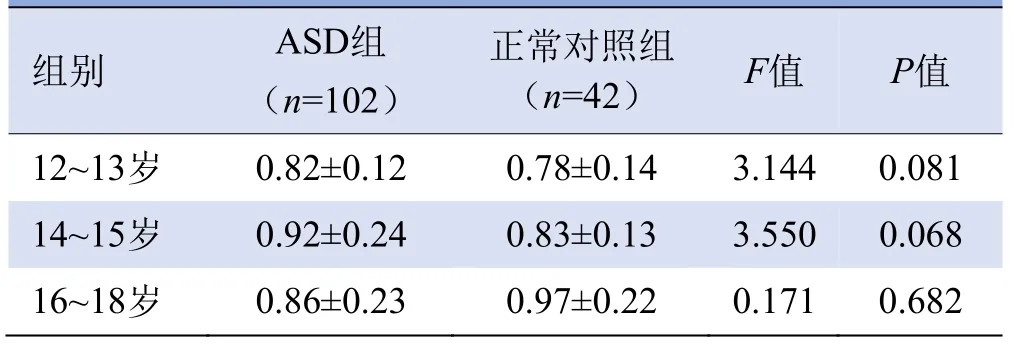
表4 不同年龄段的两组受试者间胼胝体前部体积比较(cm3,±s)
组别ASD组正常对照组(n=102)(n=42)F值P值12~13岁 0.82±0.12 0.78±0.14 3.144 0.081 0.068 16~18岁 0.86±0.23 0.97±0.22 0.171 0.682 14~15岁0.92±0.24 0.83±0.13 3.550
3 讨论
3.1 12~18岁ASD患者皮层下脑结构改变 本研究结果显示,与正常对照组相比,12~18岁ASD患者右侧尾状核及右侧苍白球体积显著增大,提示青少年ASD患者存在基底节区发育异常,与Turner等[8]的研究结果一致。青少年ASD基底节发育异常的原因尚未明确,可能是其与其他大脑区域的异常连接增加导致代偿性的体积增大[4,9]。本研究未探讨青少年ASD基底节区发育异常与ASD症状的关系。既往关于脑功能的研究显示,奖赏网络主要负责躯体执行功能,而基底节区是奖赏网络的主要组成部分,是刻板行为发生的核心区域,其功能异常与多巴胺的刺激有关[3,10-11]。另外,基底节区参与整合、调节感觉信息,在学习、认知和社交中发挥重要作用,如尾状核、壳核的形态改变与社交及沟通障碍密切相关[4,12]。因此基底节区相应结构的异常改变可能是ASD患者核心临床表现的重要神经病理学机制之一。
本研究中12~18岁ASD患者与正常对照组相比,左侧海马体积显著增大,与Xu等[5]研究一致。青少年时期ASD的海马体积较正常对照增大,海马体积增大可能是由于病理改变或者依赖海马连接的相关功能提高所致[5,13-14]。本研究未探索青少年ASD海马发育异常与ASD症状的关系。结合既往研究,刻板行为、执行功能、空间推理、工作记忆和情景记忆等多种功能均依赖于海马[4,10,15-16],ASD存在以上功能受损,对于海马结构和功能的研究将有助于揭示ASD的病理机制。Chen等[17]的研究也显示,海马可能是ASD早期治疗的重要靶点。
本研究显示,与正常对照组相比,12~18岁ASD患者胼胝体前部体积显著增大。胼胝体是连接两个大脑半球、协调半球间信息最大的白质通路,其体积及微观结构异常可能导致ASD的认知障碍、社交障碍等,与ASD临床症状严重程度的相关性较高[18]。胼胝体是ASD最常受累的结构之一,关于ASD胼胝体形态的变化,既往研究结果不一致。Prigge等[6]研究显示青少年ASD胼胝体体积增大,与本研究结果一致;而Frazier等[19]研究认为青少年ASD的胼胝体体积及面积较正常对照组减小,与本研究结果不一致。这可能与不同研究纳入样本量大小、受试者年龄大小、性别等不同有关,也可能与胼胝体的分段方式不同有关。
3.2 12~18岁ASD患者皮层下脑结构随年龄变化的特点 本研究结果显示,正常对照组各年龄段间胼胝体前部体积有显著差异,而12~18岁ASD组各年龄段间胼胝体前部体积无显著差异,提示12~18岁的ASD组胼胝体前部随年龄改变呈现与正常对照组不同的生长发育特征。进一步分析显示,虽然胼胝体前部体积在各年龄段的两组受试者间无显著差异,但12~13岁和14~15岁两组间P值均在0.05~0.1之间,考虑增大样本量可能可以看到两组间的差异,有必要增加样本量进一步探讨。
本研究结果显示,正常对照组12~18岁胼胝体前部体积随年龄增长而增加。Vannucci等[20]的研究显示青春期胼胝体生长发育轨迹与本研究结果一致。但ASD患者的胼胝体生长发育轨迹不同。Frazier等[19]与Zhang等[21]的研究显示,ASD儿童早期胼胝体体积明显增大,该现象是由于神经轴突过度生长所致,该时期胼胝体体积及神经轴突的数量均明显增加。这种过度生长可能是一种代偿机制,即大脑半球间轴突连接效率低下导致轴突细胞代偿性增殖[22]。而在学龄期,当正常儿童胼胝体快速发育时,ASD儿童的胼胝体体积开始缩小,从儿童后期持续至成年,原因尚未明确,可能是早期皮层发育异常的结果,或是持续的神经生物学破坏的结果等[23]。本研究结果显示12~18岁ASD患者胼胝体前部可能具有异常的生长发育模式,提示ASD患者大脑半球间连接可能存在异常,从而导致依赖不同大脑区域间信息协调整合的神经功能异常,这也许是ASD的重要神经病理基础之一。
另外,本研究中ASD患者胼胝体前部随年龄改变与正常对照组呈现不同的生长发育特征,与刘梦婉等[3]研究中ASD大脑的生长发育模式一致。与健康人群相比,ASD大脑发育在整个生命周期具有不同的生长轨迹,包括生命早期大脑生长过度,青少年早期大脑生长开始减缓甚至停滞,青少年晚期至成年开始过早的甚至加速的衰退[3]。青少年时期作为“拐点”,是ASD大脑生长发育的关键时期。
3.3 本研究的局限性 为单中心横断面研究,样本量较小;且仅关注皮层下部分脑结构,未关注其他脑区。鉴于ASD的异质性,未来应进行大样本多中心纵向研究,并增加脑区,以进一步验证、扩展研究结果。
总之,本研究对12~18岁青少年ASD皮层下结构进行探索,发现与正常对照相比,12~18岁青少年ASD患者的右侧尾状核、右侧苍白球、左侧海马以及胼胝体前部发育异常,并且胼胝体前部随年龄改变呈现不同的生长发育特征,证实了既往研究中关于青少年ASD皮层下结构发育的发现,提示这些脑区可能参与ASD的发病机制,加深对ASD患者脑发育特点的认识。

